Southern印跡雜交(Southern blot)是1975年由英國人southern創建,是研究DNA圖譜的基本技術,在遺傳病診斷、DNA圖譜分析及PCR產物分析等方面有重要價值。
基本介紹
- 中文名:Southern印跡雜交
- 外文名:Southern blot
- 創建:1975年
- 定義:研究DNA圖譜的基本技術
- 地位:遺傳病診斷有重要作用
- 用途:進行基因組DNA特定序列定位
基本概念
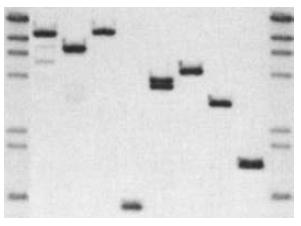
發明人

方法步驟


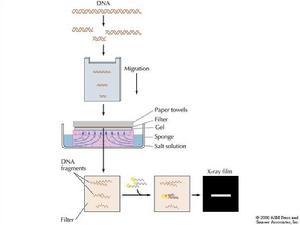
DNA印跡技術一般指本詞條
Southern印跡雜交(Southern blot)是1975年由英國人southern創建,是研究DNA圖譜的基本技術,在遺傳病診斷、DNA圖譜分析及PCR產物分析等方面有重要價值。






同義詞 DNA印跡技術一般指DNA印跡法 Southern印跡法(Southern Blot)是將基因組 DNA經限制性內切酶酶解、瓊脂糖凝膠電泳分離,使DNA片段按分子量大小排列在瓊脂糖凝膠上。經鹼處理凝膠使DNA變性(使雙鏈DNA變成單鏈),通過具有一定鹽離子濃度...
Northern印跡雜交 Northern印跡雜交(Northern blot)。這是一種將RNA從瓊脂糖凝膠中轉印到硝酸纖維素膜上的方法。DNA印跡技術由Southern於1975年創建,稱為Southern印跡技術,RNA印跡技術正好與DNA相對應,故被稱為Northern印跡雜交,與此原理...
Southern印跡,又稱DNA印漬術,是將存在於凝膠中的DNA分子轉移(印漬)於固定化介質上並加以檢測分析的技術。DNA轉移至固相支持體的過程中,各個DNA片段的相對位置保持不變,用放射性標記的DNA與固著於濾鏡上的DNA雜交,經放射自顯影鎖定...
印跡技術是指將待測核酸分子結合到一定固相支持物上的方法。southern印跡,將電泳分離的DNA片段轉移到一定的固相支持物上的過程。作品概念 印跡技術是指將待測核酸分子結合到一定固相支持物上的方法。southern印跡,將電泳分離的DNA片段轉移...
DNA 印跡法是2019年公布的結核病學名詞。定義 將經過凝膠電泳分離的DNA轉移到適當的膜(如硝酸纖維素膜、尼龍膜等)上的技術。可以採用毛細管作用或電泳法轉移,轉移到膜上的DNA再與標記的特異核酸探針雜交等進行分析。出處 《結核病學...
Southern印跡雜交(Southern blot)是1975年由英國人southern創建,是研究DNA圖譜的基本技術,在遺傳病診斷、DNA圖譜分析及PCR產物分析等方面有重要價值。基本概念 Southern印跡雜交是進行基因組DNA特定序列定位的通用方法。其基本原理是:具有...
Northern印跡雜交(Northern blot)。這是一種將RNA從瓊脂糖凝膠中轉印到硝酸纖維素膜上的方法。DNA印跡技術由Southern於1975年創建,稱為Southern印跡技術,RNA印跡技術正好與DNA相對應,故被稱為Northern印跡雜交,與此原理相似的蛋白質印跡...
高分子量DNA用限制性內切酶消化後,經瓊脂糖凝膠電泳,使不同大小的DNA片段分離,並直接在膠上變性,然後利用毛細作用(現常用電轉移技術),將它們轉移到硝酸纖維膜或尼龍纖維膜上,這一過程稱為吸印。膜上的DNA被固定後與核酸探針(DNA...
自1975年建立印跡法以後,套用較成熟的方法有Southern、Northern和Western法,它們分別用於DNA、RNA和蛋白質樣品的分析。用電泳轉移印跡和真空轉移印跡技術可提高印跡效率,縮短印跡轉移時間。具體套用 Alwine等將類似方法用於RNA印跡,被戲稱為...
利用限制內切酶消化基因組DNA時,會產生大小不同的DNA片段,電泳後通過Southem印跡雜交,將這些大小不同的DNA片段轉移到硝酸纖維膜或尼龍膜上,然後用特異的探針進行雜交,最後通過放射性自顯影或其他顯色技術顯示雜交結果,從而揭示出DNA的...
核酸雜交技術是一種分子生物學的標準技術,用於檢測DNA或RNA分子的特定序列(靶序列)。基本信息 DNA或RNA先轉移並固定到硝酸纖維素或尼龍膜上,與其互補的單鏈DNA或RNA探針用放射性或非放射性標記。在膜上雜交時,探針通過氫鍵與其互補...
根據異源單鏈核酸分子間因結構互補發生共價鍵結合,能形成互補雜合雙鏈,而進行分子遺傳學研究的一種技術。雙鏈核酸分子加熱至80~100℃時,鹼基對之間的氫鍵斷開,形成兩條單鏈,這一過程叫作核酸的變性作用或解鏈。變性的核酸分子慢慢...
技術套用 1)生物學方面的套用 分子印跡技術所使用的生物大分子,最早就是一些蛋白質。例如:牛血色素、牛血清蛋白、肌酸激酶、溶解酵素等。Ogiso等製備了針對特異性DNA片段的分子印跡聚合物凝膠,實現了對單個鹼基突變進行識別與分離。Liu...
1.核酸分子雜交技術 套用該技術可對特定DNA或RNA序列進行定性或定量檢測,包括Southern印跡雜交、Northern印跡雜交、點雜交、原位雜交等。(1)Southern印跡雜交:Southern印跡雜交是一種利用硝酸纖維素膜或尼龍膜吸附DNA的功能進行雜交的技術...
DNA印跡技術由Southern於1975年創建,稱為Southern印跡技術。RNA印跡技術正好與DNA相對應,故被稱為Northern印跡雜交,與此原理相似的蛋白質印跡技術則被稱為westernblotting。Northern印跡雜交的RNA吸印與Southern印跡雜交的DNA吸印方法類似,...
核酸雜交(Hybridization): 互補的核苷酸序列(DNA與DNA、DNA與RNA、RNA與RNA等)通過Watson-Crick鹼基配對形成非共價鍵,從而形成穩定的同源或異源雙鏈分子的過程,稱為核酸分子雜交技術,又稱核酸雜交。原理 其原理是核酸變性和復性理論...
技術種類 分子診斷是當代醫學發展的重要前沿領域之一,其核心技術是基因診斷,常規技術包括:(1)聚合酶鏈式反應(PCR);(2)DNA測序(DNA sequencing);(3)螢光原位雜交技術(FISH);(4)DNA印跡技術( DNA blotting );(5)...
包括定時定量聚合酶鏈反應、多重連結探針擴增技術、多重可擴增探針雜交技術等。2.基於雜交技術的方法 包括原位免疫螢光、Giemsa顯帶、Southern印跡技術、比較基因組雜交技術、全基因組掃描的方法等。3.基於晶片技術的方法 包括晶片比較基因...
