基本介紹
- 中文名:細胞凋亡
- 外文名:Apoptosis
細胞凋亡,研究歷史,概念解釋,細胞凋亡與程式性死亡,細胞凋亡與壞死的區別,形態學變化,生物化學變化,過程機理,啟動階段,執行,Caspase活化機制,Caspase效應機制,凋亡抑制物,破壞細胞結構,調節蛋白功能,調節,凋亡抑制分子,Bcl-2家族,醫學套用,免疫學,臨床醫學,線粒體,線粒體跨膜電位的耗散與細胞凋亡的密切關係,通透性轉變,PT孔道的性質,PT孔道開關,線粒體作用,檢測,早期檢測,晚期檢測,mRNA檢測,形態學檢測,細胞凋亡檢測,意義,
細胞凋亡
人體內的細胞注定是要死亡的,有些死亡是生理性的,有些死亡則是病理性的,有關細胞死亡過程的研究,已成為生物學、醫學研究的一個熱點。人們已經知道細胞的死亡起碼有兩種方式,即細胞壞死與細胞凋亡(apoptosis)。細胞壞死是早已被認識到的一種細胞死亡方式,而細胞凋亡則是逐漸被認識的一種細胞死亡方式。
細胞凋亡是細胞的一種基本生物學現象,在多細胞生物去除不需要的或異常的細胞中起著必要的作用。它在生物體的進化、內環境的穩定以及多個系統的發育中起著重要的作用。細胞凋亡不僅是一種特殊的細胞死亡類型,而且具有重要的生物學意義及複雜的分子生物學機制。
凋亡是多基因嚴格控制的過程。這些基因在種屬之間非常保守,如Bcl-2家族、caspase家族、癌基因如C-myc、抑癌基因P53等,隨著分子生物學技術的發展對多種細胞凋亡的過程有了相當的認識,但是迄今為止凋亡過程確切機制尚不完全清楚。而凋亡過程的紊亂可能與許多疾病的發生有直接或間接的關係。如腫瘤、自身免疫性疾病等,能夠誘發細胞凋亡的因素很多,如射線、藥物等。
人的部分生理結構屬於自然凋亡,如人的有尾階段,尾部在發育過程中自動凋亡。
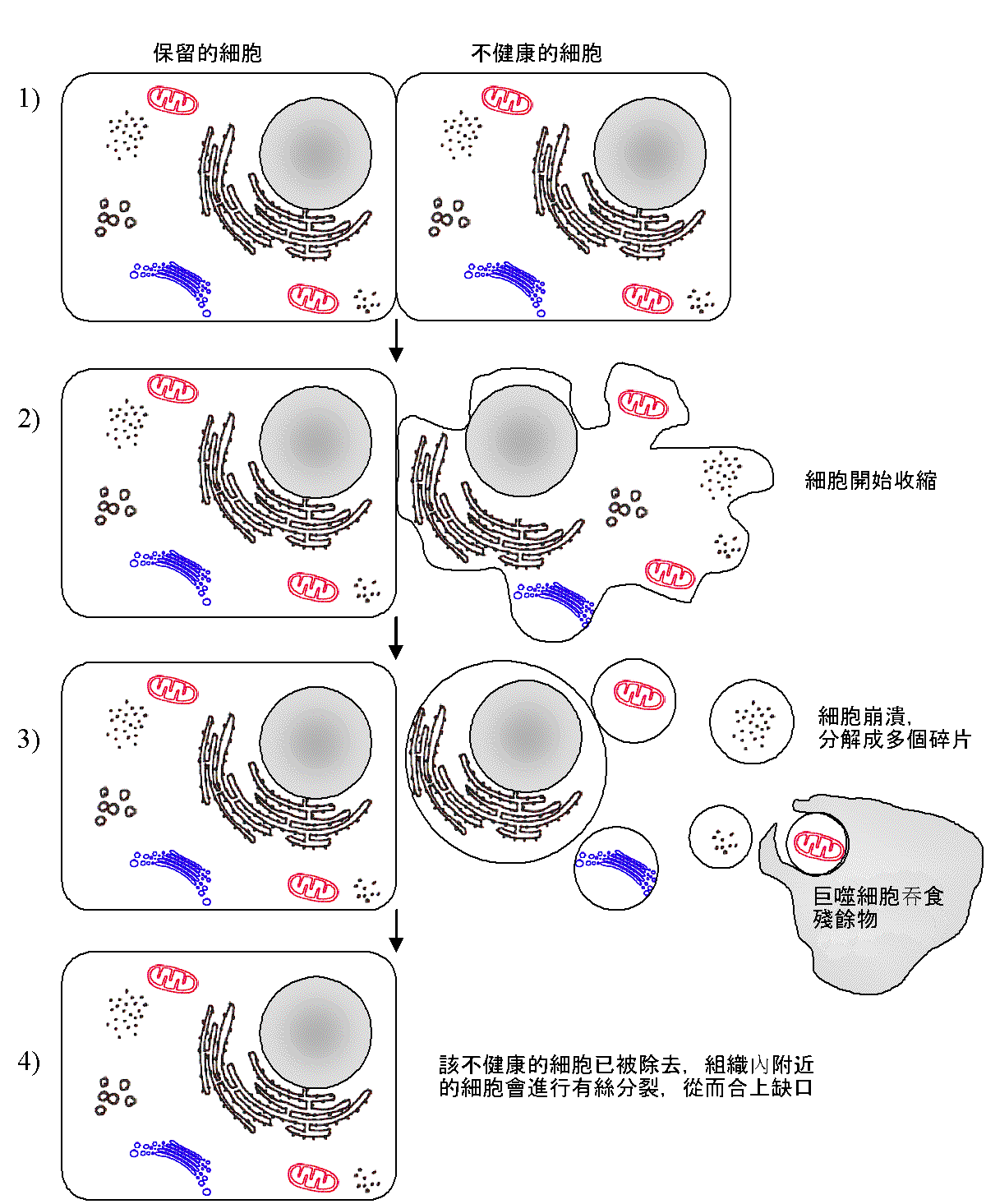 組織中細胞凋亡過程
組織中細胞凋亡過程研究歷史
1. 凋亡概念的形成 1965年澳大利亞科學家發現,結紮鼠門靜脈後,電鏡觀察到肝實質組織中有一些散在的死亡細胞,這些細胞的溶酶體並未被破壞,顯然不同於細胞壞死。這些細胞體積收縮、染色質凝集,從其周圍的組織中脫落並被吞噬,機體無炎症反應。1972年Kerr等三位科學家首次提出了細胞凋亡的概念,宣告了對細胞凋亡的真正探索的開始,在此之前,關於胚胎發育生物學、免疫系統的研究,肝細胞死亡的研究都為這一概念的提出奠定了基礎。
2.細胞凋亡的形態學及生物化學研究階段(1972-1987)。
1)利用光鏡和電鏡對形態學特徵進行了詳細的研究。
4)鈣離子變化,細胞內鈣離子濃度的升高是細胞發生凋亡的一個重要條件。
5)內源性核酸內切酶:細胞發生凋亡是需要這種核酸內切酶參與的。
3.細胞凋亡的分子生物學研究階段。
1)與細胞凋亡的相關基因及調控。
2)細胞凋亡的信號轉導。
3)與細胞凋亡的各種分子及其相互作用及相互關係。
4.細胞凋亡的臨床套用基礎研究階段 細胞凋亡的研究,其生命力在於最終能夠有利於疾病機制的闡明,以及新療法的探索及問世。
概念解釋
細胞凋亡與程式性死亡
其實從嚴格的詞學意義上來說,細胞程式性死亡(PCD)與細胞凋亡是有很大區別的。細胞程式性死亡的概念是1956年提出的,PCD是個功能性概念,描述在一個多細胞生物體中某些細胞死亡是個體發育中的一個預定的,並受到嚴格程式控制的正常組成部分。例如蝌蚪變成青蛙,其變態過程中尾部的消失伴隨大量細胞死亡,高等哺乳類動物指間蹼的消失、顎融合、視網膜發育以及免疫系統的正常發育都必須有細胞死亡的參與。這些形形色色的在機體發育過程中出現的細胞死亡有一個共同特徵:即散在的、逐個地從正常組織中死亡和消失,機體無炎症反應,而且對整個機體的發育是有利和必須的。因此認為動物發育過程中存在的細胞程式性死亡是一個發育學概念,而細胞凋亡則是一個形態學的概念,描述一件有著一整套形態學特徵的與壞死完全不同的細胞死亡形式。但是一般認為凋亡和程式性死亡兩個概念可以互動使用,具有同等意義。
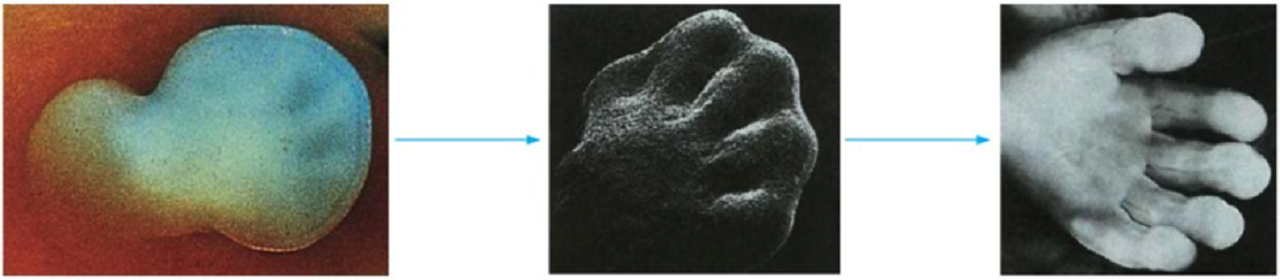 胎兒手的發育過程
胎兒手的發育過程細胞凋亡與壞死的區別
雖然凋亡與壞死的最終結果極為相似,但它們的過程與表現卻有很大差別。
過程
1、凋亡起始
2、凋亡小體形成
3、凋亡小體逐漸被鄰近的細胞或體內吞噬細胞所吞噬,凋亡細胞的殘餘物質被消化後重新利用。
形態學變化
形態學觀察細胞凋亡的變化是多階段的,細胞凋亡往往涉及單個細胞,即便是一小部分細胞也是非同步發生的。首先出現的是細胞體積縮小,連線消失,與周圍的細胞脫離,然後是細胞質密度增加,線粒體膜電位消失,通透性改變,釋放細胞色素C到胞漿,核質濃縮,核膜核仁破碎,DNA降解成為約180bp-200bp片段;胞膜有小泡狀形成,膜內側磷脂醯絲氨酸外翻到膜表面,胞膜結構仍然完整,最終可將凋亡細胞遺骸分割包裹為幾個凋亡小體,無內容物外溢,因此不引起周圍的炎症反應,凋亡小體可迅速被周圍專職或非專職吞噬細胞吞噬。
生物化學變化
1)DNA的片段化
細胞凋亡的一個顯著特點是細胞染色體的DNA降解,這是一個較普遍的現象。這種降解非常特異並有規律,所產生的不同長度的DNA片段約為180-200bp的整倍數,而這正好是纏繞組蛋白寡聚體的長度,提示染色體DNA恰好是在核小體與核小體的連線部位被切斷,產生不同長度的寡聚核小體片段,實驗證明,這種DNA的有控降解是一種內源性核酸內切酶作用的結果,該酶在核小體連線部位切斷染色體DNA,這種降解表現在瓊脂糖凝膠電泳中就呈現特異的梯狀Ladder圖譜,而壞死呈瀰漫的連續圖譜。 細胞凋亡
細胞凋亡
 細胞凋亡
細胞凋亡2) 大分子合成
細胞凋亡的生化改變不僅僅是DNA的有控降解,在細胞凋亡的過程中往往還有新的基因的表達和某些生物大分子的合成作為調控因子。如我們實驗室發現的TFAR-19就是在細胞凋亡時高表達一種分子,再如在糖皮質激素誘導鼠胸腺細胞凋亡過程中,加入RNA合成抑制劑或蛋白質合成抑制劑即能抑制細胞凋亡的發生。
過程機理
細胞凋亡的過程大致可分為以下幾個階段:
接受凋亡信號→凋亡調控分子間的相互作用→蛋白水解酶的活化(Caspase)→進入連續反應過程
啟動階段
細胞凋亡的啟動是細胞在感受到相應的信號刺激後胞內一系列控制開關的開啟或關閉,不同的外界因素啟動凋亡的方式不同,所引起的信號轉導也不相同,客觀上說對細胞凋亡過程中信號傳遞系統的認識還是不全面的,比較清楚的通路主要有:
Fas是一種跨膜蛋白,屬於腫瘤壞死因子受體超家族成員,它與FasL結合可以啟動凋亡信號的轉導引起細胞凋亡。它的活化包括一系列步驟:首先配體誘導受體三聚體化,然後在細胞膜上形成凋亡誘導複合物,這個複合物中包括帶有死亡結構域的Fas相關蛋白FADD。Fas又稱CD95,是由325個胺基酸組成的受體分子,Fas一旦和配體FasL結合,可通過Fas分子啟動致死性信號轉導,最終引起細胞一系列特徵性變化,使細胞死亡。Fas作為一種普遍表達的受體分子,可出現於多種細胞表面,但FasL的表達卻有其特點,通常只出現於活化的T細胞和NK細胞,因而已被活化的殺傷性免疫細胞,往往能夠最有效地以凋亡途徑置靶細胞於死地。Fas分子胞內段帶有特殊的死亡結構域(DD,death domain)。三聚化的Fas和FasL結合後,使三個Fas分子的死亡結構域相聚成簇,吸引了胞漿中另一種帶有相同死亡結構域的蛋白FADD。FADD是死亡信號轉錄中的一個連線蛋白,它由兩部分組成:C端(DD結構域)和N端(DED)部分。DD結構域負責和Fas分子胞內段上的DD結構域結合,該蛋白再以DED連線另一個帶有DED的後續成分,由此引起N段DED隨即與無活性的半胱氨酸蛋白酶8(caspase8)酶原發生同嗜性交聯,聚合多個caspase8的分子,caspase8分子遂由單鏈酶原轉成有活性的雙鏈蛋白,進而引起隨後的級聯反應,即Caspases,後者作為酶原而被激活,引起下面的級聯反應。細胞發生凋亡。因而TNF誘導的細胞凋亡途徑與此類似
2)細胞色素C釋放和Caspases激活的生物化學途徑
線粒體是細胞生命活動控制中心,它不僅是細胞呼吸鏈和氧化磷酸化的中心,而且是細胞凋亡調控中心。實驗表明了細胞色素C從線粒體釋放是細胞凋亡的關鍵步驟。釋放到細胞漿的細胞色素C在dATP存在的條件下能與凋亡相關因子1(Apaf-1)結合,使其形成多聚體,並促使caspase-9與其結合形成凋亡小體,caspase-9被激活,被激活的caspase-9能激活其它的caspase如caspase-3等,從而誘導細胞凋亡。此外,線粒體還釋放凋亡誘導因子,如AIF,參與激活caspase。可見,細胞凋亡小體的相關組份存在於正常細胞的不同部位。促凋亡因子能誘導細胞色素C釋放和凋亡小體的形成。很顯然,細胞色素C從線粒體釋放的調節是細胞凋亡分子機理研究的關鍵問題。多數凋亡刺激因子通過線粒體激活細胞凋亡途經。有人認為受體介導的凋亡途經也有細胞色素C從線粒體的釋放。如對Fas應答的細胞中,一類細胞(type1)中含有足夠的胱解酶8 (caspase8)可被死亡受體活化從而導致細胞凋亡。在這類細胞中高表達Bcl-2並不能抑制Fas誘導的細胞凋亡。在另一類細胞(type2)如肝細胞中,Fas受體介導的胱解酶8活化不能達到很高的水平。因此這類細胞中的凋亡信號需要藉助凋亡的線粒體途經來放大,而Bid -- 一種僅含有BH3結構域的Bcl-2家族蛋白是將凋亡信號從胱解酶8向線粒體傳遞的信使。
執行
儘管凋亡過程的詳細機制尚不完全清楚,但是已經確定Caspase即半胱天冬蛋白酶在凋亡過程中是起著必不可少的作用,細胞凋亡的過程實際上是Caspase不可逆有限水解底物的級聯放大反應過程,到目前為止,至少已有14種Caspase被發現,Caspase分子間的同源性很高,結構相似,都是半胱氨酸家族蛋白酶,根據功能可把Caspase基本分為二類:一類參與細胞的加工,如Pro-IL-1β和Pro-IL-1δ,形成有活性的IL-1β和IL-1δ;第二類參與細胞凋亡,包括caspase2,3,6,7,8,9.10。Caspase家族一般具有以下特徵:
1)C端同源區存在半胱氨酸激活位點,此激活位點結構域為QACR/QG。
2)通常以酶原的形式存在,相對分子質量29000-49000(29-49KD),在受到激活後其內部保守的天冬氨酸殘基經水解形成大(P20)小(P10)兩個亞單位,並進而形成兩兩組成的有活性的四聚體,其中,每個P20/P10異二聚體可來源於同一前體分子也可來源於兩個不同的前體分子。
3)末端具有一個小的或大的原結構域。
參與誘導凋亡的Caspase分成兩大類:啟動酶(inititaor)和效應酶(effector)它們分別在死亡信號轉導的上游和下游發揮作用。
Caspase活化機制
Caspase的活化是有順序的多步水解的過程,Caspase分子各異,但是它們活化的過程相似。首先在caspase前體的N-端前肽和大亞基之間的特定位點被水解去除N-端前肽,然後再在大小亞基之間切割釋放大小亞基,由大亞基和小亞基組成異源二聚體,再由兩個二聚體形成有活性的四聚體。去除N-端前肽是Caspase的活化的第一步,也是必須的,但是Caspase-9的活化不需要去除N-端前肽,Caspase活化基本有兩種機制,即同源活化和異源活化,這兩種活化方式密切相關,一般來說後者是前者的結果,發生同源活化的Caspase又被稱為啟動caspase(initiator caspase),包括caspase-8,-10,-9,誘導凋亡後,起始Caspase通過adaptor被募集到特定的起始活化複合體,形成同源二聚體構像改變,導致同源分子之間的酶切而自身活化,通常caspase-8,10,2介導死亡受體通路的細胞凋亡,分別被募集到Fas和TNFR1死亡受體複合物,而Caspase-9參與線粒體通路的細胞凋亡,則被募集到Cyt c/d ATP/Apaf-1組成的凋亡體(apoptosome)。同源活化是細胞凋亡過程中最早發生的capases水解活化事件,啟動Caspase活化後,即開啟細胞內的死亡程式,通過異源活化方式水解下游Caspase將凋亡信號放大,同時將死亡信號向下傳遞。異源活化(hetero-activation)即由一種caspase活化另一種caspase是凋亡蛋白酶的酶原被活化的經典途徑。被異源活化的Caspase又稱為執行caspase(executioner caspase),包括Caspase-3,-6,-7。執行Caspase不象啟動Caspase ,不能被募集到或結合起始活化複合體,它們必須依賴啟動Caspase才能活化。
Caspase效應機制
凋亡細胞的特徵性表現,包括DNA裂解為200bp左右的片段,染色質濃縮,細胞膜活化,細胞皺縮,最後形成由細胞膜包裹的凋亡小體,然後,這些凋亡小體被其他細胞所吞噬,這一過程大約經歷30-60分鐘,Caspase引起上述細胞凋亡相關變化的全過程尚不完全清楚,但至少包括以下三種機制:
凋亡抑制物
正常活細胞因為核酸酶處於無活性狀態,而不出現DNA斷裂,這是由於核酸酶和抑制物結合在一起,如果抑制物被破壞,核酸酶即可激活,引起DNA片段化(fragmentation)。現知caspase可以裂解這種抑制物而激活核酸酶,因而把這種酶稱為Caspase激活的脫氧核糖核酸酶(caspase-activated deoxyribonuclease CAD),而把它的抑制物稱為ICAD。因而,在正常情況下,CAD不顯示活性是因為CAD-ICAD,以一種無活性的複合物形式存在。ICAD一旦被Caspase水解,即賦予CAD以核酸酶活性,DNA片段化即產生,有意義的是CAD只在ICAD存在時才能合成並顯示活性,提示CAD-ICAD以一種共轉錄方式存在,因而ICAD對CAD的活化與抑制卻是必需要的。 細胞凋亡
細胞凋亡
 細胞凋亡
細胞凋亡破壞細胞結構
Caspase可直接破壞細胞結構,如裂解核纖層,核纖層(Lamina)是由核纖層蛋白通過聚合作用而連成頭尾相接的多聚體,由此形成核膜的骨架結構,使染色質(chromatin)得以形成並進行正常的排列。在細胞發生凋亡時,核纖層蛋白作為底物被Caspase在一個近中部的固定部位所裂解,從而使核纖層蛋白崩解,導致細胞染色質的固縮。
調節蛋白功能
Caspase可作用於幾種與細胞骨架調節有關的酶或蛋白,改變細胞結構。其中包括凝膠原蛋白(gelsin)、聚合粘附激酶(focal adhesion kinase,FAK)、P21活化激酶α(PAKα)等。這些蛋白的裂解導致其活性下降。如Caspase可裂解凝膠原蛋白而產生片段,使之不能通過肌動蛋白(actin)纖維來調節細胞骨架。
所有這些都表明Caspase以一種有條不紊的方式進行"破壞",它們切斷細胞與周圍的聯繫,拆散細胞骨架,阻斷細胞DNA複製和修復,干擾mRNA剪下,損傷DNA與核結構,誘導細胞表達可被其他的細胞吞噬的信號,並進一步使之降解為凋亡小體。
調節
細胞凋亡受到嚴格調控,在正常細胞Caspase處於非活化的酶原狀態,凋亡程式一旦開始,Caspase被活經隨後發生凋亡蛋白酶的層疊級聯反應,發生不可逆的凋亡——細胞調節細胞凋亡的舉例如下。
凋亡抑制分子
迄今為止,人類已發現多種凋亡抑制分子,包括P53,CrmA,IAPs,FLIPs以及Bcl-2家族的凋亡抑制分子。
2)FLIPs(FLICE-imhibirory proterins)能抑制Fas/TNFR1介導的細胞凋亡。它有多種變異體,但其N-端功能前區(Prodomain)完全相同,C端長短不一。FLIPs通過DED功能區,與FADD和Caspase-8,10結合,拮抗它們之間的相互作用,從而抑制Caspase8,10募集到死亡受體複合體和它們的起始化。
3)凋亡抑制蛋白(IAPs,inhibitors of Apoptosisprotien)為一組具有抑制凋亡作用的蛋白質,首先是從桿狀病毒基因組克隆到,發現能夠抑制由病毒感染引起的宿主細胞死亡應答。其特性是有大約20胺基酸組成的功能區,這對IAPs抑制凋亡是必需要的,它們主要抑制Caspase3,-7,而不結合它的酶原,對Caspase則即可以結合活化的,又可結合酶原,進而抑制細胞凋亡。
Bcl-2家族
這一家族有眾多成員,如Mcl-1、NR-B、A1 、Bcl-w、Bcl-x、Bax、Bak、Bad、Bim等,它們分別既有抗凋亡作用,也有促凋亡的作用。多數成員間有兩個結構同源區域,在介導成員之間的二聚體化過程中起重要作用。Bcl-2成員之間的二聚體化是成員之間功能實現或功能調節的重要形式。Bcl-2生理功能是阻遏細胞凋亡,延長細胞壽命,在一些白血病中Bcl-2呈過度表達。
Bcl-2的亞細胞定位已經明確,它在不同的細胞類型可以定位於線粒體、內質網以及核膜上,並通過阻止線粒體細胞色素C的釋放而發揮抗凋亡作用。此外, Bcl-2具有保護細胞的功能, Bcl-2的過度表達可引起細胞核谷胱苷肽(GSH)的積聚,導致核內氧化還原平衡的改變,從而降低了Caspase的活性。Bax是Bcl-2家族中參與細胞凋亡的一個成員,當誘導凋亡時,它從胞液遷移到線粒體和核膜。有人研究發現,細胞毒性藥物誘發凋亡時,核膜Bax水平的上升與lamin及PARP兩種核蛋白的降解呈正相關。用Bax寡核苷酸處理的細胞,只能特異地阻斷Lamin的降解,對PARP的降解不起作用。這種效應的調控機制仍然不清楚。
總之,細胞凋亡的調節是非常複雜的,參與的分子也非常多,還有很多不為我們所知的機理需要我們一步的探索。
醫學套用
免疫學
1)胸腺細胞成熟過程中的凋亡:胸腺細胞經過一系列的發育過程而成為各種類型的免疫活性細胞。在這一發展過程中,涉及了一系列的陽性細胞選擇和陰性細胞選擇過程。以形成CD4+的T淋巴細胞亞型及CD8+的T淋巴細胞亞型;同時,對識別自身抗原的T細胞克隆進行選擇性地消除,其細胞克隆死亡的機制主要是通過程式性細胞死亡。因此,正常的免疫系統發育的結局,既形成了有免疫活性的淋巴細胞,又產生了對自身抗原的免疫耐受。耐受機制的形成,主要靠識別自身抗原的T淋巴細胞克隆的程式性細胞死亡機制的活化。
2)活化誘導的細胞死亡:(activation-induced cell death,AICD)是T淋巴細胞程式性死亡的又一個主要類型。正常的T淋巴細胞在受到入侵的抗原刺激後,T淋巴細胞被激活,並誘導出一系列的免疫應答反應。機體為了防止過高的免疫應答,或防止這種免疫應答無限制地發展下去,便有AICD來控制激活T細胞的壽命。實際上:T淋巴細胞的增殖與T淋巴細胞AICD具有共同的信號通路。T淋巴細胞受到刺激後就開始活化,活化以後的T淋巴細胞如果有生長因子的存在,即發生生殖反應,如果沒有或較少的生長因子的存在,則發生AICD。3)淋巴細胞對靶細胞的攻擊:免疫活性細胞,特別是淋巴因子激活的殺傷細胞(LAK),是過繼性免疫治療的一種重要形式。在抗腫瘤、抗病毒及免疫調節中具有重要作用。這些免疫活性細胞在攻擊腫瘤細胞、病毒感染的細胞時,可誘導靶細胞發生程式性死亡。 細胞凋亡
細胞凋亡
 細胞凋亡
細胞凋亡臨床醫學
細胞凋亡之所以成為人們研究的一個熱點,在很大程度上決定於細胞凋亡與臨床病毒的密切關係。這種關係不僅表現在凋亡及其機制的研究,闡明了一大類免疫病的發病機制,而且由此可以導致疾病新療法的出現,特別是細胞凋亡與腫瘤及愛滋病之間的密切關係倍受人們重視。
1) HIV病毒感染造成CD4+細胞減少是通過細胞凋亡機制
HIV感染引起愛滋病,其主要的發病機制是HIV感染後特異性地破壞CD4+細胞,使CD4+以及與其相關的免疫功能缺陷,易招致機會性感染及腫瘤,但HIV感染後怎樣特異性破壞CD4+細胞呢?一般認為,CD4+T淋巴細胞絕對數顯著減少的原因,主要是通過細胞凋亡機製造成的。這不僅闡明了AIDS時CD4+T細胞減少的主要原因,同時也為AIDS的治療研究指明了一個重要的探索方向。
2)從細胞凋亡角度看,腫瘤的發生是由於凋亡受阻所致
一般認為惡性轉化的腫瘤細胞是因為失控生長,過度增殖,從細胞凋亡的角度看則認為是腫瘤的凋亡機制受到抑制不能正常進行細胞死亡清除的結果。腫瘤細胞中有一系列的癌基因和原癌基因被激活,並呈過表達狀態。這些基因的激活和腫瘤的發生髮展之間有著極為密切的關係。癌基因中一大類屬於生長因子家族,也有一大類屬於生長因子受體家族,這些基因的激活與表達,直接刺激了腫瘤細胞的生長,這些癌基因及其表達產物也是細胞凋亡的重要調節因子許多種類的癌基因表達以後,即阻斷了腫瘤細胞的凋亡過程,使腫瘤細胞數目增加,因此,從細胞凋亡角度來理解腫瘤的發生機制,是由於腫瘤細胞的凋亡機制,腫瘤細胞減少受阻所致。因此,通過細胞凋亡角度和機制來設計對腫瘤的治療方法就是重建腫瘤細胞的凋亡信號轉遞系統,即抑制腫瘤細胞的生存基因的表達,激活死亡基因的表達。
3)細胞凋亡的研究將給自身免疫病帶來真正的突破
自身免疫病包括一大類難治性的免疫紊亂而造成的疾病,自身反應性T淋巴細胞及產生抗體的B淋巴細胞是引起自身免疫病的主要免疫病理機制,正常情況下,免疫細胞的活化是一個極為複雜的過程。在自身抗原的刺激作用下,識別自身抗原的免疫細胞被活化,從而通過細胞凋亡的機制而得到清除。但如這一機制發生障礙,那么識別自身抗原的免疫活性細胞的清除就會產生障礙。有人觀察到在淋巴增生突變小鼠中觀察到Fas編碼的基因異常,不能翻譯正常的Fas跨膜蛋白分子,如Fas異常,由其介導的凋亡機制也同時受阻,便造成淋巴細胞增殖性的自身免疫疾患。
4)神經系統的退行性病變:老年性痴呆是神經細胞凋亡的加速而產生的。阿爾茨海默病(AD)是一種不可逆的退行性神經疾病,澱粉樣前體蛋白(APP)早老蛋白-1(PS1)早老蛋白-2(PS2)的突變導致家族性阿爾茨海默病(FAD)。研究證明PS參與了神經細胞凋亡的調控PS1、PS2的過表達能增強細胞對凋亡信號的敏感性。Bcl-2基因家族兩個成員Bcl-xl和Bcl-2參與對細胞凋亡的調節。
線粒體
1951年,巴黎第八大學榮譽教授Glucksmann提出正常脊椎動物發育中的細胞死亡。1966年,Saunders提出在形態發生中細胞死亡。1972年,Kerr提出細胞凋亡(apoptosis),說明這是在組織動力學方面有廣泛作用的一種基本生物學現象。1974年,Lockshin提出細胞程式性死亡。美國麻省理工學院教授Horvitz在研究線蟲發育時發現線蟲的每個細胞的位置、分裂與命運都是由遺傳決定的程式所精確地預先確定的。在構成成蟲體時有1090個細胞誕生,131個細胞死亡。1993年,哈佛大學醫學院細胞生物學系終身教授袁鈞瑛發現線蟲的死亡基因ced-3的產物在結構和功能上與哺乳類白細胞介素1β轉換酶有同源性。此後,屬於同一家族的十幾個相關基因陸續在哺乳動物基因組中被發現。統稱為胱冬肽酶(caspases)。1994年,瑞士蘇黎世大學分子生命科學研究所Hengartner發現線蟲的存活基因ced-9的產物與哺乳動物原癌基因bcl-2的產物相似。
細胞凋亡的特徵是細胞由於降解酶,主要是水解酶(蛋白酶與核酸酶)的作用,在近乎正常的細胞質膜內趨向死亡。這與壞死時細胞質膜早期破損不同。在細胞凋亡過程中,質膜脂雙層喪失二側不對稱性,磷脂醯絲氨酸暴露於細胞表面,從而導致被吞噬。
線粒體跨膜電位的耗散與細胞凋亡的密切關係
有陸續報導說明線粒體跨膜電位的耗散早於核酸酶的激活,也早於磷酯醯絲氨酸暴露於細胞表面。而一旦線粒體跨膜電位耗散,細胞就會進入不可逆的凋亡過程。線粒體解聯的呼吸鏈會產生大量活性氧,氧化線粒體內膜上的心磷脂。實驗證明,用解偶聯劑mClCCP會導致淋巴細胞凋亡。而如果能穩定線粒體跨膜電位就能防止細胞凋亡。
通透性轉變
在細胞凋亡過程中線粒體跨膜電位的耗散主要是由於線粒體內膜的通透性轉變,這是由於生成了動態的由多個蛋白質組成的位於線粒體內膜與外膜接觸位點的通透性轉變孔道(PT孔道)(圖1)。PT孔道由線粒體各部分的蛋白質與細胞質中蛋白質聯合構成。這包括細胞液蛋白:己糖激酶,線粒體外膜蛋白:外周苯並二嗪(benzodiazepine)受體與電壓依賴陰離子通道,線粒體膜間間隙蛋白:肌酸激酶,線粒體內膜蛋白:ADP-ATP載體,線粒體基質蛋白:親環蛋白D(cyclophilin D)等。凡是能夠專一作用於線粒體誘導PT孔道生成的物質,例如苯並二嗪受體的配基原卟啉IX等都能引起細胞凋亡。
PT孔道的性質
通過一些實驗室的研究,以下諸點值得指出:⑴線粒體內膜通透性轉變既是細胞凋亡的必須條件,也是它的充足條件。⑵PT孔道打開後導致線粒體許多功能的致命性變化從而啟動了死亡途徑。⑶PT孔道作為許多生理效應的感受器(二價陽離子、ATP、ADP、NAD、ΔΨm、pH、巰基與多肽),整合了電生理、氧化還原與細胞代謝狀態的信息。⑷PT孔道的組成成分ADP-ATP載體是能量代謝的重要分子,由於ADP-ATP載體是由一個基因家族的幾個成員所編碼,它的表達有嚴格的組織專一性。因此,PT孔道在不同細胞中的調節可能稍有不同。⑸PT孔道的作用有自放大的效應。PT誘導ΔΨm耗散,而反過來 mClCCP使ΔΨm去極化會導致PT。一些PT的結果例如ΔΨm 耗散,活性氧的生成本身也會導致PT。這就說明PT會有正反饋, 從而在細胞凋亡中有自摧毀的作用。反過來,如果能防止ΔΨm的耗散,就能避免氧化還原不平衡、磷酯醯絲氨酸的暴露與蛋白酶和核酸酶的激活。
PT孔道開關
PT孔道有開放與關閉二種構象。PT孔道開放導致細胞凋亡。而PT孔道關閉能防止細胞凋亡。當PT孔道與環孢菌素A(cyclosporin A)或SH,或米酵菌酸(bongkrek acid)結合時PT孔道被關閉。在PT孔道開放時線粒體釋放細胞凋亡誘導因子(AIF)。AIF可能是一種蛋白水解酶,位於線粒體膜間間隙,它能被蛋白酶抑制劑如N-苄氧羰基-纈氨醯-丙氨醯-門冬氨醯氟甲基酮(N-benzyloxycarbonyl-Val-Ala-Asp-fluoromethylketone)所抑制。此外從線粒體釋放的細胞色素C也是一種細胞凋亡誘導因子。雖然蒼朮苷與米酵菌酸都是ADP-ATP載體的抑制劑,但是它們對PT孔道的作用並不相同。蒼朮苷促進PT通道開放。這可能與二種抑制劑和ADP-ATP載體的結合部位不同有關。蒼朮苷只能與ADP-ATP載體的胞液側結合而米酵菌酸可與ADP-ATP載體的胞液及基質二側結合。
線粒體作用
⑴若將純化的正常的線粒體與純化的細胞核在一起保溫,並不導致細胞核的變化。但若將誘導生成PT孔道的線粒體與純化的細胞核一同保溫,細胞核即開始凋亡變化。⑵細胞死亡調節蛋白不論是抑制死亡的bcl-2家族還是促進細胞死亡的Bax家族均以線粒體作為靶細胞器。bcl-2蛋白的C端的疏水肽段能插入線粒體外膜。事實上相當量的bcl-2位於線粒體內外膜的接觸位點。⑶高表達bcl-2能防止ΔΨm的耗散,從而導致對蒼朮苷、原卟啉IX與mClCCP的不敏感與AIF釋放的抑制;反之,高表達Bax則導致ΔΨm的耗散。
綜上所述,細胞凋亡與線粒體的結構與功能有著密切的關係。如果線粒體有大量PT孔道形成,細胞ATP濃度很快下降,則在致凋亡的蛋白酶被活化前細胞就壞死了。而如果PT孔道的誘導生成是一種比較緩和與持續的狀態,在細胞ATP濃度下降前專一的蛋白酶被激活;而另一方面ΔΨm的耗散產生的超氧陰離子則導致細胞死亡。細胞凋亡是一把雙刃劍。一方面是機體發育的正常過程,另一方面如果細胞凋亡過速,則會導致慢性退行性病變;如果細胞不凋亡就有可能導致癌變或對化療的不敏感。進一步研究線粒體在細胞凋亡中的作用,有助於深入了解細胞凋亡的機制與對疾病的防治。
檢測
早期檢測
1) PS(磷脂醯絲氨酸)在細胞外膜上的檢測:PS從細胞膜內側轉移到外側在細胞受到凋亡誘導後不久發生,可能作為免疫系統的識別標誌。AnnexinV,一個鈣依賴性的磷脂結合蛋白,能專一性的結合暴露在膜外側的PS,再通過簡單的顯色或發光系統進行檢測。由於這是一種凋亡早期的活細胞檢測(懸浮細胞和貼壁細胞都適用),可與DNA染料或別的晚期檢測方法相結合來標記凋亡的發展階段。 細胞凋亡
細胞凋亡
 細胞凋亡
細胞凋亡美國著名生物試劑公司CLONTECH和Invitrogen公司分別開發了多種標記的Annexin V產品,簡便快速,10分鐘就可完成檢測。其中帶螢光標記的Annexin V-EGFP(Enhanced Green Fluorescent Protein)及Annexin V-FITC,靈敏度高,可作為FACS(流式細胞分選)方法篩選凋亡細胞的基礎。由於融合蛋白Annexin V-EGFP,EGFP與PS 的結合比例為1:1,還可進行定量檢測。除此之外,還提供生物素偶聯的Annexin V,可通過常用的酶聯顯色反應來檢測。另外,MACS公司將磁珠包被Annexin V,可採用磁分選方法篩選凋亡細胞。
2)細胞內氧化還原狀態改變的檢測:
這反應了細胞凋亡研究中相對較新的趨勢,研究什麼樣的氧化還原環境引起下游事件的發生。CLONTECH公司的ApoAlertTM GlutathioneDetection Kit通過螢光染料monochlorobimane(MCB)體外檢測凋亡細胞細胞質中谷光苷肽的減少來檢測凋亡早期細胞內氧化還原狀態的變化。正常狀態下,谷光苷肽(glutathione:GSH)作為細胞的一種重要的氧化還原緩衝劑。細胞內有毒的氧化物通過被GSH還原而定期去除,氧化型的GSH又可被GSH還原酶迅速還原。這一反應線上粒體中尤為重要,許多呼吸作用中副產物的氧化損傷將由此被去除。在Jurcat和一些其它類型的細胞中,細胞膜中有可被凋亡信號啟動的ATP依賴的GSH轉移系統。當細胞內GSH的排除非常活躍時,細胞液就由還原環境轉為氧化環境,這可能導致了凋亡早期細胞線粒體膜電位的降低,從而使細胞色素C(三羧酸循環中的重要組分)從線粒體內轉移到細胞液中,啟動凋亡效應器caspase的級聯反應。
由於 GSH與氧化還原作用及線粒體功能密切相關,此項檢測除了對研究細胞凋亡的起始非常有用外,還可用於心臟病、中風等疾病治療的研究。但有些細胞如:HeLa 和3T3細胞凋亡時沒有明顯的GSH水平的變化,不能用此法檢測。
3)細胞色素C的定位檢測
細胞色素C作為一種信號物質,在細胞凋亡中發揮著重要的作用。正常情況下,它存在於線粒體內膜和外膜之間的腔中,凋亡信號刺激使其從線粒體釋放至細胞液,結合Apaf-1 (apoptoticprotease activating factor-1)後啟動caspase級聯反應:細胞色素C/Apaf-1複合物激活caspase-9,後者再激活caspase-3和其它下游caspase。細胞色素C氧化酶亞單位Ⅳ(cytochrome c oxidase subunit Ⅳ:COX4)是定位線上粒體內膜上的膜蛋白,凋亡發生時,它保留線上粒體內,因而它是線粒體富集部分的一個非常有用的標誌。
ApoAlertTMCell Fractionation Kit不用超離心,可從凋亡和非凋亡細胞中快速有效分離出高度富集的線粒體部分,再進一步通過Western雜交用細胞色素C抗體和COX4抗體標示細胞色素C和COX4的存在位置,從而判斷凋亡的發生。
4) 線粒體膜電位變化的檢測:
在凋亡研究的早期,從形態學觀測上線粒體沒有明顯的變化。隨著凋亡機制研究的深入,發現線粒體凋亡也是細胞凋亡的重要組成部分,發生很多生理生化變化。例如,在受到凋亡誘導後線粒體轉膜電位會發生變化,導致膜穿透性的改變。MitoSensorTM,一個陽離子性的染色劑,對此改變非常敏感,呈現出不同的螢光染色。正常細胞中,它線上粒體中形成聚集體,發出強烈的紅色螢光。凋亡細胞中,因線粒體穿膜電位的改變,它以單體形式存在於細胞液中,發出綠色螢光。用螢光顯微鏡或流式細胞儀可清楚地分辨這兩種不同的螢光信號。CLONTECH公司的ApoAlert Mitochondrial Membrane Sensor Kit就採用這種原理來檢測線粒體膜電位的變化。但是,這種方法不能區分細胞凋亡或其他原因導致的線粒體膜電位的變化。
晚期檢測
1) TUNEL(Terminal deoxynucleotidyl transferase-mediated dUTP nick-end-labeling)
通過DNA末端轉移酶將帶標記的 dNTP (多為dUTP)間接(通過地高辛)或直接接到DNA片段的3’-OH端,再通過酶聯顯色或螢光檢測定量分析結果。美國Intergen公司提供多種標記方法,直接螢光標記,地高辛介導螢光標記或過氧化物酶聯顯色,可做細胞懸液、福馬林固定或石蠟處理的組織、細胞培養物等多種樣本的檢測。其中,直接標記步驟少,操作簡便。而間接標記有信號放大的作用,檢測靈敏度高。
2) LM-PCR Ladder (連線介導的PCR檢測)
當凋亡細胞比例較小以及檢測樣品量很少(如活體組織切片)時,直接瓊脂糖電泳可能觀察不到核DNA的變化。CLONTECH公司的ApoAlert?LM-PCR Ladder Assay Kit通過LM-PCR(ligation-mediated PCR),連上特異性接頭,專一性地擴增核小體的梯度片段,從而靈敏地檢測凋亡時產生的核小體的梯度片段。此外,LM-PCR 檢測是半定量的,因此相同凋亡程度的不同樣品可進行比較。
上述兩種方法都針對細胞凋亡晚期核DNA斷裂這一特徵,但細胞受到其它損傷(如機械損傷,紫外線等)也會產生這一現象,因此它對細胞凋亡的檢測會受到其它原因的干擾。
3) Telemerase Detection (端粒酶檢測)
這是相對來說推出較早,用得較多的一種方法。端粒酶是由RNA和蛋白組成的核蛋白,它可以自身RNA為模板逆轉錄合成端粒區重複序列,使細胞獲得“永生化”。正常體細胞是沒有端粒酶活性的,每分裂一次,染色體的端粒會縮短,這可能作為有絲分裂的一種時鐘,表明細胞年齡、複製衰老或細胞凋亡的信號。研究發現,90%以上的癌細胞或凋亡細胞都具有端粒酶的活性。Invitrogen公司的TRAP-eze Telemerase Detection Kit在1996年率先推出。它提供特定的寡核苷酸底物,分別與底物及端粒重複序列配對的引物。如果待測樣本中含有端粒酶活性,就能在底物上接上不同個數的6鹼基(GGTTAG)端粒重複序列,通過PCR反應,產物電泳檢測就可觀察到相差六個鹼基的DNA Ladder現象(參見圖4)。此外,Intergen公司還提供用酶聯免疫法(ELISA)檢測的試劑盒.
同樣,這種檢測方法也不專對細胞凋亡,檢測結果也不純反應細胞凋亡的發生。
mRNA檢測
研究者們發現了很多在細胞凋亡時表達異常的基因,檢測這些特異基因的表達水平也成為檢測細胞凋亡的一種常用方法。據報導,Fas 蛋白結合受體後能誘導癌細胞中的細胞毒性T細胞(cytotoxic T cells)等靶細胞。Bcl-2 和bcl-X (長) 作為抗凋亡(bcl-2 和bcl-X)的調節物,它們的表達水平比例決定了細胞是凋亡還是存活。一般多採用Northern雜交和RT-PCR走膠對它們進行檢測。隨著螢光定量PCR技術的發展,用定量PCR技術來檢測基因表達水平無疑比之前者更快更準確。Invitrogen公司的Amplifluor Apoptosis Gene Systems就根據這一新技術原理,通過檢測fas,bax-alpha 和 bcl-X (長的) 基因的 mRNA表達水平來進行細胞凋亡的檢測。
形態學檢測
根據凋亡細胞固有的形態特徵,人們已經設計了許多不同的細胞凋亡形態學檢測方法。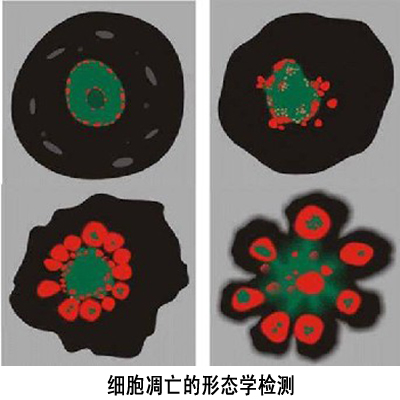 細胞凋亡的形態學檢測
細胞凋亡的形態學檢測
 細胞凋亡的形態學檢測
細胞凋亡的形態學檢測1.光學顯微鏡和倒置顯微鏡
貼壁細胞出現皺縮、變圓、脫落。
成塊狀和凋亡小體等典型的凋亡形態。
2.螢光顯微鏡和共聚焦雷射掃描顯微鏡
一般以細胞核染色質的形態學改變為指標來評判細胞凋亡的進展情況。
常用的DNA特異性染料有:HO 33342 (Hoechst 33342),HO 33258 (Hoechst 33258),DAPI。三種染料與 DNA的結合是非嵌入式的,主要結合在DNA的A-T鹼基區。紫外光激發時發射明亮的藍色螢光。
Hoechst是與DNA特異結合的活性染料,儲存液用蒸餾水配成1mg/ml的濃度,使用時用PBS稀釋成終濃度為2~5mg/ml。
DAPI為半通透性,用於常規固定細胞的染色。儲存液用蒸餾水配成1mg/ml的濃度,使用終濃度一般為0.5 ~1mg/ml。
結果評判:細胞凋亡過程中細胞核染色質的形態學改變分為三期:Ⅰ期的細胞核呈波紋狀(rippled)或呈折縫樣(creased),部分染色質出現濃縮狀態;Ⅱa期細胞核的染色質高度凝聚、邊緣化;Ⅱb期的細胞核裂解為碎塊,產生凋亡小體。
3.透射電子顯微鏡觀察
結果評判:凋亡細胞體積變小,細胞質濃縮。凋亡Ⅰ期(pro-apoptosis nuclei)的細胞核內染色質高度盤繞,出現許多稱為氣穴現象(cavitations)的空泡結構;Ⅱa期細胞核的染色質高度凝聚、邊緣化;細胞凋亡的晚期,細胞核裂解為碎塊,產生凋亡小體。
細胞凋亡檢測
細胞凋亡在胚胎髮育、造血、免疫系統的成熟以及維護正常組織和器官的細胞恆定與生長平衡,乃至機體衰老方面都起著重要作用。因此,有關凋亡的研究在臨床和基礎等各個領域已經廣泛開展,凋亡細胞的檢測方法顯得非常重要。流式細胞儀( Flow cytometry ,FCM) 將流體噴射技術、雷射光學技術、電子技術和計算機技術等集於一體,較其它方法有不可比擬的優越性,既可定性又可定量,且具有簡單、快速和敏感性高的特點,可進行多參數和活體細胞分析。在APO 的研究得到較為廣泛的套用,開闢了新途徑。
1 光散射法
在FCM 系統中,被檢細胞在液流中通過儀器測量區時,經雷射照射,細胞向空間360°立體角的所有方向散射光線,其中前向散射光( FSC) 的強度與細胞大小有關,而側向散射光(SSC) 的強度與質膜和細胞內部的折射率有關。細胞凋亡時,細胞固縮,體積變小,核碎裂形成,細胞內顆粒往往增多,故凋亡細胞FSC 降低而SSC 增高。細胞壞死由於胞體腫脹,細胞核亦碎裂分解故FSC 和SCC 均增高。正常細胞FSC 高而SSC 低。根據光散射特性檢測凋亡細胞最主要的優點是可以將光散射特性與細胞表面免疫螢光分析結合起來,用以區別辯認經這些特殊處理髮生選擇凋亡的淋巴細胞亞型,也可用於活細胞分類。值得注意的是,根據FSC 和SSC 判斷凋亡細胞的可靠性受被測細胞形態上的均一性和核細胞漿比率影響很大,因此在某些淋巴細胞凋亡中,用光散射特性檢測凋亡的可靠性較好而在腫瘤細胞凋亡中其可靠性較差。
2 細胞DNA 含量的測定
細胞凋亡時,核酸內切酶激活,導致DNA 斷裂,這是凋亡的特徵性表現,也為FCM 鑑別凋亡細胞奠定了基礎。而檢測細胞凋亡DNA 斷裂的方法中,最常用、最簡便的就是細胞DNA 含量分析。當細胞用乙醇、TrtionX—100 處理後細胞膜上出現漏洞,小片段DNA 從細胞內釋放出來,使其DNA 含量低於正常細胞的二倍體。用碘化丙啶( PI) 染色後分析,可在二倍體C0/ G1 ,峰前出現“亞二倍體”峰,即細胞凋亡峰(APO峰) ,根據APO 峰可測出凋亡細胞百分率,該法簡單易行,可大批定量檢測凋亡標本,亦可同時分析細胞的細胞周期位置。另外,套用FCM 方法通過對DNA 和RNA 的聯合檢測可以鑑別出G0 期細胞,因此,可分析細胞凋亡與G1 或G0 細胸的關係。DNA 降解的程度取決於凋亡的階段、細胞的類型和凋亡誘發因子的特性。染色過程中DNA 的逸出量變化也影響FCM 檢測結果。據研究,將高濃度的磷酸鹽———枸椽酸鹽緩衝液加入漂洗液中,可增高降解DNA 的逸出量,從而提高鑑別凋亡細胞與正常細胞的能力。
DNA 含量測定在檢測細胞凋亡中的局限性在於其特異性和敏感性均不高。特異性不高是因為APO 峰代表了一組細胞群體,包括凋亡細胞、機械損傷細胞、低DNA 含量的細胞或不同染色體結構的細胞,在上述情況下,DNA 與螢光染料的結合量均小。另外,非固定的細胞在低滲溶液中被溶解時,可導致大量的核碎片出現,此時APO 峰的細胞數目只代表了核碎片的數目,並不代表凋亡細胞數目。敏感性較差的原因是細胞凋亡早期只有DNA 斷裂點出現,但尚未出現DNA 片段的大量丟失,所以該法不能檢出早期凋亡細胞和發生於S 期或G2/ M 期的凋亡細胞,因為其實際含量不低於二倍體細胞所含的DNA ,因此該法進行凋亡細胞分析時應結合其它形態或生化方法,以期更準確地分析細胞的凋亡狀態。
3 Y 啶橙染色法( Acridine Orange ,AO)
AO 可將細胞或細胞核中的雙鏈DNA 和變性DNA 染成不同顏色的螢光。AO 插入雙鏈DNA 中時,發綠色螢光;AO也可與單鏈或通過變性而產生的DNA 單鏈發生作用,這時發出紅色螢光,因此,通過FCM 檢測不同的螢光,可判斷凋亡的發生。在測定被標準化後,綠色和紅色螢光強度的量與總DNA 含量成比例,紅色螢光與總體細胞(紅色加綠色) 螢光的比率表示細胞中變性DNA 的比例,因此,這種方法可用於評價DNA 對原位變性的敏感性。有時候,凋亡細胞DNA 降解不明顯,依賴於DNA 降解來檢測細胞凋亡的方法如細胞DNA含量測定、DNA 末端標記等就難以檢測到細胞凋亡變化。AO法檢測凋亡的原理不依賴於DNA 片斷的產生,因此其最主要的優點是可套用於寡核小體片段與凋亡不相平衡等情況,但AO 染色法不能有效區分有絲分裂細胞和凋亡細胞。
4 若丹明( Rh123) 染色法
細胞生活狀態下,胞膜上的鈉- 鉀泵、鈣泵等的作用,使細胞膜內外維持著不同離子的濃度梯度,包括Na + , K+ ,Cl - ,Ca2 + 等,形成細胞膜電位。FCM 可以檢測親脂性離子螢光染料在胞膜內外的分布,來測量膜電位的高低,以評價細胞的活力。Rh123 是一種親脂性陽離子螢光染料,對細胞膜具有通透性,線粒體膜尤敏感。細胞存活狀態時,若丹明123 通過細胞膜,積聚於線粒體發出綠色螢光。在細胞凋亡時,線粒體膜的轉運能力下降,電負性降低,故細胞線粒體積聚Rh123 的能力也喪失,螢光強度降低,據此檢測細胞的凋亡變化。但應指出,在凋亡的早期階段,由於胞膜尚完整,大多數細胞器和細胞功能相對較好,因此,Rh123 法對於早期凋亡細胞和活細胞的鑑別比較困難。
5 原位末端標記技術
細胞凋亡時,DNA 斷裂早於形態學改變及DNA 含量減少,原位末端標記( ISEL) 是將滲入到凋亡細胞中的外源性核苷酸在酶和DNA 的催化下與凋亡細胞因內源性核酸酶的激活而產生的單股或雙股斷裂相結合,較前述方面具更高靈敏性。通常有兩種方法: ①DNA 聚合酶I 或klenow 大片段介導的單位缺口平移( INST) ; ②末端脫氧核苷酸轉移酶介導的dUTP 缺口末端標記( TUNEL) 。
INST 是利用DNA 多聚酶將核苷酸整合到凋亡細胞內斷裂的DNA 處的3’末端,同時水解5’末端,以修復DNA ,若使用已標記的核苷酸即可顯示出有斷裂DNA 的細胞。1993 年,Gorczyca 等提出了末端脫氧核糖核酸轉移酶( TdT) 標記法采檢測凋亡細胞的DNA 斷裂,此種方法已得到廣泛套用。由於內源性核酸內切酶激活,細胞自身的染色質或DNA 被切割,並產生與DNA 斷點數目相同的3’2 羥基末端, TdT 可以將生物素化的dUTP 標記至3’2 羥基末端,通過卵白素2FITC 系統,使DNA 的斷點部位發生特異螢光而簽別出凋亡細胞,TdT 末端標記法是鑑別凋亡細胞比較特異的一種方法。腦組織中的凋亡細胞很少,因此基因組DNA 片斷需要更靈敏的檢測技術。將TUNEL 法與FCM 結合起來可以提高檢測凋亡細胞中DNA 片斷的靈敏度。經凋亡誘導因子處理一定時間後的細胞,原位末端標記的凋亡比Hoechst33342 染色顯示的要多,提示TUNEL 可檢測出尚未出現明顯凋亡形態學特徵但已發生DNA 裂解的核,從而使檢測的靈敏度提高。對比研究表明, TUNEL 的敏感性遠遠高於ISNT ,尤其在APO早期TUNEL 法陽性率較高,可能是APO 發生時DNA 多數為雙鏈同時斷裂,單鏈少見的原因。後者是依賴DNA 多聚酶介導的修復反應,故ISNT 的陽性率相對較低。TUNEL 還可結合細胞同期的分析,可同時了解凋亡細胞DNA 斷裂和細胞周期分布之間的關係,近來已成為鑑別和定量凋亡細胞的最常用方法之一。但由於斷裂DNA 的標記過程比較複雜,涉及多種因素,所以末端標記的陰性結果並不一定代表DNA鏈的完整,應排除方法上的問題,如TdT 酶活力的喪失等諸多影響因素。因此套用TdT 末端標記法鑑別凋亡細胞必須同時設陽性及陰性對照組,以便得到可靠結果。
6 Annexin V/ PI 法
1992 年Fadok 報導在APO 早期位於細胞膜內側的磷脂醯絲氨酸(phosphatidylserin ,PS) 遷移至細胞外側,這一現象出現在核染色質變性與核體積縮小之前。AnnexinV 是一種具有很強的抗凝血特性的血管蛋白,和磷脂有高親合力,尤其與帶負電荷的磷脂如PS 具極強的結合力,利用其特性可以檢測細胞凋亡。但壞死細胞PS 亦暴露於外表使Annexin V 結合陽性,因此使用Annexin V 這一參數不能區分壞死或凋亡,必須同時採用PI 這一參數將壞死細膽區分開來。FCM 通過Annexin V —FITC 標誌暴露於細胞膜上的PS 結合PI 進入損傷細胞膜標記降解DNA 分析凋亡與壞死細胞。在檢測時有4個亞群包括機械性損傷細胞(Annexin - / P1 + ) 、正常細胞(An2nexin - / PI - ) 、凋亡細胞(Annexin + / PI - ) 和繼發性壞死細胞(Annexin + / PI + ) 被區分。Boersma 等套用Ampexin V2FITE染色法檢測細胞毒藥物處理後的中國倉鼠細胞凋亡變化,FCM 檢測發現螢光信號強弱不同的兩種細胞亞群。進一步形態學等證實弱螢光細胞亞群代表早期凋亡細胞,強螢光亞群代表晚期凋亡細胞,可見其是檢測和定量凋亡細胞的一種較為可靠的方法。細胞凋亡時膜上PS 外露早於DNA 斷裂發生,因此該法檢測早期凋亡更為靈敏,且該法不需要固定細胞,避免了PI 法因固定造成的細胞碎片過多及TUNEL 法因固定出現的DNA 片段丟失,因此更加省時,結果亦更可靠,是目前最為理想的凋亡定量檢測方法。
7 其 他
7.1 ssDNA 單抗法 把抗單鏈DNA(ssDNA) 單克隆抗體用於細胞凋亡的檢測,是一種偶然發現,因為在套用ssDNA 單抗(螢光法) 檢測細胞毒性藥物誘導DNA 損傷中,觀察到凋亡的白血病細胞(MOL T24) 有較強的螢光,後來經過適當的改進,證明ssDNA 單抗可以特異地識別凋亡細胞。與TUNEL法相比,ssDNA 具有更強的靈敏性。TUNEL 法檢測的凋亡細胞可能只是單抗法檢測的凋亡細胞中的一個亞類。ssDNA法檢測APO 一般用免疫螢光法。但也可和FCM 結合套用。單抗法使用簡便、成本低、套用廣泛。ssDNA 單抗可以區別壞死和凋亡、甚至能檢測前期凋亡,凋亡後壞亡和一些特殊的凋亡形式(如無片段化的細胞凋亡) 。因此, ssDNA 單抗法可望成為一種新的特異靈敏檢測細胞凋亡的方法。
7.2 細胞凋亡的相關蛋白分析 研究發現,有不少基因參加凋亡調控,這些基因產物可參與促進或抑制APO 的發生、發展,因此檢測凋亡調節基因蛋白對研究APO 及其調控有重要作用。迄今為止,已可對大量細胞凋亡調節基因的蛋白產物分析,如P53 蛋白、caspases、C2myc、Fas 抗原、TNF、bcl22 家族蛋白、cyclin、ras 等。FCM 用螢光標記的各種調控蛋白單抗染色,收集不同波長的螢光信號,檢測細胞膜表面或細胞內螢光分子數量,可以了解每個細胞的變化,而且所需樣品少,方法簡便、快捷、準確。
8 展 望
近幾年來,隨著FCM 技術的不斷發展和APO 研究的逐漸深入,FCM 在細胞凋亡研究中日益廣泛。套用FCM 定量檢測凋亡細胞簡便、快速、客觀,並可進行多參數檢測,因此,可同時對APO 及其相關的癌基因表達、細胞周期分布等諸多因素進行相關分析,可以比較深入地了解凋亡的調節機制。儘管套用FCM 進行細胞凋亡研究的方法較多,但FCM檢測凋亡細胞的方法一般基於細胞凋亡過程中形態、生化等某一方面的特性,因而難於了解凋亡過程中發生的各種變化的相互關係,也使該類方法缺乏特異性,所以,聯合套用多種針對不同特性的FCM 檢測方法,才能更為有效地鑑別凋亡細胞。同時,FCM 研究結果尚需同時結合形態學觀察或生物化學方法,才能更加深入地了解凋亡細胞的生物學特性。隨著生物技術的發展及人們對APO 本質認識的深入,相信在不久的將來,定會有更為特異和敏感的方法問世,有助於細胞凋亡取得突破性進展。

