牛胰島素 簡介 中文名稱:牛胰島素
英文名稱:insulin from bovine pancreas
英文別名:insulin human; insulin hybri-max from bovine pancreas; insulin bovine; Insulin (bovin)
CAS號:11070-73-8
EINECS號:234-291-2
分子式:C254H377N65O75S6
分子量:5733.53
牛胰島素是牛
胰臟 中胰島β-細胞所分泌的一種調節
糖代謝 的蛋白質激素,是一種多肽。其一級結構1955年由英國桑格(S.Sanger)測定。牛胰島素在醫學上有抗炎、抗動脈硬化、抗血小板聚集、治療
骨質增生 、治療
精神疾病 等作用。中國是第一個合成人工牛胰島素的國家。1965年,中國科學院上海生物化學研究所在所長
王應睞 的組織領導下,與北京大學和
中國科學院上海有機化學研究所 的科學家通力合作,在經歷了多次失敗後,終於在世界上第一次用人工方法合成出具有
生物活性 的蛋白質——
結晶牛胰島素 。人工牛胰島素的合成,標誌著人類在認識生命、探索生命奧秘的征途上邁出了重要的一步。
在1965年9月17日我國完成了結晶牛胰島素的全合成。經過嚴格鑑定,它的結構、生物活力、物理化學性質、結晶形狀都和天然的牛胰島素完全一樣。這是世界上第一個人工合成的蛋白質,為人類認識生命、揭開生命奧秘邁出了可喜的一大步。這項成果獲1982年中國自然科學一等獎。
1953年,英國人F. SangerSanger由於測定了牛胰島素的一級結構而獲得1958年
諾貝爾化學獎 。
化學結構 牛胰島素是一種蛋白質分子,它的化學結構於1955年由英國的科學家桑格測定、闡明:牛胰島素分子是一條由21個
胺基酸組成 的A鏈和另一條由30個
胺基酸 組成的B鏈,通過兩對二硫鏈連結而成的一個雙鏈分子,而且A鏈本身還有一對
二硫鍵 。
牛胰島素結構模型 以後,科學家們又陸續測定了不同生物來源的
胰島素 ,發現與桑格首次確定的牛胰島素的化學結構大體相同。
人胰島素 也是如此,只有:A鏈的第8位由
蘇氨酸 代替
丙氨酸 、第10位由
異亮氨酸 代替
纈氨酸 ;B鏈的第30位由蘇氨酸代替丙氨酸。
人工合成牛胰島素 當美國的
維格納 奧德(V. du Vigneand,1901-1974)於1953年合成了第一個天然
多肽激素 (他因此而獲得了1955年度的諾貝爾化學獎),英國的桑格(F. Sanger,1918-)於1955完成了胰島素的全部測序工作(他因此而獲得了1958年度的
諾貝爾化學獎 )之後,
人工合成胰島素 就成了一項世界性的熱門課題。據媒體報導,1955-1965年間,在世界範圍內共有10個研究小組在進行胰島素的人工合成 。
研究路線的確定 1956年,即在桑格因率先測定了牛胰島素的化學結構,並由此而獲得了諾貝爾獎的第二年,另一位英國著名科學家在國際權威的《自然》雜誌評論文章中預言:“人工合成胰島素還有待於遙遠的將來”。在這種情況下,1958年的上半年,中科院上海生化所的科技人員提出研究“人工合成胰島素”這一意義重大、難度很高、國際上還沒有人開始研究的基礎科研項目。
然而,對於一個蛋白質的合成來說,必須拿到了與天然物的
生物活性 和結構完全相同的純產物,才能算得上實現了它的全合成。由於胰島素分子不但化學結構複雜,而且還具有蛋白質分子的特定構象。因此,
人工合成胰島素 不僅要完成
肽鏈 的合成,而且還要求使合成的肽鏈能夠摺疊成具有與天然胰島素同樣構象的活性分子。而當時的胰島素的“家族”中,牛胰島素是唯一被測定了化學結構的,於是便作出了
人工合成牛胰島素 的審慎抉擇。
這一重大基礎科研項目一經提出,立即得到中國國家領導的重視。在
王應睞 所長的同意和支持下,決定將已有的由
鈕經義 領導的蛋白質人工合成組、
曹天欽 領導的
蛋白質結構 功能組和
鄒承魯 領導的酶組聯合起來,成立一個由曹天欽任組長的“五人領導小組”,採用五路進軍的方案,即1、抓住天然胰島素A、B鏈拆合的關鍵;2、加強多肽的合成力量,發展
多肽 合成;3、組織生產原料胺基酸和
多肽合成 試劑;4、開展有關胰島素構象的研究,並從胰島素酶解產物中分離純化天然肽段,以期用作化學合成或酶促合成更大肽段的原料;5、開展
肽鏈 的酶促合成和
轉肽反應 的研究,向著牛胰島素人工合成研究的成功彼岸挺進。
科學研究 研究過程 按照這個方案積極組織人員,使各項研究工作很快順利展開。首先,在沈昭文的指導下,胺基酸的生產工藝建立起來,胰島素B鏈中幾個小片段人工合成完成;其後,
杜雨蒼 、
張友尚 等發現:天然胰島素A、B鏈經S—磺酸化後,不僅能分離純化得到穩定產物,而且容易進行A、B鏈的重組,並得到有5~10%的胰島素活性產物。1959年的這一成功,奠定了胰島素合成可以採用化學合成A、B鏈的路線,至此,胰島素的合成研究取得了初步的進展。在此後的幾年裡,雖投入了“大兵團作戰”,但並未取得實質性突破。
直到1963年,
鄒承魯 領導研究的天然胰島素A、B鏈重組生成胰島素的產率,由原來的5~10%提高到50%左右;1964年,
鈕經義 、
龔岳亭 領導的
多肽合成 組人工合成B鏈。並與天然A鏈重組構建胰島素獲得成功;1965年,中科院有機所和北京大學化學系合作,由
汪猷 和
邢其毅 領導的聯合研究小組完成了胰島素A鏈的化學合成,上海生化所化學合成的胰島素B鏈進行重組取得成功,並純化得到了具有與天然胰島素完全相同的比活性和
抗原性 的
人工合成牛胰島素 結晶,且其結晶形狀和
酶切 圖譜也與天然物相同。
人工合成胰島素 的成功,宣告了中國科學工作者歷經八年的科研攻關,奪得了這項科學競賽的“世界冠軍”。
隨後,由
曹天欽 主持起草論文,將這一重要科學研究成果首先以簡報形式發表在1965年11月的《中國科學》雜誌上,並於1966年4月全文發表。
科學意義 人工合成牛胰島素 是科學上的一次重大飛躍,它標誌著人工合成蛋白質時代的開始;是生命科學發展史上一個新的重要里程碑.在揭示生命奧秘的偉大曆程中邁進了可喜的一大步。同時,它也是中國自然科學基礎研究的重大成就。
醫學功能 消炎作用 抗動脈硬化作用 載脂蛋白E 基因 缺陷是引起動脈硬化的原因。因此臨床上可以使用牛胰島素,不必擔心胰島素會加重
動脈粥樣硬化 的發生。還有人進行了胰島素口服治療動脈粥樣硬化的試驗,結果硬化塊減少,硬化面積下降22%-37%,由於口服胰島素已被胃液破壞,失去降糖作用,故而抗動脈粥樣硬化與胰島素抗炎和保護
內皮細胞 作用有關,與降糖作用無關。
抗血小板聚集作用 正常的血管內皮細胞具有抗血小板聚集作用,一般不會發生
動脈粥樣硬化 ,而
高血糖 、
高血脂 、高血壓會激活
內皮細胞 的
氧化應激 反應,損傷內皮,血小板的聚集作用起到了推波助瀾的作用。牛胰島素的降血糖作用間接起到了保護內皮細胞作用。
治療骨質增生 牛胰島素可增強
成骨細胞 活性,合成
膠原纖維 ,促使骨質對胺基酸的攝取,牛胰島素還可促使維生素D的合成和鈣和吸收,有利於骨質形成,最適合糖尿病合併骨質疏鬆的治療。
治療精神疾病 牛胰島素低
血糖 療法主要用於中毒性精神病的
精神錯亂 和
震顫性譫妄 ,對焦慮、緊張和
神經衰弱 也有效。 不同類別的牛胰島素也有不同的作用。(牛)胰島素分為三種類型,即中長效牛胰島素、短效牛胰島素、專降
餐後血糖 的超短效牛胰島素。
中長效牛胰島素也稱為
預混胰島素 ,是把
短效胰島素 和中效胰島素按不同比例混合形成的。它的起效時間為1小時~2小時,持續時間為12小時左右,一天注射兩次,一般的2型糖尿病患者都適合,但需要在注射後半小時之後才可吃飯。
短效牛胰島素適合於血糖不容易控制的人群,以及餐後血糖特別高的人群。他們在臨睡前還需再加一次中
長效胰島素 ,以維持夜間的
基礎胰島素 需要量,保持夜間
血糖 平穩。注射後20分鐘~30分鐘起效,持續時間為4小時~6小時,一天需要注射3次~4次。它的特點是見效快,濃度大,單位時間內降糖效果強,可以皮下、肌肉或
靜脈注射 。
關於胰島素醫學文獻 專降
餐後血糖 的牛胰島素起效特別快,10分鐘之後就開始起作用了,它是專門針對
餐後血糖高 的患者,在注射完畢後即可吃飯。它的持續時間也較其他胰島素短,為1小時~2小時。
作用機理 為什麼牛胰島素對患者有那么大的作用?這必須從牛胰島素的作用機理談起。
調節糖代謝 胰島素能促進全身組織對葡萄糖的攝取和利用,並抑制
糖原 的分解和糖原異生,因此,牛胰島素有降低
血糖 的作用。胰島素分泌過多時,血糖下降迅速,腦組織受影響最大,可出現
驚厥 、昏迷,甚至引起胰島素
休克 。相反,胰島素分泌不足或
胰島素受體 缺乏常導致血糖升高;若超過
腎糖閾 ,則糖從尿中排出,引起糖尿;同時由於血液成份中改變(含有過量的葡萄糖), 亦導致高血壓、
冠心病 和
視網膜 血管病等病變。
胰島素與糖尿病關係 牛胰島素降血糖是多方面作用的結果:
(1)促進肌肉、
脂肪組織 等處的
靶細胞 細胞膜載體將血液中的葡萄糖轉運入細胞內進行代謝。
(4)通過抑制PEP羧激酶的合成以及減少
糖異生 的原料,抑制糖異生。
調節脂肪代謝 關於胰島素醫學文獻
牛胰島素能促進脂肪的合成與貯存,使血中
游離脂肪酸 減少,同時抑制脂肪的分解氧化。胰島素缺乏可造成脂肪代謝紊亂,脂肪貯存減少,分解加強,血脂升高,久之可引起動脈硬化,進而導致
心腦血管 的嚴重疾患;與此同時,由於脂肪分解加強,生成大量酮體,出現
酮症 酸中毒 。
調節蛋白質代謝 胰島素一方面促進細胞對胺基酸的攝取和蛋白質的合成,一方面抑制蛋白質的分解,因而有利於生長。
腺垂體 生長激素 的促
蛋白質合成 作用,必須有胰島素的存在才能表現出來。因此,對於生長來說,胰島素也是不可缺少的激素之一。
其它功能 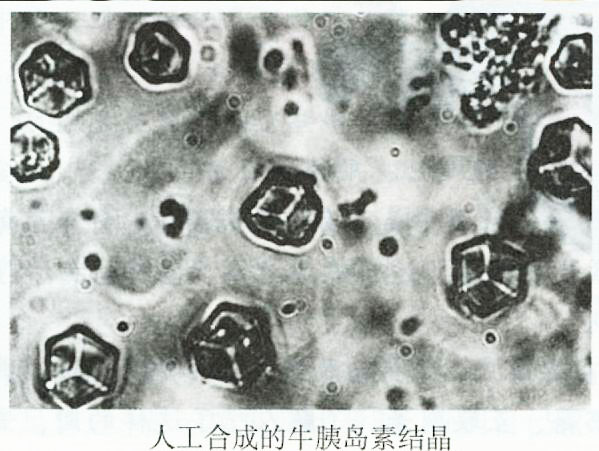
 牛胰島素結構模型
牛胰島素結構模型


 關於胰島素醫學文獻
關於胰島素醫學文獻 胰島素與糖尿病關係
胰島素與糖尿病關係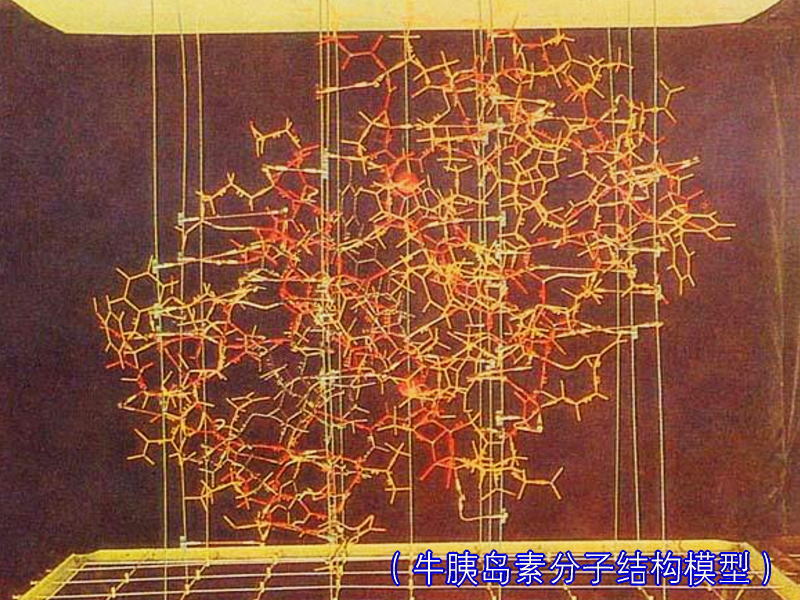

 牛胰島素結構模型
牛胰島素結構模型


 關於胰島素醫學文獻
關於胰島素醫學文獻 胰島素與糖尿病關係
胰島素與糖尿病關係