簡介 它主要由帶針尖的微
懸臂 、微懸臂運動檢測裝置、監控其運動的反饋迴路、使樣品進行掃描的壓電陶瓷掃描器件、
計算機 控制的圖像採集、顯示及處理系統組成。微
懸臂 運動可用如隧道
電流 檢測等
電學 方法或光束偏轉法、干涉法等光學方法檢測,當針尖與樣品充分接近相互之間存在短程相互斥力時,檢測該斥力可獲得表面原子級分辨圖像,一般情況下
解析度 也在
納米 級水平。AFM測量對
樣品 無特殊要求,可測量固體表面、吸附體系等。
生物型原子力顯微鏡 原理 概括 原子力顯微鏡 (atomic force microscope,簡稱AFM)利用微懸臂感受和放大懸臂上尖細探針與受測樣品原子之間的作用力,從而達到檢測的目的,具有原子級的
解析度 。由於原子力顯微鏡既可以觀察
導體 ,也可以觀察非導體,從而彌補了
掃描隧道顯微鏡 的不足。原子力顯微鏡是由IBM公司蘇黎世研究中心的
格爾德·賓寧 於一九八五年所發明的,其目的是為了使非
導體 也可以採用類似
掃描探針顯微鏡 (SPM)的觀測方法。原子力顯微鏡(AFM)與
掃描隧道顯微鏡 (STM)最大的差別在於並非利用電子隧穿效應,而是檢測原子之間的接觸,原子鍵合,
范德瓦耳斯力 或
卡西米爾效應 等來呈現樣品的表面特性。
詳細 原子力顯微鏡的基本原理是:將一個對微弱力極敏感的微
懸臂 一端固定,另一端有一微小的針尖,針尖與
樣品 表面輕輕接觸,由於針尖尖端原子與樣品表面原子間存在極微弱的排斥力,通過在掃描時控制這種力的恆定,帶有針尖的微懸臂將對應於針尖與樣品表面原子間作用力的等位面而在垂直於樣品的表面方向起伏運動。利用光學檢測法或隧道電流檢測法,可測得微
懸臂 對應於掃描各點的位置變化,從而可以獲得樣品
表面形貌 的信息。我們以雷射檢測原子力顯微鏡(Atomic Force Microscope Employing Laser Beam Deflection for Force Detection,Laser-AFM)來詳細說明其工作原理。
圖1. 雷射檢測原子力顯微鏡探針工作示意圖 如圖1所示,
二極體雷射器 (Laser Diode)發出的雷射束經過
光學系統 聚焦在微
懸臂 (Cantilever)背面,並從微懸臂背面反射到由光電二極體構成的光斑位置
檢測器 (Detector)。在
樣品 掃描時,由於樣品表面的原子與微
懸臂 探針尖端的原子間的相互作用力,微懸臂將隨樣品
表面形貌 而彎曲起伏,反射光束也將隨之偏移,因而,通過光電二極體檢測光斑位置的變化,就能獲得被測樣品表面形貌的信息。
在系統檢測成像全過程中,探針和被測樣品間的距離始終保持在
納米 (10e-9米)量級,距離太大不能獲得樣品表面的信息,距離太小會損傷探針和被測樣品,
反饋迴路 (Feedback)的作用就是在工作過程中,由探針得到探針-樣品相互作用的強度,來改變加在樣品掃描器垂直方向的電壓,從而使樣品伸縮,調節探針和被測樣品間的距離,反過來控制探針-樣品相互作用的強度,實現反饋控制。因此,反饋控制是本系統的核心工作機制。本系統採用數字反饋控制迴路,用戶在控制
軟體 的參數工具列通過以參考電流、積分增益和比例增益幾個參數的設定來對該反饋迴路的特性進行控制。
子力顯微鏡——原理圖 優缺點 優點 相對於
掃描電子顯微鏡 ,原子力顯微鏡具有許多優點。不同於
電子顯微鏡 只能提供二維圖像,AFM提供真正的
三維 表面圖。同時,AFM不需要對樣品的任何特殊處理,如鍍銅或碳,這種處理對樣品會造成不可逆轉的傷害。第三,
電子顯微鏡 需要運行在
高真空 條件下,原子力顯微鏡在常壓下甚至在液體環境下都可以良好工作。這樣可以用來研究
生物 巨觀分子,甚至活的
生物組織 。原子力顯微鏡與
掃描隧道顯微鏡 (Scanning Tunneling Microscope)相比,由於能觀測非導電樣品,因此具有更為廣泛的適用性。當前在科學研究和
工業 界廣泛使用的掃描力顯微鏡,其基礎就是原子力顯微鏡。
原子力顯微鏡觀察到的圖像 缺點 和
掃描電子顯微鏡 (SEM)相比,AFM的缺點在於成像範圍太小,速度慢,受探頭的影響太大。
儀器結構 在原子力顯微鏡(Atomic Force Microscopy,AFM)的系統中,可分成三個部分:力檢測部分、位置檢測部分、反饋系統。
力檢測部分 在原子力顯微鏡(AFM)的系統中,所要檢測的力是原子與原子之間的范德華力。所以在本系統中是使用微小
懸臂 (cantilever)來檢測原子之間力的變化量。微
懸臂 通常由一個一般100~500μm長和大約500nm~5μm厚的矽片或氮化矽片製成。微
懸臂 頂端有一個尖銳針尖,用來檢測樣品-針尖間的相互作用力。這微小
懸臂 有一定的規格,例如:長度、寬度、
彈性係數 以及針尖的形狀,而這些規格的選擇是依照樣品的特性,以及操作模式的不同,而選擇不同類型的探針。
位置檢測部分 在原子力顯微鏡(AFM)的系統中,當針尖與樣品之間有了互動作用之後,會使得
懸臂 cantilever擺動,當
雷射 照射在微懸臂的末端時,其反射光的位置也會因為懸臂擺動而有所改變,這就造成偏移量的產生。在整個系統中是依靠雷射光斑位置
檢測器 將偏移量記錄下並轉換成電的信號,以供SPM控制器作信號處理。
原子力顯微鏡 反饋系統 在原子力顯微鏡(AFM)的系統中,將信號經由
雷射檢測器 取入之後,在反饋系統中會將此信號當作反饋信號,作為內部的調整信號,並驅使通常由壓電陶瓷管制作的掃描器做適當的移動,以保持樣品與針尖保持一定的作用力。
總結 AFM系統使用壓電陶瓷管制作的掃描器精確控制微小的掃描移動。壓電陶瓷是一種性能奇特的材料,當在壓電陶瓷對稱的兩個端面加上電壓時,壓電陶瓷會按特定的方向伸長或縮短。而伸長或縮短的尺寸與所加的電壓的大小成
線性關係 。即可以通過改變電壓來控制壓電陶瓷的微小伸縮。通常把三個分別代表X,Y,Z方向的壓電陶瓷塊組成三角架的形狀,通過控制X,Y方向伸縮達到驅動探針在樣品表面掃描的目的;通過控制Z方向壓電陶瓷的伸縮達到控制探針與樣品之間距離的目的。
原子力顯微鏡(AFM)便是結合以上三個部分來將樣品的表面特性呈現出來的:在原子力顯微鏡(AFM)的系統中,使用微小懸臂(cantilever)來感測針尖與樣品之間的相互作用,這作用力會使微懸臂擺動,再利用雷射將光照射在懸臂的末端,當擺動形成時,會使
反射光 的位置改變而造成偏移量,此時雷射
檢測器 會記錄此偏移量,也會把此時的信號給反饋系統,以利於系統做適當的調整,最後再將樣品的表面特性以
影像 的方式給呈現出來。
工作模式 原子力顯微鏡的工作模式是以針尖與樣品之間的作用力的形式來分類的。主要有以下3種操作模式:接觸模式(contact mode) ,非接觸模式( non - contact mode) 和敲擊模式( tapping mode)。
接觸模式 從概念上來理解,接觸模式是AFM最直接的成像模式。AFM 在整個掃描成像過程之中,探針針尖始終與樣品表面保持緊密的接觸,而
相互作用力 是排斥力。掃描時,
懸臂 施加在針尖上的力有可能破壞
試樣 的
表面結構 ,因此力的大小範圍在10 - 10~10 - 6 N。若
樣品 表面柔嫩而不能承受這樣的力,便不宜選用接觸模式對樣品表面進行成像。
非接觸模式 非接觸模式探測試樣表面時
懸臂 在距離試樣表面上方5~10 nm 的距離處振盪。這時,樣品與針尖之間的相互作用由范德華力控制,通常為10 - 12 N ,樣品不會被破壞,而且針尖也不會被污染,特別適合於研究柔嫩物體的表面。這種操作模式的不利之處在於要在室溫
大氣 環境下實現這種模式十分困難。因為
樣品 表面不可避免地會積聚薄薄的一層水,它會在樣品與針尖之間搭起一小小的毛細橋,將針尖與表面吸在一起,從而增加尖端對表面的壓力。
敲擊模式 敲擊模式介於接觸模式和非接觸模式之間,是一個雜化的概念。
懸臂 在試樣表面上方以其
共振頻率 振盪,針尖僅僅是周期性地短暫地接觸/ 敲擊樣品表面。這就意味著針尖接觸樣品時所產生的側向力被明顯地減小了。因此當檢測柔嫩的樣品時,AFM的敲擊模式是最好的選擇之一。一旦AFM開始對
樣品 進行成像掃描,裝置隨即將有關數據輸入系統,如表面粗糙度、平均高度、峰谷峰頂之間的最大距離等,用於物體
表面分析 。同時,AFM 還可以完成
力的測量 工作,測量
懸臂 的彎曲程度來確定針尖與樣品之間的作用力大小。
三種模式的比較 接觸模式(Contact Mode):
優點:
掃描速度 快,是唯一能夠獲得“原子
解析度 ”圖像的AFM垂直方向上有明顯變化的質硬樣品,有時更適於用Contact Mode掃描成像。
缺點:橫向力影響圖像質量。在空氣中,因為樣品
表面吸附 液層的
毛細作用 ,使針尖與樣品之間的粘著力很大。橫向力與粘著力的合力導致圖像
空間解析度 降低,而且針尖刮擦樣品會損壞軟質樣品(如
生物 樣品,聚合體等)。
非接觸模式:
優點:沒有力作用於樣品表面。
缺點:由於針尖與樣品分離,
橫向解析度 低;為了避免接觸
吸附層 而導致針尖膠粘,其掃描速度低於Tapping Mode和Contact Mode AFM。通常僅用於非常怕水的樣品,吸附液層必須薄,如果太厚,針尖會陷入液層,引起反饋不穩,刮擦樣品。由於上述缺點,on-contact Mode的使用受到限制。
輕敲模式:
優點:很好的消除了橫向力的影響。降低了由吸附液層引起的力,
圖像解析度 高,適於觀測軟、易碎、或膠粘性樣品,不會損傷其表面。
缺點:比Contact Mode AFM 的掃描速度慢。
其他模式 除了上面三種常見的三種工作模式外,原子力顯微鏡還可以進行下面的工作:
1、橫向力顯微鏡(LFM)
橫向力顯微鏡(LFM)是在原子力顯微鏡(AFM)
表面形貌 成像基礎上發展的新技術之一。工作原理與接觸模式的原子力顯微鏡相似。當微
懸臂 在
樣品 上方掃描時,由於針尖與樣品表面的相互作用,導致懸臂擺動,其擺動的方向大致有兩個:垂直與水平方向。一般來說,雷射位置探測器所探測到的垂直方向的變化,反映的是樣品表面的形態,而在水平方向上所探測到的信號的變化,由於物質表面材料特性的不同,其摩擦係數也不同,所以在掃描的過程中,導致微
懸臂 左右扭曲的程度也不同,
檢測器 根據雷射束在四個象限中,(A+C)-(B+D)這個強度差值來檢測微懸臂的扭轉彎曲程度。而微
懸臂 的扭轉彎曲程度隨表面摩擦特性變化而增減(增加
摩擦力 導致更大的扭轉)。雷射
檢測器 的四個象限可以實時分別測量並記錄形貌和橫向力數據。
SFM除了形貌測量之外,還能測量力對探針-樣品間距離的關係曲線Zt(Zs)。它幾乎包含了所有關於
樣品 和針尖間相互作用的必要信息。當微
懸臂 固定端被垂直接近,然後離開樣品表面時,微懸臂和樣品間產生了相對移動。而在這個過程中微
懸臂 自由端的探針也在接近、甚至壓入樣品表面,然後脫離,此時原子力顯微鏡(AFM)測量並記錄了探針所感受的力,從而得到力曲線。Zs是樣品的移動,Zt是微
懸臂 的移動。這兩個移動近似於垂直於樣品表面。用
懸臂 彈性係數 c乘以Zt,可以得到力F=c·Zt。如果忽略樣品和針尖彈性變形,可以通過s=Zt-Zs給出針尖和樣品間相互作用距離s。這樣能從Zt(Zs)曲線決定出力-距離關係F(s)。這個技術可以用來測量探針尖和樣品表面間的排斥力或長程吸引力,揭示定域的化學和機械性質,像粘附力和彈力,甚至吸附分子層的厚度。如果將探針用特定分子或
基團 修飾,利用力曲線分析技術就能夠給出特異結合分子間的力或鍵的強度,其中也包括特定分子間的膠體力以及
疏水力 、長程引力等。
掃描探針
納米 加工技術是
納米科技 的核心技術之一,其基本的原理是利用SPM的探針-
樣品 納米可控定位和運動及其
相互作用 對樣品進行納米加工操縱,常用的納米加工技術包括:機械刻蝕、電致/場致刻蝕、浸潤筆(Dip-Pen Nano-lithography,DNP)等。
對樣品的要求 原子力顯微鏡研究對象可以是有機固體、聚合物以及
生物大分子 等,樣品的載體選擇範圍很大,包括雲母片、玻璃片、
石墨 、拋光矽片、
二氧化矽 和某些生物膜等,其中最常用的是新剝離的雲母片,主要原因是其非常平整且容易處理。而拋光矽片最好要用濃硫酸與30%
雙氧水 的7∶3 混合液在90 ℃下煮1h。利用電性能測試時需要導電性能良好的載體,如石墨或鍍有金屬的基片。
試樣的厚度,包括試樣台的厚度,最大為10 mm。如果試樣過重,有時會影響Scanner的動作,請不要放過重的試樣。試樣的大小以不大於試樣台的大小(直徑20 mm)為大致的標準。稍微大一點也沒問題。但是,最大值約為40 mm。如果未固定好就進行測量可能產生移位。請固定好後再測定。
套用 隨著科學技術的發展,生命科學開始向
定量 科學方向發展。大部分實驗的研究重點已經變成
生物大分子 ,特別是核酸和蛋白質的結構及其相關功能的關係。因為AFM的工作範圍很寬,可以在自然狀態(空氣或者液體)下對
生物醫學 樣品 直接進行成像,
解析度 也很高。因此,AFM已成為研究
生物 醫學樣品和生物大分子的重要工具之一。AFM套用主要包括三個方面:
生物 細胞的表面形態觀測;生物大分子的結構及其他性質的觀測研究;生物分子之間力譜曲線的觀測。
AFM可以用來對細胞進行形態學觀察,並進行圖像的分析。通過觀察細胞表面形態和
三維 結構,可以獲得細胞的表面積、厚度、寬度和
體積 等的量化參數等。例如,利用AFM可以對感染病毒後的細胞表面形態的改變、
造骨細胞 在加入底物(鈷鉻、鈦、鈦釩等)後細胞形態和細胞彈性的變化、GTP對胰腺外分泌細胞囊泡高度的影響進行研究。利用AFM還可以對
自由基 損傷的
紅細胞膜 表面
精細結構 的研究,直接觀察到自由基損傷,以及加女貞子保護作用後,對紅細胞膜分子形態學的影響。
生物大分子的結構及其他性質的觀測研究
對於蛋白質,AFM的出現極大的推動了其研究進展。AFM可以觀察一些常見的蛋白質,諸如白蛋白,血紅蛋白,胰島素及
分子馬達 和噬菌調理素吸附在圖同固體界面上的行為,對於了解
生物相 溶性,體外細胞的生長,蛋白質的純化,膜中毒有很大幫助。例如,Dufrene 等利用AFM 考察了吸附在
高分子 支撐材料表面上的膠原蛋白的組裝行為。結合X-射線光電子能譜技術和輻射標記技術,他們提出了一個定性解釋其
層狀結構 的
幾何模型 。AFM 實驗證實了膠原蛋白組裝有時連續,有時不連續的性質,通過形貌圖也提供了膠原蛋白纖維狀結構特徵。Quist等利用AFM 研究了白蛋白和豬胰島素在雲母基底上的吸附行為,根據AFM 圖上不同尺寸的小丘狀物質推測,蛋白質有時發生聚集,有時分散分布。Epand 等則利用AFM 技術研究了一類感冒病毒的紅血球
凝集素 ,首次展示了一種膜
溶原 蛋白
自組裝 形成病毒摺疊蛋白分子外域的實時過程。
在AFM 觀察包裹有
紫膜 的噬菌調理素蛋白(BR) 的研究中,AFM
儀器 的改進,檢測技術的提高和制樣技術的完善得到了集中的體現。在細胞中,分子馬達可以將
化學能 轉變為機械運動,防止因為布朗運動導致的細胞中具有方向性的活動出現錯誤,這些活動包括:肌漿球蛋白,運動蛋白,動力蛋白,螺旋酶,DNA
聚合酶 和RNA 聚合酶等分子
馬達蛋白 的共同特點是沿著一條線性軌道執行一些與
生命活動 息息相關的功能,比如肌肉的收縮,
細胞的分化 過程中染色體的隔離,不同細胞間的
細胞器 的置換以及
基因信息 的解碼和複製等。由於分子馬達本身的微型化,它們容易受更高的熱能和大的波動的影響,了解馬達分子如何正常有序工作就成為一項具有挑戰性的任務。利用AFM,人們已經知道了
肌動蛋白結合蛋白 的結構信息和
細胞運動 過程中肌動蛋白骨架調控功能。
AFM液相成像技術的優點在於消除了毛細作用力,針尖
粘滯力 ,更重要的是可以在接近生理條件下考察DNA 的單分子行為。DNA 分子在
緩衝溶液 或水溶液中與基底結合不緊密,是液相AFM面臨的主要困難之一。
矽烷化 試劑 ,如3-氨丙基三乙氧基矽烷(
APTES )和
陽離子 磷脂雙層 修飾的雲母基底固定DNA 分子,再在
緩衝液 中利用AFM 成像,可以解決這一難題。在氣相條件下
陽離子 參與DNA的沉積已經發展十分成熟,適於AFM 觀察。在液相條件下,
APTES 修飾的雲母基底較常用。目前DNA的許多
構象 諸如彎曲,
超螺旋 ,小環結構,三鏈
螺旋結構 ,DNA 三通接點構象,DNA 複製和重組的中間體構象,
分子開關 結構和藥物分子插入到DNA 鏈中的相互作用都廣泛地被AFM考察,獲得了許多新的理解。
AFM對RNA的研究還不是很多。結晶的轉運RNA 和單鏈病毒RNA 以及寡聚Poly (A) 的單鏈RNA 分子的AFM 圖像已經被獲得。因為在於不同的緩衝條件下,單鏈RNA 的結構變化十分複雜,所以單鏈RNA 分子的圖像不容易採集。(利用AFM成像RNA分子需要對
樣品 進行特殊和複雜的處理。Bayburt 等借鑑Ni2 + 固定DNA 的方法在緩衝條件下獲得了單鏈Pre-m RNA 分子的AFM 圖像。他們的做法如下: (1) 用酸處理被Ni2 + 修飾的雲母基底以增加結合力; (2) RNA 分子在70℃退火,慢慢將其冷卻至室溫再滴加在用酸處理過的Ni2 +-雲母基底上。採用AFM 單
分子力 譜技術,在Mg2 + 存在的溶液中,Liphardt 等研究了形貌多變的RNA 分子的機械去摺疊過程,發現了從
髮夾結構 到三螺旋
連線體 這些RNA 分子三級結構的過渡態。隨後他們又利用RNA 分子證實了可逆非平衡功函和可逆平衡
自由能 在
熱力學 上的等效性。)
2.4
核酸 與蛋白質複合物( Nuclearacids-Protein Complex)
DNA 和蛋白質分子的特定相互作用在分子
生物 學中起著關鍵作用。蛋白質與DNA 結合的精確位點圖譜和不同細胞狀態下結合位點的測定對於了解複雜細胞體系的功能與機理,特別是基因表達的控制都十分關鍵。AFM 作為一種高度分辨達0。1 nm,寬度
解析度 為2 nm 左右的
表面分析技術 ,已廣泛地用於表征各類DNA-蛋白質的複合物。低濕度
大氣 條件下,Rees 等利用AFM 在接觸模式下考察了λ2PL 啟動子在啟動和關閉轉錄過程中對DNA 鏈彎曲程度的影響。此外,這個小組還研究了另外一種λ2
轉錄因子 ,Cro-蛋白對DNA 彎曲的影響。為了研究Jun 蛋白的結合是否會引起DNA 鏈的彎曲,Becker等利用AFM研究了包含一個AP21 結合位點的
線性化 質粒DNA 與Jun 蛋白的複合物。Aizawa小組對DNA 蛋白激酶Ku 亞結構域和雙鏈DNA斷裂的相關性進行了研究。Kasas 等研究了大腸桿菌RNA
聚合酶 (RNAP) 轉錄過程中的動態酶活性。他們的方法是在Zn2 + 存在的條件下,RNAP 能夠鬆散或緊密地與DNA 模板進行結合,通過AFM 成像了解其動態過程。
AFM 不僅能夠提供超光學極限的
細胞結構 圖像,還能夠探測細胞的微機械特性,利用AFM 力-曲線技術甚至能夠實時地檢測
細胞動力學 和
細胞運動 過程。利用AFM 研究細胞很少用樣品預處理,尤其是能夠在近生理條件下對它們進行研究。
利用AFM 直接成像方法,可以對固定的活細胞和亞
細胞結構 進行了深入研究。這些研究獲得了關於
細胞器 的構造,
細胞膜 和細胞骨架更詳細的信息。將細胞固定在基底上再進行AFM 觀察,可以得到
細胞膜 結構的皺褶,層狀
脂肪 物,微
端絲 和微絨毛等特徵。由於
細胞質膜 掩蓋了細胞內部骨架,現在已經發展了一種仔細剝離該層膜的方法,並利用AFM 對剝離細胞膜後的結構進行了研究。
AFM 在細胞研究方面的一個最重要用途是對
活細胞 的動力學過程,細胞間的相互作用以及細胞對其內外干擾因素的回響進行實時成像目前,AFM已經可以對外來病毒感染的細胞進行實時考察。AFM還可以研究活性狀態下血小板形狀的變化情況和培養的胰腺細胞對澱粉消化酶的回響情況。
早期,AFM 在
生物 學上的套用主要集中在病毒研究。Kolbe 等首次研究了具有不同頭尾結構的T4 噬菌體。Imai 及其合作者分別對
菸草花葉病毒 和各類
噬菌體 進行了考察。菸草花葉病毒( TMV) 或星形菸草花葉病毒(STMV) 是迄今研究得最多的病毒類型。在
膠體溶液 中,TMV非常類似已知的蛋白質行為,可以採用研究蛋白質的方法對其進行考察。利用AFM,可以研究高度過飽和和輕微過飽和條件下TMV的二維成核生長過程。AFM研究表明,當TYMV 暴露在平衡條件下的溶液中,TYMV
晶體 的(101) 面逐層向上生長,晶格的結構
缺陷 如空位,單粒子,位錯和聚集等現象在AFM 圖上區分得十分清楚。Turner 等利用從AIDS 病毒中提取的
逆轉錄 酶修飾AFM橫樑,使之成為一種能檢測抑制酶的活力和篩選使AIDS 病毒失活藥物的方法。自支撐磷脂膜與感冒病毒結合作用以及缺陷位點結構上底物暴露的磷脂單層效應和水合雙層磷脂的檢測被發展成了一種新型
生物 感測器,這種感測器能夠從其它大分子中識別特定的病毒物質。這些結果都被AFM 圖像所證實。
對
生物 分子表面的各種
相互作用力 進行測量,是AFM的一個十分重要的功能。這對於了解
生物 分子的結構和物理特性是非常有意義的。因為這種作用力決定兩種分子的相互吸引或者排斥,接近或者離開,
化學鍵 的形成或者斷裂,
生物 分子立體構像的維持或者改變等等。在
分子間作用力 的支配下,還同時支配著
生物 體內的各種生理現象、生化現象、藥物藥理現象,以及離子通道的開放或關閉,受體與配體的結合或去結合,酶功能的激活或抑制等等。因此,
生物 分子間作用力的研究,在某種意義上說,就是對
生命體 功能活動中最根本原理的研究。這也為人們理解生命原理,提供了一個新的研究手段和工具。
將兩種分子分別固定於AFM的基底和探針尖端上。然後使帶有一種分子的探針尖端在垂直方向上不斷地接近和離開基底上的另一種分子。這時,兩種分子間的相互作用力,就是二者間的相對距離的函式。這種力與距離間的
函式關係 曲線,稱之為力譜曲線。
利用
AFM 獲得的力譜曲線在
生物 醫學中的套用:在探測一個細胞之後,根據所遇到的阻力,AFM就會賦予一個表明細胞柔軟度的數值。研究人員發現,儘管正常細胞的硬度各有不同,但癌細胞比正常細胞要柔軟得多,所研究的
胰腺 、肺部和乳腺細胞均是如此。一些腫瘤的細胞可能比另外一些更為堅硬,那就意味著這些腫瘤惡化轉移的可能性較小,對病人的威脅也較小。利用AFM還可以研究不同藥物對癌細胞的影響。針對細胞用藥後,AFM可以觀察在藥物的作用下細胞的變化情況。這樣可以開發出比當前所用的藥物毒性更小、但同樣能夠阻止正常細胞發生癌變的藥物,以免因
癌症 擴散而危及生命。
 生物型原子力顯微鏡
生物型原子力顯微鏡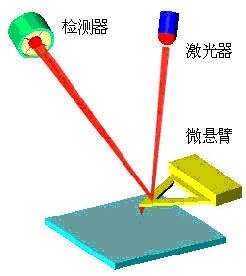 圖1. 雷射檢測原子力顯微鏡探針工作示意圖
圖1. 雷射檢測原子力顯微鏡探針工作示意圖 原子力顯微鏡觀察到的圖像
原子力顯微鏡觀察到的圖像 原子力顯微鏡
原子力顯微鏡
 生物型原子力顯微鏡
生物型原子力顯微鏡 圖1. 雷射檢測原子力顯微鏡探針工作示意圖
圖1. 雷射檢測原子力顯微鏡探針工作示意圖 原子力顯微鏡觀察到的圖像
原子力顯微鏡觀察到的圖像 原子力顯微鏡
原子力顯微鏡