概況
PAS染色法(
Periodic
Acid-
Schiff stain)在
組織學上,主要用來檢測組織中的糖類。過碘酸把糖類相鄰兩個碳上的羥基氧化成
醛基,再用Schiff試劑和
醛基反應使呈現紫紅色。
原理
PAS染色又稱糖原染色。一般用來顯示糖原和其它多糖物質。
原理:過碘酸能使細胞內的
多糖乙二醇基氧化成
乙二醛,再與
Schiff氏液的無色
品紅結合,紅色,定位於
胞漿上。
套用
方法
固定液
Carnoy固定液: 純酒精
60 ml 冰醋酸
10ml氯仿
30ml,也可以選用75%酒精.
液配製
1.過碘酸酒清夜配法:
過碘酸
(HIO .2H O) 0.4g 95%酒精
35ml M/5醋酸鈉(2.72g+蒸餾水100ml) 5ml蒸餾水
10ml保存於冰櫃內,用棕色瓶,可用兩周.
2.Schiff氏液:
0.5克
鹼性品紅加入100毫升蒸餾水中,時時搖動三角瓶5分鐘,使之充分溶解.冷卻至50℃後過濾加入10毫升1N
鹽酸.冷卻至25℃,加入0.5-1克偏重
硫酸鈉,在室溫中至少
靜置24小時,然後密封冰櫃保存.
3.Schiff氏酒精液配置 Schiff氏液 11.5ml 1N HCI 0.5ml 純酒精 23ml
染色步驟
2. 蒸餾水洗
3. 過碘酸酒清夜10min
4. 自來水沖洗10min
5.Schiff氏液10min
7.用哈瑞蘇木精或邁耶蘇木精染核3min(
細胞核染色過深可用鹽酸酒精分化)
8. 流水沖洗5min
9. 常規脫水、透明、封固
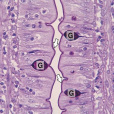
結果
PAS陽性為紅色,細胞核藍色。
實驗效果
準備
1、10g/L過碘酸液
2、Schiff染液:
DH2O 100ml
煮沸後,待片刻,加入
鹼性品紅,振盪數分鐘使品紅溶解,冷至50℃加入1M的
鹽酸20ml,
混勻。待冷
卻至25℃加入偏重亞硫酸鈉0.5g,混合,置於帶塞的棕色瓶中,放於暗處24小時,染液為無色,如為微紅則
加活性炭1-2g,混合過濾,如過濾液仍有紅色,應再加少許
活性炭,時紅色完全被吸收為止。製成後置於棕色
瓶內保存在冰櫃備用,如變為紅色,則不能使用。
DH2O 200ml
將
蘇木素溶於95%的乙醇,
鉀明礬溶於水(可加熱),然後將蘇木素液加入明礬液中混合,用強火煮
沸後加
氧化汞0.5g,迅速攪拌,成
深紫色,迅速移入冷水中,次日過濾,臨用時取此液95ml加冰醋酸
5ml,可使細胞著色清楚。
流程
2、10g/L過碘酸液作用20分鐘
3、DH2O洗滌幾次,晾乾
5、用自來水洗滌15分鐘(細水長流沖洗)
7、自來水沖洗15分鐘,待乾。
結果
陽性反應,胞漿呈紅色,陰性反應,胞漿呈無色;
在正常血片中RBC不染色;
PLT染成深紅色;
中性粒細胞胞漿染成紅色或深紅色,有些細胞有陽性顆粒;
單核細胞的胞漿染成淡紅色,可含有細小或粗大陽性顆粒;
少數
淋巴細胞的胞漿內含有少許小的淡紅色或紅色顆粒;
巨核細胞的胞漿內呈彌散紅色或深紅色。