基本介紹
- 中文名:鐵死亡
- 外文名:Ferroptosis
主要特徵

發生機制
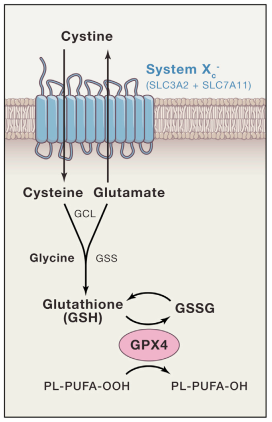
概念
結論
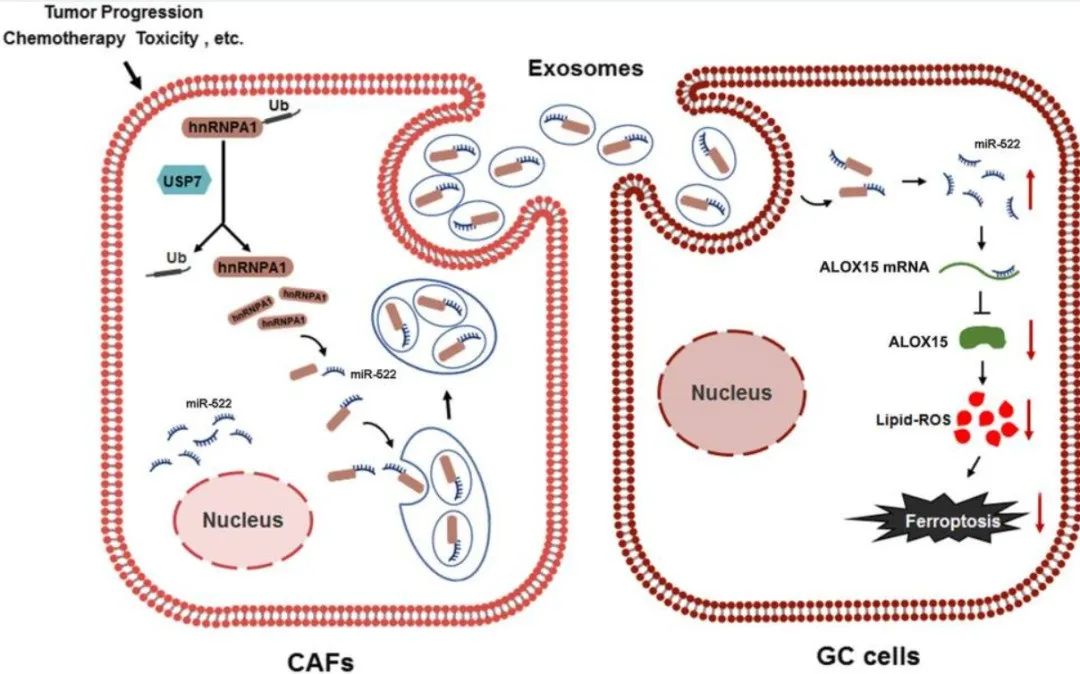
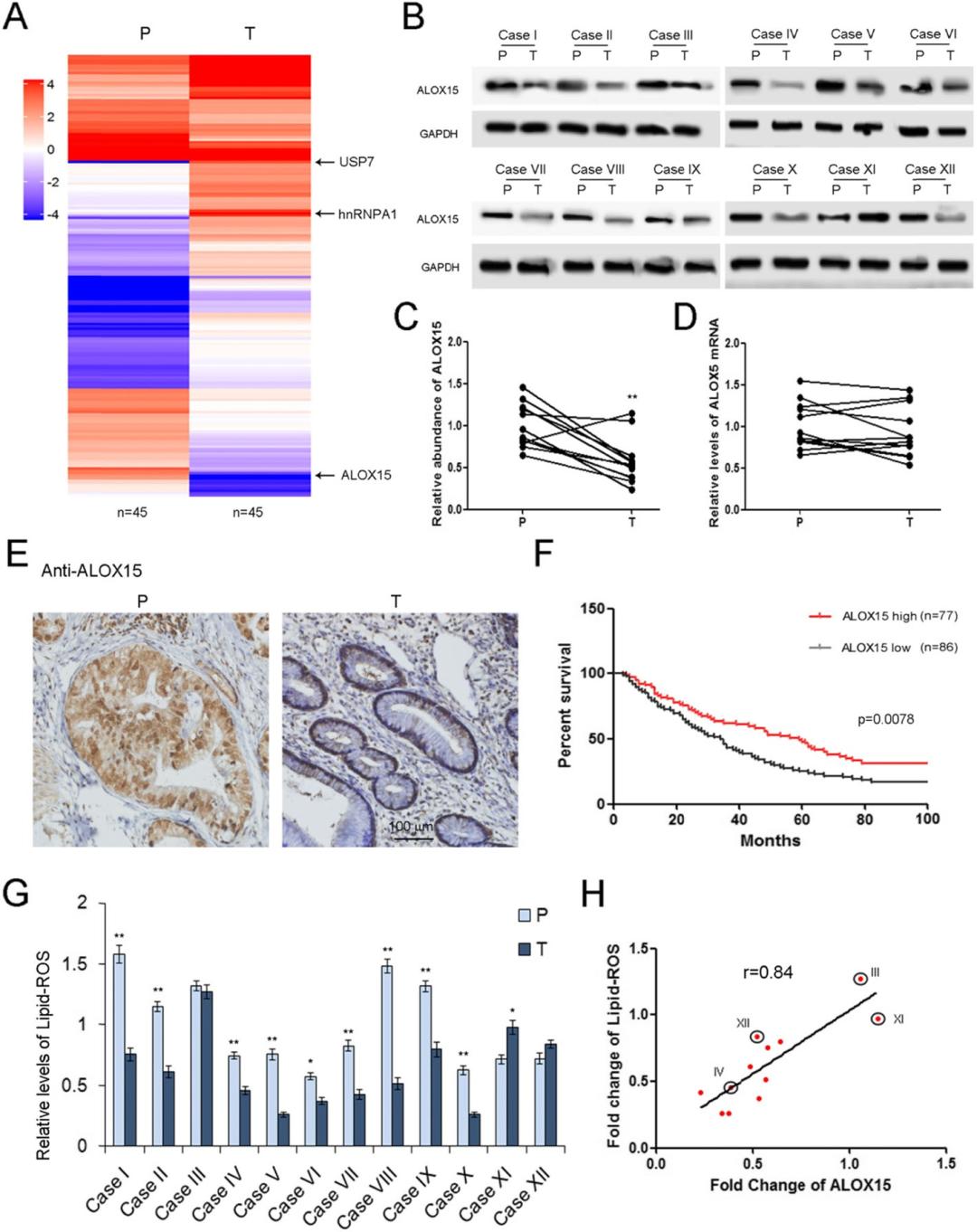
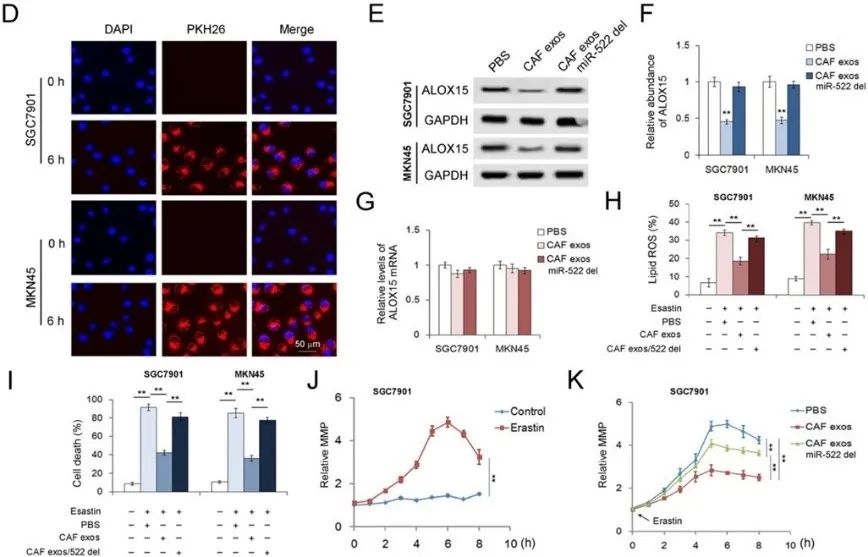
背景
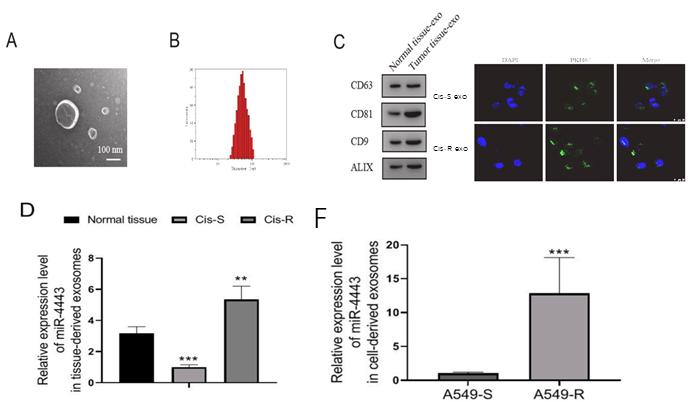
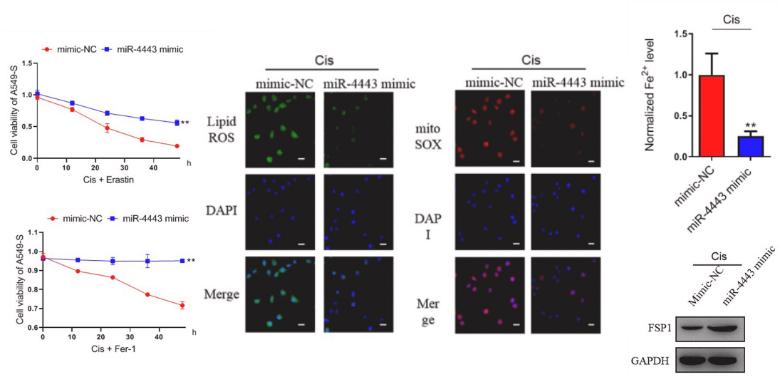
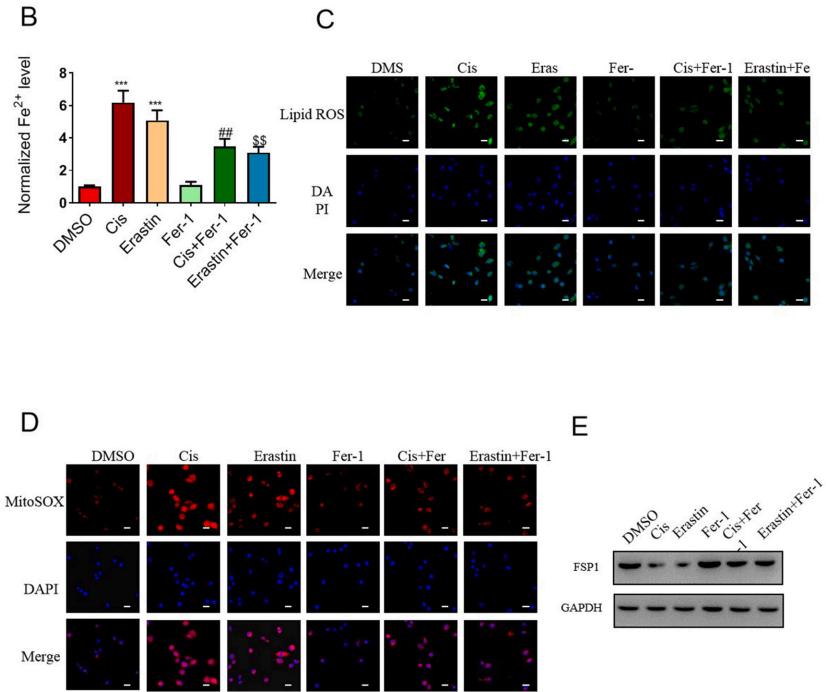
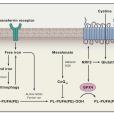








鐵死亡(Ferroptosis )是一種鐵依賴性的,區別於細胞凋亡、細胞自噬的新型的細胞程式性死亡方式。鐵死亡的主要機制是,在二價鐵或酯氧合酶的作用下,催化細胞膜上高表達的不飽和脂肪酸,發生脂質過氧化,從而誘導細胞死亡;...
《鐵死亡》是2023年科學出版社出版的圖書,王福俤主編。全書分為五篇,包括鐵死亡概念及基本理論、鐵死亡生物學調控、鐵死亡關鍵因子、鐵死亡與疾病診治,以及鐵死亡研究方法及模型。該書既可作為大專院校、科研院所和醫藥企業的專業科研工作者...
銅死亡(cuproptosis),多種銅離子載體藥物如伊利司莫(Elesclomol,ES)、雙硫侖(Disulfiram)及NSC319726等均可引起細胞死亡,這種銅誘導的細胞死亡是一種新型死亡方式,不同於其他程式性細胞死亡(如凋亡、焦亡、壞死及鐵死亡),因此...
閔軍霞,浙江大學轉化醫學院教授,2019年1月29日發布心臟細胞“鐵死亡”方案。簡介 浙江大學醫學院閔軍霞教授團隊發現,心臟細胞“鐵死亡”是心臟疾病的關鍵致病機制,並基於分子調控機制提出了多種預防心臟損傷的有效途徑。這一發現為心肌病及...
鐵死亡是一種由高度不飽和磷脂的過氧化修飾的過量聚集引起的細胞應激性死亡途徑。其形態變化,死亡歷程和分子機制均有別於常規的細胞凋亡等程式性死亡途徑。近年的研究發現鐵死亡在各種慢性或急性的器官衰竭過程中起到突出的作用,點燃了通過...
我們推測FXN減少導致神經元的丟失是鐵死亡的結果。本項目在執行過程中發現當我們使用鐵死亡的特定誘導劑和抑制劑處理來自FRDA病人的細胞時, 發現FRDA病人細胞並沒有表現對erastin誘導的鐵死亡更加敏感。這一結果動搖了我們的研究假說。由於本...
毛小元,男,中南大學湘雅醫院教授,研究員,博士生導師,湖南省優青獲得者和國家自然科學基金項目評審專家。擔任教育部藥物基因組套用技術工程中心副主任、鐵死亡科學家全球聯盟委員會學術委員、湖南省神經科學學會神經藥理與毒理學專業委員會副...
2.探究細胞鐵死亡(Ferroptosis)在腫瘤中的作用和分子機制,並以此為基礎尋找通過鐵死亡通路來殺死腫瘤細胞的方法。主要成就 長期從事腫瘤發病機理方面的研究,主要的科學發現包括:1.首次發現細胞自噬基因UVRAG(UV Radiation Resistance ...
王福俤 教授30餘年聚焦金屬離子前沿研究,創新金屬離子時空穩態調控理論,創建靶向調控金屬離 子和鐵死亡精準疾病防控理論體系,推動金屬離子營養標準體系建設,創製多個靶向金屬離 子和鐵死亡新藥並提出公共衛生安全中國方案,系列重大原創突破引領...
(6) 細胞鐵死亡模型建立及闡明SENP1信號調控細胞鐵死亡。利用CML細胞系體外鐵死亡模型,篩選了信號通路抑制劑對白血病細胞鐵死亡影響。證明了磷脂代謝信號ENPP2、SENP1及miR-17-92是重要的細胞鐵死亡調節分子。本項目證明了SPK和SENP1是CML...
廣東省科學院微生物研究所、華南套用微生物國家重點實驗室研究員謝黎煒團隊,首次報導了骨骼肌衰老Tfr1-Slc39a14(轉鐵蛋白受體1-溶質載體家族39成員14)的功能轉化,可促進骨骼肌鐵離子吸收、蓄積並誘發骨骼肌鐵死亡的發生。相關研究《肌...
