理化性質
物理性質
白色至淺黃色粒狀、棒狀或粉末。有吸濕性。加熱至320℃以上分解。在
空氣中慢慢氧化為
硝酸鈉。遇弱酸分解放出棕色
三氧化二氮氣體。溶於1.5份冷水、0.6份沸水,微溶於
乙醇。水溶液呈鹼性,
pH約9。相對
密度2.17。熔點271℃。有
氧化性,與
有機物接觸能
燃燒和爆炸,並放出有毒和刺激性的
過氧化氮和氧化氮的氣體。中等毒,半數致死量(大鼠,經口)180mg/kg。
化學性質
亞硝酸鈉有毒,有傳言說亞硝酸鈉是致癌物質,但事實上亞硝酸鈉並不是致癌物質,致癌的是亞硝酸鈉在一定條件下生成的
亞硝胺,在亞硝酸鈉分子中,氮的
化合價是+3。是一種中間
化合態,既有還原性又有氧化性,例如在
酸性溶液中能將KI氧化成
單質碘。
套用
色層分析。點滴分析用以定汞、
鉀和氯酸鹽。重氮化試劑。亞硝化試劑。
土壤分析。肝功能試驗中測定血清膽紅素。
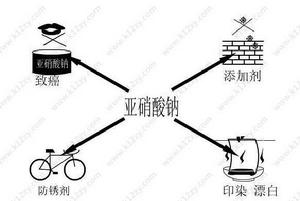 亞硝酸鈉的用途與危害
亞硝酸鈉的用途與危害絲綢、亞麻的漂白劑,金屬熱處理劑;鋼材緩蝕劑;氰化物中毒的解毒劑,實驗室分
合成方法
1、用鉛還原硝酸鈉,加熱熔化硝酸鈉,加少量金屬鉛,攪拌並繼續加熱至鉛全部氧化。生成的塊狀物邊冷卻邊分成小塊,用熱水萃取生成的氧化鉛數次。通入二氧化碳氣體使生成碳酸鉛沉澱,經過濾,用稀硝酸準確中和濾液後,蒸發、濃縮析出亞硝酸鈉結晶。經吸濾,用乙醇洗滌後乾燥,再重結晶精製而得。
2、用燒鹼溶液或純鹼吸收硝酸或硝酸鹽生產中排出的含有少量NO和NO2的尾氣,尾氣中NO/NO2的比例要調節至使中和液中NaNO2與NaNO3的質量之比在8以下,在吸收過程中中和液應避免出現酸性,以免腐蝕設備。當中和液的相對密度為1.24~1.25,純鹼含量為3~5g/L時送去蒸發,在132℃時吸收液蒸發濃縮,然後冷至75℃,析出亞硝酸鈉呈結晶,再經分離、乾燥即得產品。反應方程式如下:
Na2CO3+NO+NO2→2NaNO2+CO2↑
3、將硝酸和硝酸鹽生產時排除的尾氣中的一氧化氮和二氧化氮,用純鹼或燒鹼溶液吸收而得中和液,經蒸發、結晶,然後利用亞硝酸鈉與硝酸鈉在水中的溶解度不同而將二者分離,即得成品。
2NO+2NaOH→2NaNO2+H2O
2NO+Na2CO3→2NaNO2+CO2
4、將42.5g硝酸鈉與100g金屬鉛在瓷(或鐵)坩堝中熔融攪拌,冷卻後用200mL熱水抽提,通入CO2數分鐘,以沉澱溶於水中的氧化鉛,鐵離子等。過濾,濾液用稀硝酸酸化後,蒸發濃縮至乾。然後加200~250mL乙醇在殘渣上煮沸,過濾濾液以除去少量的硝酸鈉,蒸餾濾液除去乙醇,則得到白色粉末,亞硝酸鈉約20g。提純方法將100g亞硝酸鈉在70~80℃下溶於100mL水中,加入1~2g純氫氧化鈉以沉澱鐵,冷卻過濾,蒸髮結晶,二次再結晶純度更高,產量為75g。
5、採用吸收法。將稀硝酸生產過程中排出的尾氣中一氧化氮和二氧化氨的比例調節到使中和液的亞硝酸和硝酸鈉的質量比在8以下。然後將尾氣自吸收塔底部通入,純鹼溶液從吸收塔的頂部噴淋吸收氣體中的氧化氮,生成中和液。當中和液的相對密度為1.24~1.25、碳酸鈉含量為3~5g/l時,進行蒸發濃縮、冷卻結晶50~70℃析出亞硝酸鈉結晶,再經離心分離,製得亞硝酸鈉成品。其反應式如下:
Na2CO3+NO+NO2→2NaNO2+CO2↑
Na2CO3+2NO2→NaNO2+Na2CO3+CO2↑
經離心分離出的母液,用作生產硝酸鈉的原料。
6、將1份工業品亞硝酸鈉溶解在1.5~2.0份70~80℃的純水中。添加固體試劑氫氧化鈉,調節PH值為12,靜置沉澱,然後過濾。濾液蒸發到密度為1.45時再過濾,濾液冷卻到室溫,析出的亞硝酸鈉晶體,用布氏漏斗抽濾,並不斷攪拌,用少量冷水洗滌,然後移入磨口瓶中。母液可再蒸髮結晶而得到大量亞硝酸鈉,但需進行重結晶。
7、在氫氧化鈉醇溶液中加入亞硝酸乙酯,放置二天,進行如下反應:
NaOH+C2H5ONO=NaNO2+C2H5OH
揮發物質,剩餘物濾出 ( 亞硝酸鈉含量高達91%~96%)後在水中進行重結晶,可得亞硝酸鈉含量95.5% ~99.8%。
健康關注
致癌
過量的亞硝酸鈉會致癌。亞硝酸鈉在烹調和消化過程中會和食物中的胺反應,產生
致癌物質亞硝胺類化合物。傳統食品中也存在亞硝胺,例如
醃肉和
鹹魚乾。在19世紀20年代,美國一次重要的肉製品醃漬工藝的改進減少了69%的亞硝酸鹽使用,這使得當時胃癌患者的死亡率驟減。而在1970年前後,人們發現
抗壞血酸(即
維生素C)可以有效抑制亞硝胺的產生。這使得美國要求肉製品中必須含有至少550ppm的抗壞血酸。製造商有時會使用成本更低但效果相當的
異抗壞血酸作為替代。製造商也會添加α-生育酚(即
維生素E)來起到進一步效果。上述三種化合物均通過它們的
抗氧化性來抑制亞硝胺的產生。以抗壞血酸為例,它可以通過
氧化還原作用將亞硝酸鈉的轉化物亞硝酸酐還原為
一氧化氮,而自身被氧化為
脫氫抗壞血酸。
這種保鮮劑可見於午餐肉、醃肉和魚肉中。會導致多種癌症。
反應機理
在酸性環境(例如胃液)中火加熱條件(例如烹飪過程)下,亞硝胺可以形成
重氮鹽。
特定的亞硝胺類化合物,例如N-亞硝胺和N-亞硝基四氫吡咯可以產生
碳正離子與細胞中的生物
親核試劑發生反應(例如
DNA或
酶)。
一旦這樣的
親核取代發生在一個生物大分子上的關鍵部位,就可能破壞細胞的正常功能,導致細胞
癌變或
細胞凋亡。
注意事項
亞硝酸鈉被廣泛用於醃肉,若出現髙鐵血紅蛋白的紫紺,可用亞甲基藍使髙鐵血紅蛋白還原。 誤食亞硝酸鈉會中毒的原因是人體中血紅蛋白所含的鐵是
亞鐵,它能跟
氧結合隨著
血液循環,將
氧輸送到身體各部。當誤食亞硝酸鈉後,在血液中發生了
化學反應,使血紅蛋白轉變成三價鐵的血紅蛋白。三價鐵的血紅蛋白不能攜帶氧,因此造成人體缺氧中毒。因此,誤食亞硝酸鈉對身體健康的危害很大。按GB1907國標生產作為食品添加劑,按GB2760規定量添加,肉食中最大使用量是0.15g/kg,肉食中亞硝酸鈉殘留量在罐頭中不得超過0.05g/kg;肉製品不得超過0.03g/㎏。
世界食品衛生科學委員會1992年發布的人體安全攝入亞硝酸鈉的標準為0~0.1㎎/㎏體重;若換算成亞硝酸鹽,其標準為0~4.2㎎/60千克體重,按此標準使用和食用,對人體不會造成危害。亞硝酸鈉有毒,過量食入的毒副作用是麻痹血管運動中樞、呼吸中樞及周圍血管,形成高鐵血紅蛋白。急性中毒表現為全身無力、頭痛、頭暈、噁心、嘔吐、腹瀉、胸部緊迫感以及呼吸困難;檢查見皮膚黏膜明顯紫紺。嚴重者血壓下降,昏迷、死亡。
另外亞硝酸鈉在人體內也會生成致癌物質。新醃製的
泡菜中也含有亞硝酸鈉(所以泡菜最好在淹制後的15天以後食用,當中的亞硝酸鹽含量會逐漸降低)。
應急處置
皮膚接觸:脫去被污染的衣著,用肥皂水和清水徹底沖洗皮膚。
吸入:迅速脫離現場至空氣新鮮處。保持呼吸道通暢。如呼吸困難,給輸氧。如呼吸停止,立即進行人工呼吸。就醫。
食入:飲足量溫水,催吐。就醫。
呼吸系統防護:空氣中
濃度較高時,應該佩戴自吸過濾式防塵口罩。必要時,佩戴自給式呼吸器。
 亞硝酸鈉
亞硝酸鈉身體防護:穿膠布防毒衣。
其他防護:工作畢,淋浴更衣。保持良好的衛生習慣。
泄漏應急處理:隔離泄漏污染區,限制出入。建議應急處理人員戴自給式呼吸器,穿一般作業工作服。勿使泄漏物與
還原劑、有機物、易燃物或
金屬粉末接觸。不要直接接觸泄漏物。小量泄漏:用潔淨的鏟子收集於乾燥、潔淨、有蓋的容器中。大量泄漏:收集回收或運至廢物處理場所處置。
儲藏運輸
亞硝酸鈉宜放在低溫、乾燥、通風庫房內。門窗嚴密,防止日光直曬。可與硝酸銨以外的其它硝酸鹽同庫存放,但與有機物、
易燃物、
還原劑隔離存放,並隔絕
火源。
包裝方法: 兩層塑膠袋或一層塑膠袋外麻袋、塑膠編織袋、乳膠布袋;塑膠袋外複合塑膠編織袋(聚
丙烯三合一袋、
聚乙烯三合一袋、聚丙烯二合一袋、聚乙烯二合一袋);螺紋口
玻璃瓶、鐵蓋壓口玻璃瓶、塑膠瓶或金屬桶(罐)外普通木箱;螺紋口玻璃瓶、塑膠瓶或鍍錫薄鋼板桶(罐)外滿底板花格箱、纖維板箱或膠合板箱。
入庫驗收:主要檢查包裝有無破漏,封口嚴密有效,有無雨淋、受潮等。
亞硝酸鈉的運輸儲存
堆碼苫墊:貨垛應墊高15-30cm。垛高不超過2.5m,保持貨垛牢固安全,垛距80-90cm,牆距30-50cm。
在庫檢查:保管員除每日班前班後對
庫房、
貨垛進行安全檢查外,還應每3個月對所管物品進行一次質量檢查,並做好記錄。
溫濕度管理:炎熱季節嚴格控制溫度,庫房可採取密封庫的辦法,儘量保持庫內乾燥,乾燥季節可自然通風。庫內溫度在30℃以下,相對濕度在75%以下。
安全作業:作業人員必須穿工作服,戴
手套;操作中必須輕搬輕放,嚴禁摩擦摔、扔、撞擊、滾動;各項驗收檢查操作一律不得在庫內進行,應到指定地點進行。
檢驗方法
一、 測定方法
《生活飲用水衛生規範》(2001)
三、 測定範圍
2. 本法適用於測定生活飲用水及其水源水中
亞硝酸鹽氮的含量。
4. 本法最低檢測質量為0.05µg
亞硝酸鹽氮,若取50mL水樣,最低檢測
質量濃度為0.001mg/L。
四、測定原理
五、試劑
稱取125g
硫酸鋁鉀[KAl(SO4)2.12H2O]或
硫酸鋁銨[NH4Al(SO4)2.12H2O]溶於1000mL純水中。加熱至60oc,緩緩加入55mL
氨水(ρ20=0.88g/mL)。使
氫氧化鋁沉澱完全。充分攪拌後靜置,棄取上清液。用純水反覆洗滌沉澱,至傾出上清液中不含
氯離子(用
硝酸銀溶液試驗)。然後加入300mL純水成
懸濁液,適應前振搖均勻。
3.鹽酸N-(1萘)-乙二胺溶液(1.09g/L)
4.
亞硝酸鹽氮標準儲備液[ρ(NO2-_N)=50µg/mL]:
稱取0.2463g在玻璃乾燥器內放置24h的亞硝酸鈉(NaNO2),溶
於純水中,並定容至1000mL。每升加2mL
氯仿保存。
5.
亞硝酸鹽氮標準使用液[ρ(NO2-_N)=0.1µg/mL]:
取10.00mL標準儲備液於容量瓶中,用純水定容至500mL。再從中吸取10mL,用純水於容量瓶中定容至100mL。
六.儀器
具塞比色管50mL
分光光度計
七.分析步驟
1.若水樣中渾
濁度或
色度過大,可先取100mL,加入2mL氫氧化鋁懸浮液,攪拌後靜置數分鐘,過濾。
2.先將水樣或處理後的水樣用酸或鹼調進中性,取50mL置於比色管中。
3.另取50mL
比色管配製標準濃度系列。其中空白與最低
檢測限必須配製。其他系列視檢測的具體情況而定。
4.向水樣及標準系列中分別加入1mL
對氨基苯磺醯胺溶液。搖勻後放置2-8min,加入1.0mL鹽酸N-(1萘)-乙二胺溶液。立即混勻。
5.於540nm
波長下,用1 cm比色皿,以
純水作參比,在10min-2hr內測定
吸光度。如含量低於4mg/L,改用3cm比色皿。
八、計算
ρ(NO2-N)=m/V
式中:ρ(NO2-N)----水樣中亞硝酸鹽氫的
質量濃度,㎎/L
m----從
標準曲線上查得樣品中亞硝酸鹽氫的質量,㎎
v----水樣體積,mL
 亞硝酸鈉
亞硝酸鈉 亞硝酸鈉
亞硝酸鈉
 亞硝酸鈉
亞硝酸鈉 亞硝酸鈉
亞硝酸鈉