基本介紹
- 中文名:Weinreb醯胺
- 外文名:Weinreb Amide
- 用途:醛、酮的合成
簡介,製備,有關反應,反應通式,反應機理,全合成中的套用,
簡介
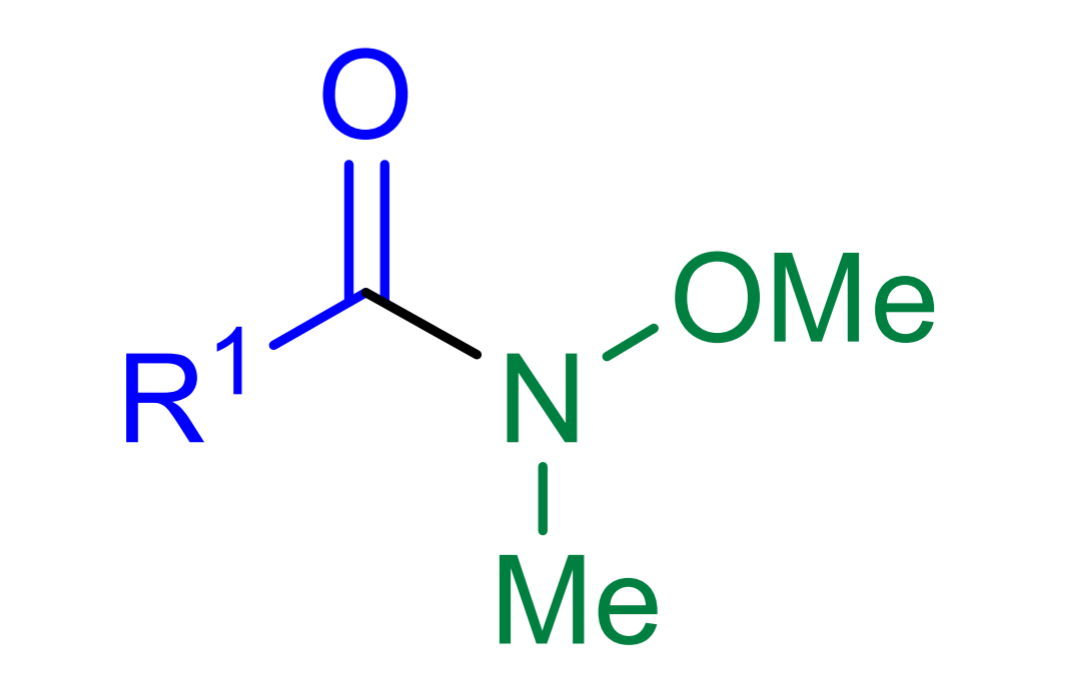
Weinreb醯胺是N-甲氧基-N-甲基醯胺。它是以一位名叫Weinreb的化學家命名,他和另一位科學家Nahm於1981年發現這種醯胺。
與一般的羧酸衍生物(如酯、普通的醯胺、醯鹵)相比,該試劑的主要優點在於避免了與金屬有機試劑加成時的過量添加問題。對於一般的羧酸衍生物而言,兩個當量的親核基團(如有機金屬試劑)加成醇而不是酮或醛。即使親核基團的當量受到嚴格控制,也會發生這種情況。原因是親核加成-消除得到的中間產物酮或醛往往比底物(如酯或者醯胺)更加活潑,更容易與金屬有機試劑反應得到三級醇。而Weinreb醯胺避免了這種問題。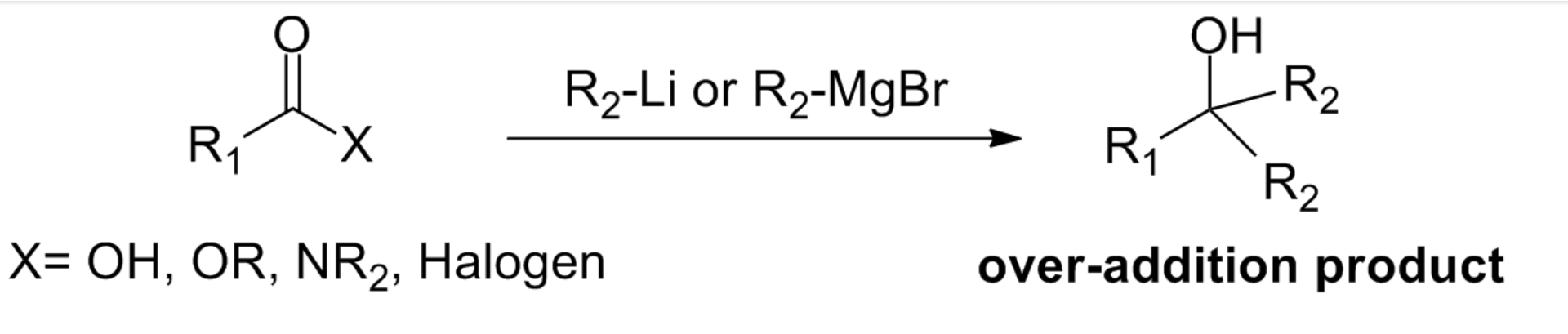 一般的羧酸衍生物與有機金屬試劑反應得到過加成產物
一般的羧酸衍生物與有機金屬試劑反應得到過加成產物
 一般的羧酸衍生物與有機金屬試劑反應得到過加成產物
一般的羧酸衍生物與有機金屬試劑反應得到過加成產物Weinreb醯胺作為一種合成酮類化合物的可靠方法,已被有機化學家經常使用。這些官能團存在於大量的天然產物中,能夠可靠地反應形成新的碳-碳鍵或轉化為其他官能團。該方法已用於許多合成。
製備
Weinreb醯胺的製備常以羧酸作為反應底物,羧酸在亞硫醯氯作用下可高效的轉化為醯氯,或是與乙酸酐反應生成混酐。得到的醯氯或混酐在0℃、鹼性條件下與N,O-二甲基羥胺鹽酸鹽反應得到Weinreb醯胺。
Weinreb醯胺也可以通過相對不活潑的酯和醯胺來製備。但需要在過量的AlMe3或Me2AlCl催化下並且需要用惰性氣體保護才能與N,O-二甲基羥胺鹽酸鹽反應得到Weinreb醯胺。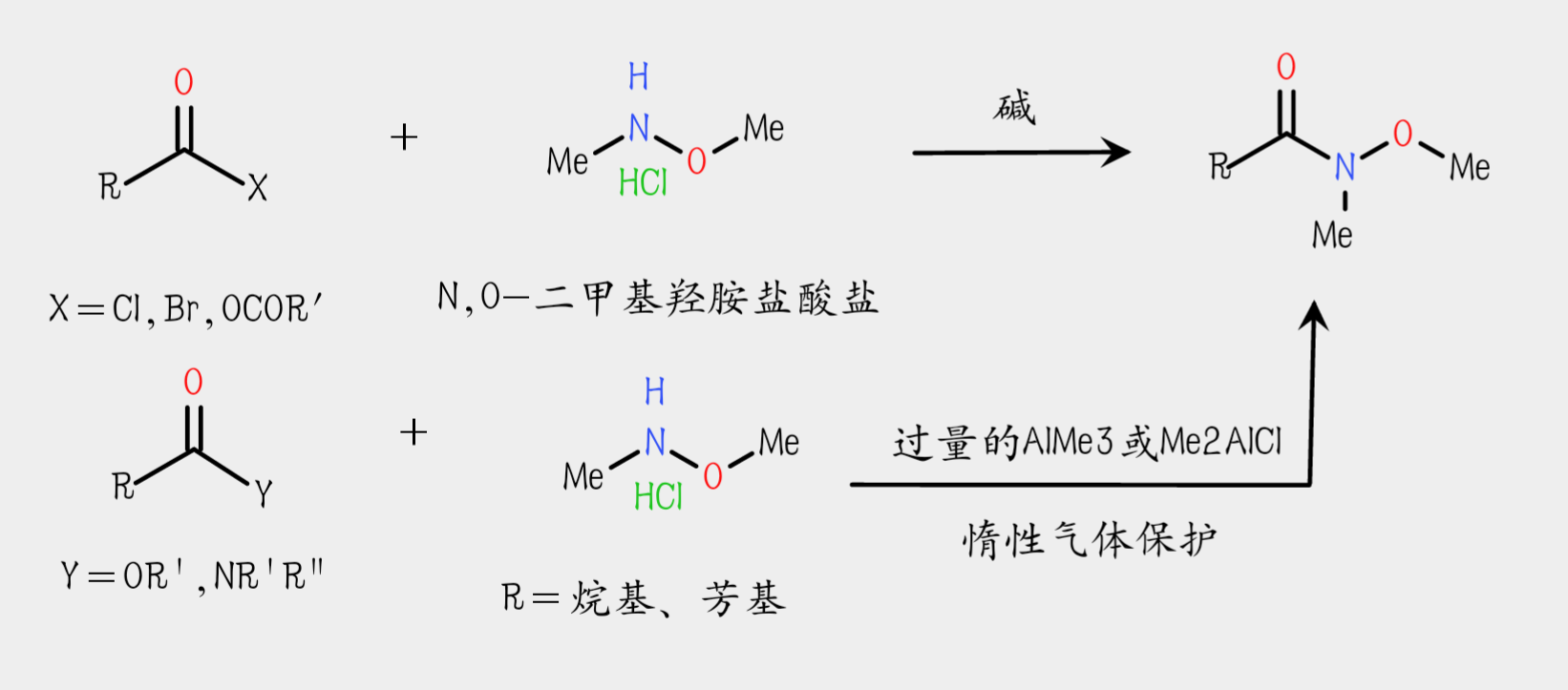 Weinreb醯胺的製備
Weinreb醯胺的製備
 Weinreb醯胺的製備
Weinreb醯胺的製備有關反應
反應通式
a.與格氏試劑、有機鋰試劑等有機金屬試劑反應後,水解得到酮。
b.與四氫鋁鋰(LiAlH4)、AlH(i-Bu)2反應後,水解得到醛。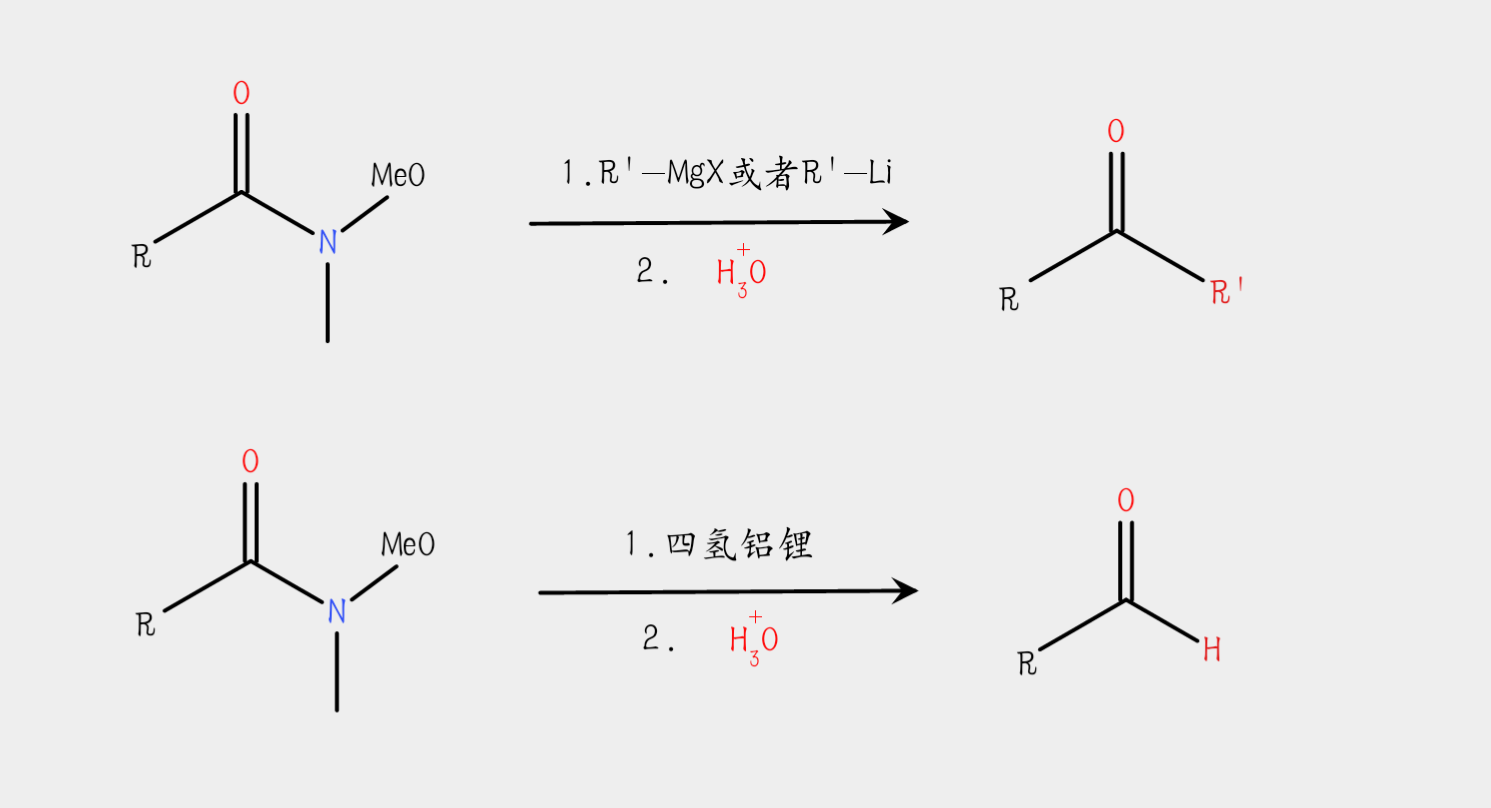 反應通式
反應通式
 反應通式
反應通式反應機理
普遍認可的機理來解釋Weinreb醯胺反應中顯示的選擇性的是,由有機金屬試劑對羰基進行親核進攻,形成的四面體中間體,該中間體通過的甲氧基和原羰基氧與金屬離子配位形成五元螯合環得到穩定。該中間體在低溫下穩定,故需要低溫下反應。
該中間體在這個反應體系中並不會直接發生消除得到醛或酮,而維持這中間體,直到用水淬滅、酸化後才得到醛、酮產物。由於醛、酮並不在第一步反應中生成,也就避免了過量加成產物三級醇的生成(對於氫化鋁鋰還原反應是一級醇)。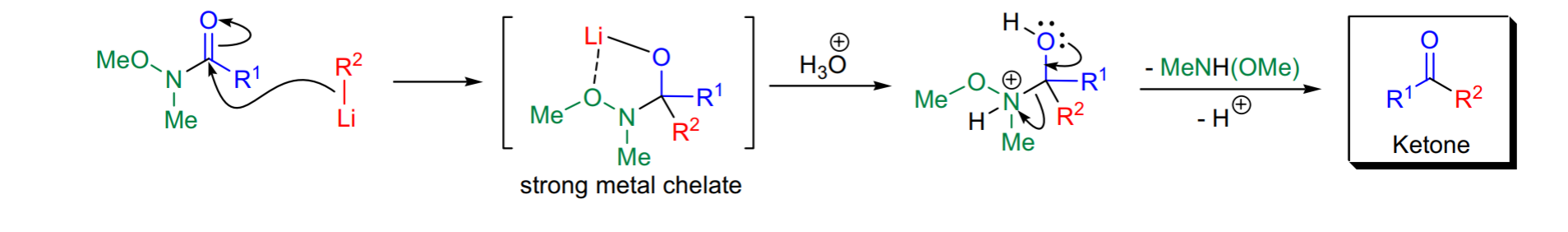 反應機理
反應機理
 反應機理
反應機理全合成中的套用
1.第一次Stemona生物鹼(-)-結核莖鹼的全合成使用了Weinreb酮合成,在該合成中,中間產物丁內酯與N,O-二羥基胺鹽酸鹽和Me2AlCl反應製備了Weinreb‘s醯胺,得到了較好的產率。然後,在THF中用LDBB處理溴代鄰苯二甲酸酯,生成相應的烷基鋰物種,並將其添加到Weinreb‘s醯胺中,清潔有效地獲得了所需的酮。
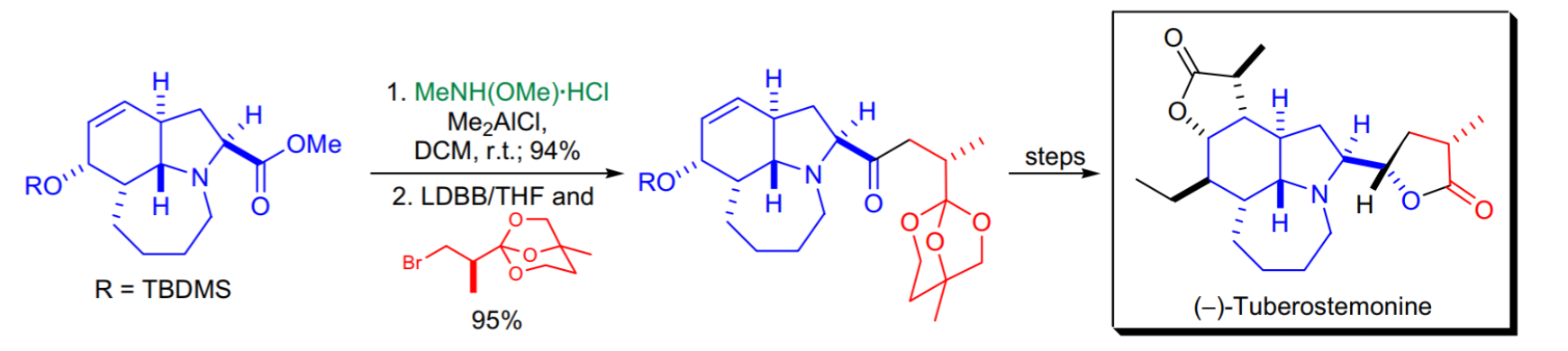 Weinreb醯胺在(-)-結核莖鹼全合成的套用
Weinreb醯胺在(-)-結核莖鹼全合成的套用2.在(+)-Macrosphelides A and B全合成中的套用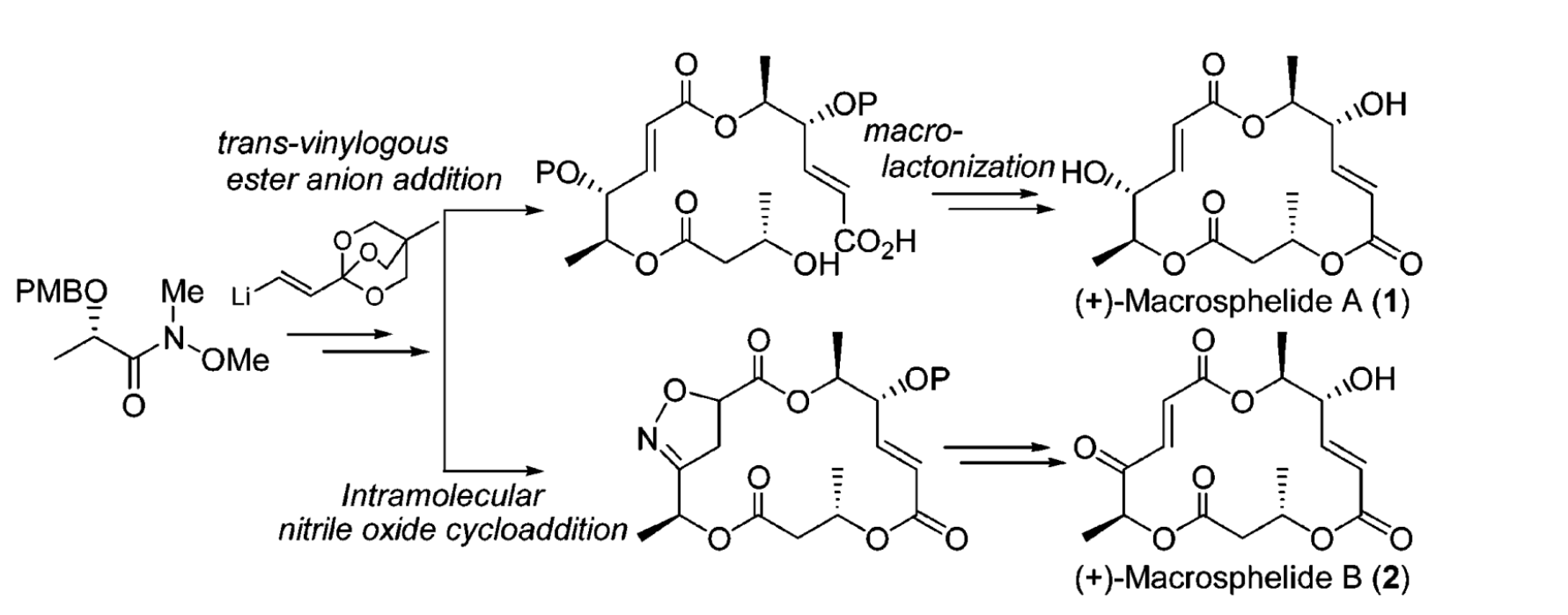 Weinreb醯胺在(+)-Macrosphelides A and B合成中的套用
Weinreb醯胺在(+)-Macrosphelides A and B合成中的套用
 Weinreb醯胺在(+)-Macrosphelides A and B合成中的套用
Weinreb醯胺在(+)-Macrosphelides A and B合成中的套用