疾病簡介,流行病學與病因,臨床表現,一般症狀,上呼吸道症狀,下呼吸道症狀,腎臟損害,眼受累,皮膚黏膜,神經系統,關節病變,其他,診斷,鑑別診斷,治療,預後,護理,
疾病簡介 肉芽腫性血管炎(Granulomatosis with Polyangiitis, GPA),既往稱為韋格納肉芽腫(Wegener's granulomatosis, WG)。是一種壞死性肉芽腫性血管炎,屬自身免疫性疾病。該病在1931年由Klinger首次描述,在1936年由Wegener進一步作了病理學的描述。該病病變累及小動脈、靜脈及毛細血管,偶爾累及大動脈,其病理以血管壁的炎症為特徵,主要侵犯上、下呼吸道和腎臟,通常以鼻黏膜和肺組織的局灶性肉芽腫性炎症為開始,繼而進展為血管的瀰漫性壞死性肉芽腫性炎症。臨床常表現為鼻和副
鼻竇炎 、肺病變和進行性
腎功能衰竭 。還可累及關節、眼、皮膚,亦可侵及眼、心臟、神經系統及耳等。無腎臟受累者被稱為局限性肉芽腫性血管炎。
流行病學與病因 該病男性略多於女性,從兒童到老年人均可發病,最近報導的年齡範圍在5 - 91歲之間發病,但中年人多發,40~50歲是本病的高發年齡,平均年齡為41歲。各種人種均可發病,根據美國Gary S. Hoffma的研究,GPA的發病率為每30000-50000人中有一人發病,其中97%的患者是高加索人,2%為黑人,1%為其他種族。我國發病情況尚無統計資料。未經治療的GPA病死率可高達90%以上,經激素和免疫抑制劑治療後,GPA的預後明顯改善。儘管該病有類似炎性過程,但尚無獨立的致病因素,病因至今不明。
臨床表現 GPA臨床表現多樣,可累及多系統。典型的GPA有三聯征:上呼吸道、肺和腎病變。
一般症狀 可以起病緩慢,持續一段時間,也可表現為快速進展性發病。病初症狀包括發熱、疲勞、抑鬱、納差、體重下降、關節痛、盜汗、尿色改變和虛弱。其中發熱最常見。發熱有時是由鼻竇的細菌感染引起。
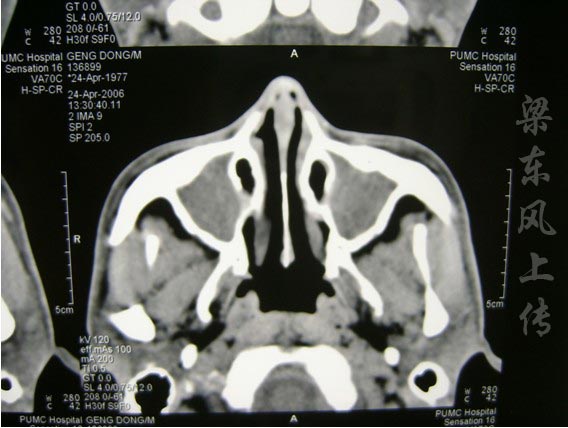
上呼吸道症狀 大部分患者以上呼吸道病變為首發症狀。通常表現是持續地流鼻涕,而且不斷加重。流鼻涕可來源於鼻竇的分泌,並導致上呼吸道的阻塞和疼痛。伴有鼻黏膜潰瘍和結痂,鼻出血、唾液中帶血絲,鼻竇炎(圖1)可以是緩和的,嚴重的GPA鼻中隔穿孔,鼻骨破壞,出現鞍鼻(圖2)。咽鼓管的阻塞能引發中耳炎,導致聽力喪失。而後者常是患者的第一主訴。部分患者可因聲門下狹窄出現聲音嘶啞,及呼吸喘鳴(圖3)。
下呼吸道症狀 肺部受累是本病基本特徵之一,約50%的患者在起病時既有肺部表現,總計80%以上的患者將在整個病程中出現肺部病變。胸悶、氣短、咳嗽、咯血以及胸膜炎是最常見的症狀,及肺內陰影。大量肺泡性出血較少見,但一旦出現,則可發生呼吸困難和呼吸衰竭。有約1/3的患者肺部影像學檢查有肺內陰影(圖4),可缺乏臨床症狀。查體可有叩濁、呼吸音減低以及濕囉音等體徵。因為支氣管內膜受累以及疤痕形成,55%以上的患者在肺功能檢測時可出現阻塞性通氣功能障礙,另有30% ~ 40%的患者可出現限制性通氣功能障礙以及彌散功能障礙。
腎臟損害 大部分病例有腎臟病變,出現蛋白尿,紅、白細胞及管型尿,嚴重者伴有高血壓和腎病綜合徵,終可導致腎功能衰竭,是GPA的重要死因之一。無腎臟受累者稱為局限型GPA,應警惕部分患者在起病時無腎臟病變,但隨病情進展可逐漸發展至腎小球腎炎(圖5)。
眼受累 眼受累的最高比例可至50%以上,其中約15%的患者為首發症狀。GPA可累及眼的任何區域,可表現為眼球突出、視神經及眼肌損傷、結膜炎、角膜潰瘍、表層鞏膜炎、虹膜炎、視網膜血管炎、視力障礙等。
皮膚黏膜 多數患者有皮膚黏膜損傷,表現為下肢可觸及的
紫癜 、多形紅斑、斑疹、瘀點(斑)、丘疹、皮下結節、壞死性潰瘍形成以及淺表皮膚糜爛等。其中皮膚紫癜最為常見。
神經系統 很少有GPA患者以神經系統病變為首發症狀,但仍有約1/3的患者在病程中出現神經系統病變。患者以外周神經病變最常見,多發性單神經炎是主要的病變類型,臨床表現為對稱性的末梢神經病變。肌電圖以及神經傳導檢查有助於外周神經病變的診斷。
關節病變 關節病變在GPA中較為常見,發病時約30%的患者有關節病變,全部病程中可有約70%的患者關節受累。多數表現為關節疼痛以及肌痛,1/3的患者可出現對稱性、非對稱性以及遊走性關節炎(可為單關節、寡關節或多關節的腫脹和疼痛)。
其他 GPA也可累及心臟而出現
心包炎 、
心肌炎 。胃腸道受累時可出現腹痛、腹瀉以及出血;屍檢時可發現脾臟受損(包括壞死、血管炎以及肉芽腫形成)。泌尿生殖系統系統(不包括腎臟),如膀胱炎、睪丸炎、附睪炎等受累較少見。尚有肉芽腫侵及腦垂體引發尿崩症的病例報導。
診斷 GPA的診斷時間平均為5 - 15個月。國外資料報導其中40%的診斷是在不到三個月的時間裡得出的,10%可長達5 - 15年才被診斷。為了達到最有效的治療,GPA早期診斷至關重要。無症狀患者可通過血清學檢查ANCA以及鼻竇和肺臟的CT掃描有助於診斷。上呼吸道、支氣管內膜及腎臟活檢是診斷的重要依據,病理顯示肺及皮膚小血管和類纖維蛋白變性,血管壁有中性粒細胞浸潤,局灶性壞死性血管炎,上、下呼吸道有壞死性肉芽腫形成,和腎病理為局灶性、節段性、新月體性壞死性腎小球腎炎,免疫螢光檢測無或很少免疫球蛋白以及補體沉積。當診斷困難時,必要進可行胸腔鏡或開胸活檢以提供診斷的病理依據。目前GPA的診斷標準仍採用1990年美國風濕病學院分類標準(見表):
1990年美國風濕病學院GPA分類標準
1.鼻或口腔炎症痛性或無痛性口腔潰瘍,膿性或血性鼻腔分泌物
2.胸片異常胸片示結節、固定浸潤病灶或空洞
3.尿沉渣異常鏡下血尿(RBC>5/高倍視野)或出現紅細胞管型
4.病理性肉芽腫性炎性改變動脈壁或動脈周圍,或血管(動脈或微動脈)外區有中性粒細胞浸潤
符合2條或2條以上時可診斷為GPA,診斷的敏感性和特異性分別為88.2%和92.0%。
GPA在臨床上常被誤診,為了能早期診斷,對有以下情況者應反覆進行活組織檢查:不明原因的發熱伴有呼吸道症狀;慢性鼻炎及副鼻竇炎,經檢查有黏膜糜爛或肉芽組織增生;眼、口腔黏膜有潰瘍、壞死或肉芽腫;肺內有可變性結節狀陰影或空洞;皮膚有紫癜、結節、壞死和潰瘍等。
鑑別診斷 GPA因為可以出現上、下呼吸道以及腎臟的相關症狀,經常需要與臨床上常見的鼻竇炎、
鼻咽癌 、淋巴瘤、肺炎、肺結核、肺癌、慢性腎炎等進行鑑別,另外,尚需要與以下幾種疾病鑑別:
1.顯微鏡下多血管炎:1993年以前將顯微鏡下多血管炎作為GPA的一個亞型,目前認為顯微鏡下多血管炎為一獨立的系統性血管炎。是一種主要累及小血管的系統性壞死性血管炎,可侵犯腎臟、皮膚和肺等臟器的小動脈、微動脈、毛細血管的小靜脈。常表現為壞死性腎小球腎炎和肺毛細血管炎。累及腎臟時出現蛋白尿、鏡下血尿和紅細胞管型。抗中性粒細胞胞漿抗體(ANCA)陽性是顯微鏡下多血管炎的重要診斷依據,60-80%為髓過氧化物酶(MPO)-ANCA陽性,在螢光檢測法示外周型(p-ANCA)陽性,胸部X線檢查在早期可發現無特徵性肺部浸潤影或小泡狀浸潤影,中晚期可出現肺間質纖維化。
2.變應性肉芽腫性血管炎(Churg-Strauss綜合徵):有重度哮喘;肺和肺外臟器有中小動脈、靜脈炎及壞死性肉芽腫;周圍血嗜酸性粒細胞增高。GPA與變應性肉芽腫性血管炎均可累及上呼吸道,但前者常有上呼吸道潰瘍,胸片示肺內有破壞性病變如結節、空洞形成,而在變應性肉芽腫性血管炎則不多見。GPA病灶中很少有嗜酸性粒細胞浸潤,周圍血嗜酸性粒細胞增高不明顯,也無哮喘發作。
3.淋巴瘤樣肉芽腫病:是多形細胞浸潤性血管炎和血管中心性壞死性肉芽腫病,浸潤細胞為小淋巴細胞、漿細胞、組織細胞及非典型淋巴細胞,病變主要累及肺、皮膚、神經系統及腎間質,但不侵犯上呼吸道。
4.肺出血-腎炎綜合徵(Goodpasture syndrome):是以肺出血和急進性腎小球腎炎為特徵的綜合徵,抗腎小球基底膜抗體陽性,由此引致的瀰漫性肺泡出血及腎小球腎炎綜合症,以發熱、咳嗽、咯血及腎炎為突出表現,但一般無其它血管炎徵象。本病多缺乏上呼吸道病變,腎病理可見基底膜有免疫複合物沉積。
5.復發性多軟骨炎:復發性多軟骨炎是以軟骨受累為主要表現,臨床表現也可有鼻塌陷、聽力障礙、氣管狹窄,但該病一般均有耳廓受累,而無鼻竇受累,實驗檢查ANCA陰性。抗Ⅱ型膠原陽性。
治療 治療可分為3期,即誘導緩解、維持緩解以及控制復發。循證醫學顯示糖皮質激素加環磷醯胺聯合治療有顯著療效,特別是腎臟受累以及具有嚴重呼吸系統疾病的患者,應作為首選治療方案。目前認為未經治療的GPA患者的預後較差。
1、糖皮質激素:活動期用潑尼松1.0 - 1.5 mg·kg-1·d-1。用4~6周,病情緩解後減量並以小劑量維持。對嚴重病例如中樞神經系統血管炎、呼吸道病變伴低氧血症如肺泡出血、進行性腎功能衰竭,可採用衝擊療法;甲基潑尼松龍1.0 g/d×3天,第4天改口服潑尼松1.0~1.5mg/kg/d,然後根據病情逐漸減量。
2、免疫抑制劑
(1)環磷醯胺:通常給予每天口服1.5 - 2 mg/kg,也可用200mg,隔日一次。對病情平穩的患者可用1 mg/kg維持。對嚴重病例給予1.0g衝擊治療,每3 ~ 4周一次,同時給予每天口服100mg。或每2周給予靜滴0.6g~0.8g。環磷醯胺是治療本病的基本藥物,可使用一年或數年,撤藥後患者能長期緩解。用藥期間注意觀察不良反應,如骨髓抑制等。循證醫學顯示,環磷醯胺能顯著地改善GPA患者的生存期,但不能完全控制腎臟等器官損害的進展。筆者曾觀察到一例患者間斷套用環磷醯胺,總量達60g,控制良好。
(2)硫唑嘌呤:為嘌呤類似藥,有抗炎和免疫抑制雙重作用,有時可替代環磷醯胺。一般用量為1 ~ 4 mg. kg-1.d-1,總量不超過200 mg/d。但需根據病情及個體差異而定,用藥期間應監測不良反應。如環磷醯胺不能控制,可合併使用硫唑嘌呤或改用硫唑嘌呤。
(3)甲氨蝶呤:一般用量為10 ~25mg,一周一次,口服、肌注或靜注療效相同,如環磷醯胺不能控制可合併使用之。
(4)環孢黴素A:作用機理為抑制IL-2合成,抑制T淋巴細胞。優點為無骨髓抑制作用。但免疫抑制作用也較弱。常用劑量為3 ~ 5mg/kg/d。
(5)嗎替麥考酚酯:初始用量1.5g/d,分2 ~ 3次口服,維持3月,維持劑量1.0g/d,分2 ~ 3次口服,維持6 ~ 9月。
(6)丙種球蛋白:靜脈用丙種球蛋白(IVIG)通過Fc介導的免疫調節作用,通過Fab干擾抗原反應或參與抗獨特型抗體交叉作用而抑制抗體形成,抑制T淋巴細胞增殖及減少自然殺傷細胞的活性。大劑量丙球還具有廣譜抗病毒、細菌及其他病抗體作用。一般與激素及其他免疫抑制劑合用,劑量為300 ~ 400mg/kg/d,連用5 ~ 7天。
(7)化療方案:對一些難治性的患者,筆者曾在臨床上試用了用於淋巴瘤的CHOP化療方案,取得了一定的療效。
3、其他治療
(1)複方新諾明片(trimethoprim/sulfamethoxazole,SMZ Co):對於病變局限於上呼吸道以及已用潑尼松和環磷醯胺控制病情者,可選用複方新諾明片進行抗感染治療( 2 ~ 6片/日),認為有良好療效,能預防復發,延長生存時間。在使用免疫抑制劑和激素治療時,應注意預防卡氏肺囊蟲感染所致的肺炎,約6%的GPA患者在免疫抑制治療的過程出現卡氏肺囊蟲肺炎,並可成為GPA的死亡原因。
(2)生物製劑:利妥昔單抗即抗CD-20單克隆抗體可以清除B細胞,以往臨床上主要用於治療淋巴瘤,目前已經有兩項隨機對照臨床試驗證實該藥能夠誘導ANCA相關血管炎(包括GPA、變應性肉芽腫性血管炎和顯微鏡下多血管炎)緩解。另外,已經有臨床試驗證實依那西普(Etanercept)對GPA無效。
(3)血漿置換:對活動期或危重病例,可用血漿置換治療作為臨時治療。但需與激素及其他免疫抑制劑合用。
(4)急性期患者如出現腎衰則需要透析,55% - 90%的患者能恢復足夠的功能。
4.對於聲門下狹窄、支氣管狹窄等患者可以考慮外科治療。
預後 GPA通過用藥尤其是糖皮質激素加環磷醯胺聯合治療和嚴密的隨診,能誘導和維持長期的緩解。近年來,GPA的早期診斷和及時治療,提高了治療效果。過去,未經治療的GPA平均生存期是5個月,82%的患者一年內死亡,90%多的患者兩年內死亡。目前大部分患者在正確治療下能維持長期緩解。影響預後的主要因素是難以控制的感染和不可逆的腎臟損害,年齡57歲以上,血肌酐升高是預後不良因素。此外,ANCA的類型對治療的反應和預後似乎無關,但有抗PR3抗體的患者若不治療有可能病情更活動,進展更迅速。故早期診斷、早期治療、力爭在腎功能損害之前給予積極治療,可明顯改善預後。
護理 1.一級預防
(1)加強營養,增強體質。
(2)預防和控制感染,提高自身免疫功能。
(3)避免風寒濕,避免過累,忌菸酒,忌吃辛辣食物。
(4)室外活動時保護眼用眼罩防護及鼻部的保護。
2.二級預防早期診斷,了解眼、鼻感染情況,做好臨床觀察,早期發現各個系統的損害,早期治療,主要控制眼、鼻的感染。
3.三級預防注意肺、腎、心及皮膚病變,並注意繼發性金黃色葡萄球菌感染的發生。此外,神經系統、消化系統亦可能被累及。
肉芽腫性血管炎
 肉芽腫性血管炎
肉芽腫性血管炎