類型 病毒的
核酸 包括雙鏈DNA(dsDNA)、單鏈DNA(ssDNA)、雙鏈RNA(dsRNA)、單鏈RNA(ssRNA)等不同類型;病毒顆粒中的組成成分有簡有繁,有的用顆粒自帶專門於病毒複製的
核酸酶 ,有的則無。有的病毒核酸並不僅有一個分子,如流感病毒有8條RNA,呼腸孤病毒有11-12條dsRNA。由於病毒種類繁多,核酸類別不同,因而病毒的複製機制不盡相同。
ssRNA病毒的複製
有些ssRNA病毒,一旦病毒顆粒中的RNA進入寄主細胞,就直接作為mRNA,翻譯出所編碼的蛋白質,其中包括衣殼蛋白和病毒的RNA
聚合酶 。然後在病毒RNA聚合酶的作用下複製病毒RNA,最後病毒RNA和衣殼蛋白自我裝配成成熟的病毒顆粒。這類病毒很多,如ssRNA、
脊髓灰質炎 病毒、
鼻病毒 、
TMV 等。
還有另一類ssRNA病毒,它們的複製特點是病毒顆粒中的ssRNA病毒為負鏈,進入寄主後不能直接作為mRNA,而是先以負鏈RNA為模板由轉錄酶轉錄出與負鏈RNA互補的RNA,再以這個互補RNA作為mRNA翻譯出遺傳密碼所決定的蛋白質。這類病毒稱之為負鏈非侵染型病毒,如濾泡性口腔炎病毒、流感病毒、副流感病毒、萵苣壞死黃化病毒等。
RNA病毒 此外,還有一類特殊的ssRNA病毒即
反轉錄病毒 。該類病毒通常引起人和動物的腫瘤,其中包括造成人免疫性缺陷症的愛滋病病毒、
白血病 病毒、肉瘤病毒等。在它們的髓核中攜帶
反轉錄 酶,能使RNA反向轉錄成DNA,豐富和發展了分子生物學的
中心法則 。它們的複製有其特有的特點,一是單鏈RNA的基因組必須反轉錄成雙鏈DNA;二是隨後這種DNA必須整合到細胞
DNA 中;三是整合狀態長期持續下去並傳給子代細胞,也可能轉錄RNA,生產子代病毒或使細胞轉化;四是感染細胞不會死亡,分裂不停止。也就是說這類病毒的潛伏期很長,有時可以終身帶毒而不發病。
雙鏈RNA病毒的複製
雙鏈RNA病毒有兩個特點,一是它的基因組為10-12條雙鏈RNA分子;二是它有單層或者多層衣殼,而沒有囊膜。病毒的RNA-RNA 聚合酶存在於髓核中,在該聚合酶的作用下
病毒基因組 轉錄正鏈RNA,它們自髓核逸出。它們既能作為mRNA,又能作為病毒基因組的模板。MRNA翻譯結構蛋白,裝配內層衣殼後,正鏈RNA進入,並形成雙鏈RNA。然後又重複上述過程,最後獲得了外層衣殼。
綜上所述,病毒複製的特點表現在:一是利用寄主細胞的物質和能量進行病毒生物大分子的合成;二是複製周期短,繁殖效率高;三是反轉錄病毒的複製方式,豐富了遺傳信息傳遞的中心法則。
負鏈RNA病毒複製
負鏈RNA病毒複製的大致過程是:首先病毒通過其表面糖蛋白與
宿主 細胞的特異性受體結合,接著病毒囊膜與細胞漿膜(即通過不依賴於PH途徑)或有酸性環境的核內體膜(PH依賴途徑)融合後釋放病毒
核糖核蛋白 複合體(RNP)至細胞漿,在轉錄過程中每一mRNA得以合成,而通過複製產生全長反義基因組RNA,使其作為病毒基因組RNA的模板。很多負鏈RNA病毒在感染細胞的胞漿中複製,而一些
正粘病毒 和布尼亞病毒在細胞核中複製。新合成的RNP複合體與
病毒結構 蛋白在細胞漿膜或高爾基體膜組裝,然後釋放新合成的子代病毒。
負鏈RNA病毒複製的主要步驟 在動物正鏈RNA病毒的研究上,1996年,Meyers G等[129]構建了
豬瘟病毒 (Classical swine fever virus,CSFV)基因組全長
cDNA克隆 ,將cDNA克隆體外轉錄後獲得的RNA轉染豬腎細胞後最終產生了有感染性的CSFV,雖然拯救出的帶有遺傳標記的CSFV比野生型生長能力上差一些,但仍具有感染性。這是較早的有關CSFV拯救的報導。此外,有報導首先建立表達T7 RNA 聚合酶的豬腎細胞系SK6,然後將CSFV基因組cDNA克隆線性化後轉染該細胞系,結果成功拯救出與野生型CSFV生物學特性
一樣的病毒,且病毒的效價比用體外製備轉錄本的方法高200倍,如對cDNA克隆不進行線性化直接用環型重組體進行轉染,則拯救出的病毒效價高20倍[130]。此外,在CSFV疫苗株C株的反向遺傳研究上已有很多報導,其中在對
標記疫苗 、病毒複製、毒力和
宿主特異性 等方面都有相關報導。
提取方法 試劑準備 1、 TROzlo試劑、氯仿、75%乙醇(0.1% DEPC配製)。
2、 塑膠器皿需用0.1% DEPC水浸泡。
3、 0.1%DEPC水:100ml dd水中加入DEPC0.1ml,充分振盪,37℃孵育12h以上,121℃高壓滅菌20min,於4℃保存。
操作步驟 1、 樣品處理
(1) 組織:50-100mg組織中加入1ml TROzlo試劑。
(2) 單層細胞:加入TROzlo試劑1ml/cm2平板。
(3) 懸浮細胞:處理前洗滌細胞,以防止RNA降解。每5-10×105動物、植物或酵母細胞,或1×107細菌加入1 ml TROzlo試劑。
2、 將上述樣品於15-30℃靜置5min,使核蛋白充分解離。
3、 加入0.2ml(1 ml TROzlo試劑)氯仿,蓋緊蓋子,充分劇烈振盪15s並於15-30℃靜置2-3min。
4、 於2-8℃ 12000g離心15min。離心後樣品分層,上層水相中含RNA,下層有機相中含蛋白和DNA。
5、 取上清,加入0.5ml異丙醇,輕輕混勻,於15-30℃靜置10min後,在管底會出現膠狀沉澱,即為RNA。
6、 於2-8℃ 12000g離心10min後棄去上清。
7、 向沉澱中加入1ml 75%乙醇,輕輕混勻。
8、 於2-8℃ 7500g離心5min後棄上清
9、 將RNA樣品涼乾(不要徹底乾燥),加入適量DEPC水溶解(可於55-60℃促溶10min)。
注意問題 1、 在加入氯仿之前(第1步),樣品能於-60- -70℃保存至少一個月。
2、 RNA沉澱(第6步)在75%乙醇中於2-8℃能保存至少一周,於-5- -20℃能保存至少一年。
四、 RNA定量
RNA(mg/mL)=40×OD260×稀釋倍數(n)/1000
RNA純品OD260/OD280=2.0
RNA電泳 (1)用1×TAE電泳緩衝液製作瓊脂糖凝膠,加1×TAE電泳緩衝液至液面覆蓋凝膠。
(2)在超淨工作檯上,用移液器吸取總RNA樣品4μl於封口膜上。在實驗台上再加入5μl 1×TAE電泳緩衝液及1μl 的10×載樣緩衝液,混勻後,小心加入點樣孔。
(3)打開電源開關,調節電壓至100V,使RNA由負極向正極電泳,約30min後將凝膠放入EB染液中染色5min,用清水稍微漂洗。在紫外透射檢測儀上觀察RNA電泳結果。
裝配與釋放 新合成的病毒核酸和病毒結構蛋白在感染細胞內組合成病毒顆粒的過程稱為裝配(Assembly),而從細胞內轉移到細胞外的過程為釋放(Release)。大多數
DNA病毒 ,在核內複製DNA,在胞漿內合成蛋白質,轉入核內裝配成熟。而
痘苗病毒 其全部成份及裝配均在胞漿內完成。RNA病毒多在胞漿內複製核酸及合成蛋白。感染後6個小時,一個細胞可產生多達10,000個病毒顆粒。
病毒裝配成熟後釋放的方式有:⑴宿主細胞裂解,病毒釋放到周圍環境中,見於無
囊膜病毒 ,如腺病毒、
脊髓灰質炎病毒 等;⑵以出芽的方式釋放,見於有囊膜病毒,如
皰疹病毒 在核膜上獲得囊膜,流感病毒在細胞膜上獲得囊膜而成熟,然後以出芽方式釋放出成熟病毒。也可通過
細胞間橋 或細胞融合鄰近的細胞。
病毒的增殖不只是產生有感染性的子代,絕大多數
動物病毒 在大量感染的情況下,經多次增殖會產生缺損干擾顆粒(Defective interfering particles),它是能幹擾親代病毒複製的
缺損病毒 ,其核酸有部分缺損或被宿主DNA片段替換。缺損干擾顆粒的基本特性是:
⑴本身不能繁殖;
⑶干擾同種病毒而不干擾異種病毒的增殖;
⑷在感染細胞內與親代病毒競爭性增殖。由於缺損干擾顆粒的產生,使同種感染性病毒數量減少,在導致病毒的
持續性感染 中具有一定的作用,但疫苗中含有大量缺損干擾顆粒會影響活疫苗的
免疫效果 。
遺傳學研究 近年來,在
分子病毒學 研究領域興起一門新型技術,即在
RT-PCR 和體外轉錄RNA技術基礎上建立起來的全長感染性cDNA克隆技術,也叫反向遺傳操作技術(reverse genetics manipulation ),又名“病毒拯救(rescue of virus)”,它解決了對病毒基因組RNA難以操作這一難題。從cDNA克隆拯救出負鏈RNA全病毒是90年代分子病毒學研究領域最振奮人心的突破之一,它開啟了人們對病毒基因組進行人工操作以及詳細了解病毒基因及其產物功能的大門。該技術發展迅速,倍受國內外研究者關注。
與經典的從表型改變到進行
基因 特徵研究的思路相反,反向遺傳操作技術是指通過構建RNA病毒的感染性分子克隆,將病毒基因組RNA逆轉錄成cDNA,在DNA分子水平上對其進行體外人工操作,由病毒基因組cDNA和各種
輔助蛋白 來組裝新的RNA病毒的一項技術。由於最終“拯救”出的RNA病毒來源於cDNA克隆,因此,可通過中間過程中人為加入的DNA環節,在DNA水平上對RNA病毒基因組進行各種體外人工操作,如進行
基因突變 、基因敲除(缺失)、基因插入、基因置換和基因互補(即構建嵌合病毒)等改造,以此來研究RNA病毒的基因複製和表達調控機理、RNA編輯和自發重組與誘導重組、病毒與宿主間的相互作用關係(如插入報告基因來研究病毒在宿主細胞間的傳遞機制)、抗病毒策略、基因治療研究以及構建新型病毒載體表達外源基因和進行
疫苗 的研製等。
1976年Goff S. P等首先報導成功拯救出SV40 DNA病毒突變株,雖然拯救出的不是RNA病毒,但這是最早的有關病毒拯救的報導。1978年,Taniguchi T 等報導從全長cDNA克隆拯救出在細菌中有感染性的Qβ
噬菌體 。接著,基因組長約150kb的
單純皰疹病毒 和長約190kb的痘苗病毒的重組病毒的成功拯救及有關研究是病毒學研究的領域重大突破。為在早期反向遺傳操作體系的建立奠定了基礎。
區別 C肝病毒疫苗的研製“瓶頸”出現在RNA病毒的形態上面。DNA形態通常比較穩定,因此,DNA病毒的複製,都與“原版”DNA高度一致,因此可以研製出許多用於預防B肝病毒疫苗。與此相反,RNA病毒在複製過程中會發生錯誤的“拼寫檢查”,RNA病毒的變異速度比DNA病毒快100萬倍,而且體形經常改變。這就使得C肝等RNA病毒的疫苗研製很難。即使某天研製出C肝病毒疫苗,每年還是要根據新出現的變異C肝病毒不斷研製新的疫苗。
C肝變幻莫測,對人類健康危害極大,我們怎樣才能保護自己免受C肝的感染呢?最佳方法就是儘早了解RNA致命病毒的本質,及其感染和傳播的原理。進行早期診斷和治療也非常必要,判斷是否感染C肝的唯一辦法是做C肝測試,以確保在病毒侵害肝部之前進行治療。專家們建議,在C型肝炎高危人群中進行
C型肝炎抗體 檢查刻不容緩。有輸血史或是用靜脈注射毒品、多個性夥伴者,以及經常和血液接觸的醫護人員,美容師,牙醫,警察等都因該考慮接受C肝檢查。
雙RNA病毒科 本科病毒形態與
呼腸孤病毒 相似,過去歸於
呼腸孤病毒科 ,亦曾作為分類地位 未定的病毒。1973年,當人們認識到該科成員中的傳染性胰壞死病毒和傳染性
法氏囊病 病毒在形態學上很相似,尤其是它們的基因組都含有雙股雙節段RNA後 ,建議設立一個新科。1984年正式命名為雙RNA病毒科。在國際病毒分類委員會(ICTV)第4次報告中,作為可能的雙RNA病毒科。在1991年ICTV第5次報告中,正式獨立 為一個新的科,僅設一個屬[CD2]雙RNA病毒屬。在1995年ICTV第6次報告中,將雙RNA病毒 科分設三屬,即水生雙RNA病毒屬(代表種為傳染性胰壞死病毒)、禽雙RNA病毒屬(代表種 為
傳染性法氏囊病 病毒)以及昆蟲雙RNA病毒屬(代表種為果蠅的X病毒)。該科的其它成 員還有雙瓣軟體動物的Tellina病毒(TV)和
牡蠣 病毒(Oyster virus,OV)。本科病毒呈二十面體對稱,球形,粒子直徑大小約60nm,核衣殼有32個殼粒,92個形態亞單 位。無囊膜,表面無突起。無特徵性雙層衣殼而區別於
呼腸孤病毒 。採用EDTA、胰酶或胰凝 乳蛋白酶處理純化的病毒,易於丟失核心。病毒氯化銫浮密度為1?33g/cm?3,對乙醚、氯仿穩定,對酸、鹼(pH3~9) 及熱(56℃,30分鐘)相對穩定,在20℃ pH7?5的環境中,能抵抗1%SDS達30分 鐘而活力不喪失。病毒分子量為55×10?6Da,S??20w?=435。
病毒粒子 有4種
結構多肽 和 一種依賴RNA的RNA聚合酶,不含類脂。病毒基因組占整個病毒粒子重量的9?7% ,為線性雙股、雙節段RNA,無感染性,大小分別為A節段3?3kb,B節段3?8kb。病毒在胞漿內複製,成熟的病毒粒子集積在胞漿中,細胞裂解時釋放出大約半 數的子代病毒,另一半仍與細胞結合。本科病毒能水平傳播,還可能垂直傳播,尚未發現任何生物傳播媒介。
雙RNA 流感病毒 流感病毒 是一種RNA病毒,醫學上根據其
抗原性 差異來進行分類,主要有甲、乙、丙三種類型的病毒。由於流感病毒的抗原特性很不穩定,很容易發生變異,因而每一類型病毒中又出現了很多的亞類型。尤其是
甲型流感病毒 ,其毒性最強,最容易發生變異,臨床常可以引起嚴重的大暴發流行。乙型流感病毒對人類的致病力較低,僅引起局部地區散發的小流行。而丙型流感病毒僅引起人類不明顯的或輕微的
上呼吸道感染 ,多為散發性,雖然存在特例,但極少造成大範圍流行。
流感伴隨人類的發病已有很長的時間了,歷史上曾記載過很多次大規模的暴發流行。如1918年發生了一次流感的大流行,流感病毒在幾個月的時間內橫掃全世界,致使1000多萬人因此而死亡。又如五十年代,中國也曾爆發流感,之後,該病毒又經香港向全世界傳播開來,4個月內橫掃世界各大洲。據研究,這些大流行的“罪魁禍首”都是甲型流感病毒及其變異的甲亞型流感病毒所致。
腸道病毒 腸道病毒 是一種主要生長於腸道的RNA病毒,雖然名為腸道病毒,但感染後很少出現腹瀉、腹痛等胃腸道症狀。腸道感染是指胃腸消化道被微生物感染,感染的微生物包括各種細菌、真菌、病毒等,一般具有明顯的胃腸道症狀,如腹痛、腹瀉。腸道感染多由細菌所致,以
革蘭氏陰性菌 為主,主要致病菌為志賀氏菌、鼠傷寒沙門氏菌及大腸埃希菌等。我們日常生活中說的腸炎、
痢疾 都屬於腸道感染。
後來發現這種分類帶有人為性質,所以自68型起統一按腸道病毒編號分型,目前已有腸道病毒68、69、70、71、72型(人)。在畜禽腸道病毒中,重要的有
豬水皰病病毒 、豬腦脊髓炎病毒、
雞腦脊髓炎病毒 和鴨肝炎病毒等。
脊髓灰質炎 病毒 又稱
小兒麻痹病毒 ,大多引起
隱性感染 ,只有約1%產生明顯的臨床症狀,如頓挫型、非麻痹型和麻痹型脊髓灰質炎,也可引起
無菌性腦膜炎 。脊髓灰質炎可注射滅活疫苗或口服減毒活疫苗預防,效果很好。可控制流行的發生。
本病毒因最初於美國的庫克薩基地區被分離到而得名。可引起無菌性
腦膜炎 、
皰疹性咽峽炎 、胸壁痛、
手口足病 、心肌病等。A7型尚可引起麻痹型脊髓灰質炎。
ECHO(埃柯)系Enteric cytopathic hu-man orphan的縮寫,意為腸道內致細胞病變的人類孤兒病毒。在剛分離出病毒時,尚不知所引起的疾病,所以稱為“孤兒”。後來才知道它可引起無菌性腦膜炎、紅疹、普通感冒等疾病。
A型肝炎 病毒(HAV) 又稱72型病毒,直徑27納米,其RNA的分子量為1.9×106。只有 1個血清型。易感者除人外,尚有黑猩猩、南美的白唇猴和狨猴。中國紅面猴也可感染。近年已在猴胚
腎細胞 和人肺二倍體細胞上培養成功。A型肝炎潛伏期為15~40天。潛伏期的後期和發病早期,病毒由糞便排出,有傳染性。患病後可獲終身免疫力。愈後良好,很少轉為慢性。
豬水皰疹病毒 (SVDV) 只有 1個血清型。與人的庫克薩基病毒B5型有
共同抗原 ,
免疫血清 能互動中和。豬是唯一的自然宿主,主要經傷口感染。在口腔黏膜、鼻頭、
乳房 、蹄部發生
水皰 ,外觀與口蹄疫難以分辨。病毒主要存在於水皰皮和皰液中,內臟和肌肉含病毒量極微。皰皮中的病毒能抗強酸強鹼。病毒可用豬原代腎細胞或傳代細胞培養並產生病變。接種乳鼠
弱毒疫苗 、組織培養弱毒疫苗、水皰皮和皰液滅活疫苗能控制本病的流行。
豬腦病毒(PEV) 有兩個亞型,
捷克 豬捷申病 病毒和英國豬太法病病毒。除美洲和亞洲外,世界許多國家都已發現。主要病變為中樞神經灰質壞死,病死率90~100%。滅活疫苗有一定效果,但未能完全控制此病。
雞腦脊髓炎病毒(AEV) 單一血清型。自然病
毒株 均有嗜腸性,雞胚適應的Van Roekel株有高度嗜神經性。經糞便和蛋傳播,雛雞、鵪鶉、雉均可被自然感染。人工接種可感染小鴨和小鴿。病毒可用易感雛雞
神經膠質細胞 或纖維母細胞進行培養。可用疫苗預防。
鴨肝炎病毒(DHV) 可感染2
周齡 以下的小鴨,成年鴨、雞、鵝都不感染。人工接種1~7日齡雛火雞能發病。此病在歐、亞、美3洲均有發生。從糞中排病毒,由消化道感染。可用鴨胚或雞胚細胞培養病毒。母鴨可在產蛋前2~4周接種
弱毒疫苗 ,使蛋黃中有足夠的抗體,以保護雛鴨。
鼻病毒屬 能感染人、馬、牛的鼻腔而得名。
人患普通感冒的主要病原。與腸道病毒的區別如下:①不耐酸,pH3~5溶液中易被破壞;②人腎細胞中只在33℃旋轉培養物中才能很好繁殖,而腸道病毒在36~37℃靜止培養可繁殖;③比重大,氯化銫浮力密度為1.38~1.42。鼻病毒
抗原性 複雜,有100多個血清型。感染後可獲得免疫力,但維持時間短,不同型鼻病毒之間很少交叉保護,因而人可多次患感冒。對普通感冒尚無特異預防和治療方法。
心病毒屬 代表種為鼠腦心肌炎病毒,不耐酸。氯化銫浮力密度1.34,RNA含量31%。只有1個血清型。
口瘡病毒屬 因代表種
口蹄疫病毒 引起口瘡而得名。直徑23~25納米,氯化銫浮力密度1.43~1.45,RNA含量31.5%,不耐酸。
病毒 病毒
抗原性 易變異。已發現A、O、C、Asia I、SAT1、SAT2、SAT37個正型和 60多個亞型。能自然感染
偶蹄動物 ,以牛、豬最為易感。人也可被感染,但症狀輕。病毒對初生幼畜感染性強,有些毒株對牛致病力強而對豬致病力弱,有些毒株則相反。1981年,用
基因工程技術 已培育出帶有口蹄疫免疫原性蛋白基因的細菌,將用於製造疫苗。
相關信息 80多年前有一個至少在全球造成2000萬人死亡的兇手,它還從未接受正義的審判,它就是著名的“
西班牙流感 病毒”。科學家相信,研究惡貫滿盈的1918年“西班牙流感”可能有助於人類防範另一場災難性流感的襲擊。今天,1918年在人們的記憶中是模糊的。那年,第一次世界大戰以
同盟國 的戰敗投降而告終。戰爭造成了1000多萬人死亡,更多的人流離失所。在經歷了4年之久的慘烈戰爭後,人們盼望著和平寧靜的生活。然而就在此刻,一場更大規模的災難使得一次大戰的死亡幽靈相形見絀。這場在很多歷史書中只是一則小小腳註的災難,就是所謂的“西班牙流感”。
最危險的感冒 “西班牙流感”也被稱作“
西班牙女士 ”(SpanishLady),不過它卻有些名不符實。首先,它似乎並不是從西班牙起源的。其次,這場流感絕對沒有它的名稱那樣溫柔。現有的醫學資料表明,“西班牙流感”最早出現在美國
堪薩斯州 的芬斯頓(Funston)軍營。1918年3月11日午餐前,這個軍營的一位士兵感到發燒、嗓子疼和頭疼,就去部隊的醫院看病,醫生認為他患了普通的感冒。然而,接下來的情況出人意料:到了中午,100多名士兵都出現了相似的症狀。幾天之後,這個軍營里已經有了500名以上的“感冒”病人。在隨後的幾個月里,美國全國各地都出現了這種“感冒”的蹤影。這一階段美國的流感疫情似乎不那么嚴重,與往年相比,這次流感造成的死亡率高不了多少。在一場世界大戰尚未結束時,軍方很少有人注意到這次流感的爆發———儘管它幾乎傳遍了整個美國的軍營。
隨後,流感傳到了西班牙,總共造成800萬
西班牙人 死亡,這次流感也就得名“西班牙流感”。9月,流感出現在
波士頓 ,這是“西班牙流感”最嚴重的一個階段的開始。10月,美國國內流感的死亡率達到了創紀錄的5%。戰爭中軍隊大規模的調動為流感的傳播火上澆油。有人懷疑這場疾病是德國人的細菌戰,或者是芥子氣引起的。 這次流感呈現出了一個相當奇怪的特徵。以往的流感總是容易殺死年老體衰的人和兒童,這次的死亡曲線卻呈現出一種“W”型———20歲到40歲的青壯年人也成為了死神追逐的對象。到了來年的2月份,“西班牙流感”迎來了它相對溫和的第三階段。 數月後,“西班牙流感”在地球上銷聲匿跡了。不過,它給人類帶來的損失卻是難以估量的。科學家估計,大約有2000萬到4000萬人在流感災難中喪生。相比之下,第一次世界大戰造成的1000萬人死亡只有它的1/2到1/4。據估計,在這場流感之後,美國人的平均壽命下降了10年。
善化裝兇手 作為一種傳染病,流感至少已經有了2000多年的歷史。1918年“西班牙流感”的危害甚至超過了中世紀歐洲爆發的鼠疫,與最近20年流行的愛滋病打了一個平手(全球大約有7000萬人感染愛滋病,2000萬人死亡)。
流行性感冒 是比你想像的更嚴重的疾病。即便流感只有2.5%的死亡率,如果有10億人感染,那么後果就是“西班牙流感”這樣的災難。流感的另一個危險之處是它的不穩定性:今年你患上了流感,你得到了一定的免疫力。但是你可能仍然逃不過明年的那場流感。相比之下,
風疹 或者天花之類的傳染病只要患過一次就能獲得終身的免疫力。
流感病毒的結構決定了它總是能侵害你。流感病毒的遺傳物質是單鏈的
核糖核酸 (RNA),而不是你我身體中的遺傳物質DNA。有兩種蛋白質像大頭針一樣“扎”在流感病毒的蛋白質外殼上,一種叫做血凝素(HA),另一種叫做
神經氨酸酶 (NA)。HA和NA的作用是負責讓病毒———準備入侵細胞的和已經在細胞內複製、組裝好的———順利進出細胞。人體的免疫系統也正是以HA和NA作為“靶子”。如果指導HA和NA合成的流感病毒RNA發生了變化(這種變化發生的可能性要比DNA變化的可能性大),那么
人體免疫系統 就對改變了結構的HA和NA“視而不見”。直到流感痊癒,你終於獲得了對新的HA和NA的識別能力,不過很不幸:下一次流感病毒的HA和NA可能又變得讓你的免疫系統無法識別了。 迄今為止已經發現了15種HA和9種NA。科學家使用HA和NA區別各種流感病毒的身份,例如1968年的“香港型”流感被稱作H3N2。
儘管大多數人可能不知道或者早已忘記1918年的“西班牙流感”,科學家卻一直保持著警惕。弄清85年前的那場災難的原因有助於防止悲劇的重演。尋找將近一個世紀之前的疾病的病因並不是一件簡單的事。直到1930年代,人類才分離出流感病毒。1950年代,美國曾經組織了考察隊趕赴
阿拉斯加 挖掘死於1918年“西班牙流感”的病人的屍體,期望得到可供研究的病原體。很遺憾,那些埋葬在永久凍土帶的屍體因為解凍腐爛而失去了研究價值。
直到1997年,美國軍事病理研究所的病理學家陶本伯傑(JefferyTaubenberger)領導的一個研究小組才第一次找到造成“西班牙流感”的感冒病毒RNA片斷。陶本伯傑所在的研究所保留了將近一個世紀以來病人的組織樣本,包括一些浸泡在福馬林中的“西班牙流感”病人的肺組織。在28份當年的樣本中,只有一位21歲士兵的肺部樣本完全符合當時“西班牙流感”的狀況。正是在這份標本中,陶本伯傑用逆轉錄
聚合酶鏈反應 的方法找到了9段當年流感病毒的RNA“碎片”。RNA比DNA更容易分解,但是陶本伯傑發現的RNA片斷已經能夠提供一些“西班牙流感”病毒的線索了。這9段RNA片斷分屬5個不同的基因,其中包括製造HA和NA的基因。
通過比較,陶本伯傑發現造成“西班牙流感”大流行的病毒與豬流感有相似之處,如果把它歸類,那么它應該是H1N1型的。此前的理論認為,造成1918年流感大流行的病原體,可能是一種禽流感。 2001年,澳大利亞的科學家
吉布斯 (MarkGibbs)在陶本伯傑的基礎上有了進一步的發現。吉布斯把1918年流感病毒中負責製造HA的基因與30種類似的豬流感、
禽流感 、人類流感病毒中的相同基因進行對比,結果發現了一個很有趣的現象:在這個基因的前部和後部是人類流感病毒的編碼,而在基因的中段則是
豬流感病毒 的編碼。吉布斯認為,造成1918年全球流感大流行的原因,就是豬流感病毒的一段編碼“跳”到了人類流感病毒的RNA中。
繼續追蹤 然而,也有一些科學家認為吉布斯的證據不夠充分。他們認為,這種人類流感病毒的HA基因和
豬流感病毒 的HA基因“混合”(科學家稱之為“重組”)的可能性不大。陶本伯傑更是認為,吉布斯“錯誤理解”了他的數據。
要完全認識“西班牙流感”為什麼如此兇惡,可能需要測出它的基因組的全部序列。 一些科學家正在試圖挖開更多的死於1918年流感的人的墳墓。倫敦的瑪麗王后醫學院教授奧克斯福德(JohnOxford)就是其中之一。去年,他打算從
伯恩 (PhyllisBurn,一位住在倫敦南部的20歲的女性)的屍體中採集肺部樣本。伯恩當年因“西班牙流感”而去世,她被安葬在一個灌滿了酒精的密封鉛制棺材中。
牛津 相信,在伯恩的體內保存有完好的“西班牙流感”病毒。 重新調查“西班牙流感”有一定的危險性。科學家建議在生物安全性最好的實驗室中進行研究,以免“西班牙流感”病毒———假如真的能完整找到的話———泄漏出實驗室,再度危害人類。不過相比之下,大自然才是終極的“生物恐怖分子”。研究表明,野生的
水禽 是感冒病毒的“基因庫”———它們擁有全部15種HA基因和9種NA基因,因此近些年,具有較強殺傷力的各類“禽流感”層出不窮。而豬由於既能感染水禽身上的流感病毒,又能感染人類流感病毒,它很可能會成為一種病毒的“混合器”,即產生了擁有新的HA和NA的流感病毒。這樣一來,人類的免疫系統就可能面臨一場像1918年那樣的嚴峻考驗(所以現在中國很多地方就禁止在水源一公里範圍內飼養禽畜)。
數十年來,
世界衛生組織 (WHO)在全世界系統地監視人類流感病毒的變化趨勢,但是對於豬流感,卻沒有一個很好的監視系統。今年2月份,在WHO的一次關於
流感疫苗 的會議上,病毒學家
韋伯斯特 (RobertWebster)提議,WHO應研製儲備針對所有15種HA的疫苗,以防止類似1918年“西班牙流感”的出現。 科學家們還在繼續追蹤“西班牙流感”。用陶本伯傑的話說,80多年前這個惡貫滿盈的兇手,還從未接受正義的審判。
 RNA病毒
RNA病毒 負鏈RNA病毒複製的主要步驟
負鏈RNA病毒複製的主要步驟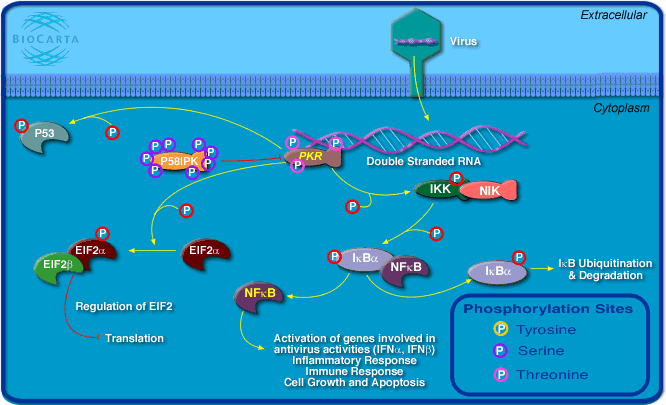 雙RNA
雙RNA