方程式
C6H6 + Br2 → C6H5Br + HBr(條件為溴化鐵)
試驗
實驗一
[原理]
用鐵作催化劑(實際起
催化作用的是FeBr3,FeBr3由Fe與Br2反應生成),苯能跟溴發生反應,苯環里的氫原子能被溴原子取代生成
溴苯。
[用品]鐵架台、燒瓶、導管、錐形瓶、苯、
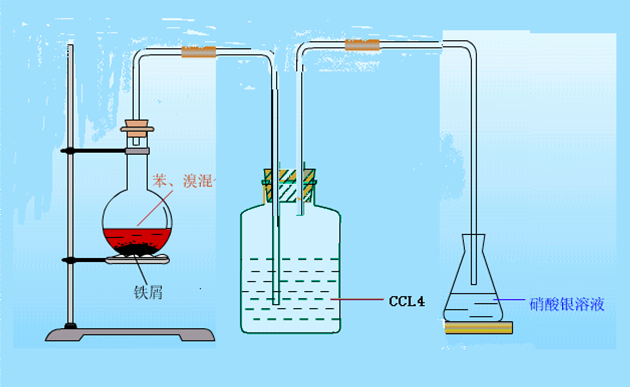
液溴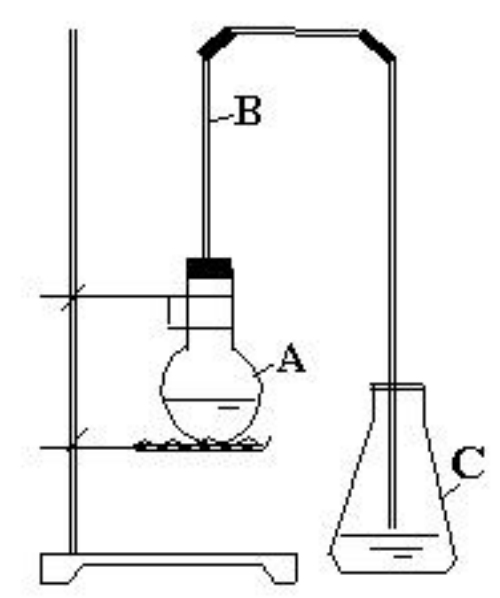 苯與溴的取代反應實驗一
苯與溴的取代反應實驗一[操作]
(1)裝置如圖。先檢查裝置的
氣密性。在圓底小燒瓶里加入5mL苯和2mL液溴,輕輕振盪,使苯與溴混合均勻。此時因無催化劑,苯與溴不發生反應。
(2)在混合液冷卻後,將準備好的還原
鐵屑(約0.5g)或幾枚去銹的小鐵釘,迅速放入小燒瓶中,立即用帶有長玻璃導管的單孔橡皮塞塞好。一般情況下反應即可開始,液面上會有小氣泡產生,隨後反應逐漸劇烈,半分鐘後液體呈沸騰狀態。在錐形瓶內導管口附近出現大量白霧(反應中生成的溴化氫溶於水而成的酸霧)。錐形瓶中導管不插入液面以下,原因是避免錐形瓶中的水倒吸入燒瓶中。(3)等反應結束後,先檢驗錐形瓶里的
氫溴酸。把錐形瓶里的液體在兩支試管各倒少許,在其中一支試管中加入
石蕊試液(會變紅);另一支試管中滴入幾滴AgNO3溶液(會有淺黃色的AgBr沉澱析出)。
Ag+ + Br- = AgBr↓
(4)把燒瓶里的液體倒入盛有冷水的燒杯里,在燒杯底部有紅褐色不溶於水的液體,這就是反應中生成的溴苯。純淨的溴苯是無色液體,製取時往往因溶解了少量的溴而呈紅褐色。可用水或10%NaOH溶液進行洗滌,洗去FeBr3和沒有反應的溴,能夠得到無色透明的油狀液體。
[注意]
(1)裝置的氣密性必須良好。(2)裝置中跟燒瓶口垂直的一段導管,起導氣兼
冷凝作用,以防止溴和苯的蒸氣揮發出來,減少苯和溴的消耗以及它們對環境的污染,所以它應有一定的長度,一般不小於25cm。(3)在盛放液溴的試劑瓶中,液溴上面是一層溴的飽和水溶液,取用時必須將吸管插入下層液溴部分,以吸取純溴。所用的苯套用無水氯化鈣乾燥,所用的燒瓶和導管也應是乾燥的。否則反應比較困難,甚至不反應。(4)這個反應是放熱的,一般不需加熱,如開始要加熱時,只用熱水浴微微加熱(30~40℃)即可。(5)此反應不宜太劇烈,如反應過於劇烈時,可把燒瓶浸在盛冷水的燒杯中冷卻。反應溫度過高,會增加苯和溴的揮發和副反應的產物
二溴苯的產量。(6)為了防止反應進行得過於猛烈,所用鐵屑不宜太細,更不宜用鐵粉代替鐵屑。(7)液溴容易揮發,又有很強的腐蝕性,取用液溴時一定要注意安全,不要沾在手上。最好戴上橡皮手套,在通風櫥內取。萬一沾到皮膚上,應立即用水沖洗,再用
酒精擦淨,然後塗上甘油。
實驗二
[用品]
鐵架台、圓底燒瓶、分液漏斗、導管、洗氣瓶、普通漏斗、錐形瓶
[原理]
與方案一的原理一樣,採用鐵作催化劑。
[操作]
1.裝置如圖所示,在分液漏斗中加入苯和溴的混合液,圓底燒瓶中加入鐵屑。
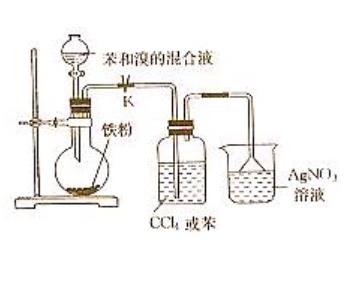 苯與溴的取代反應實驗二
苯與溴的取代反應實驗二2.在洗氣瓶里放少量四氯化碳(或苯),在燒瓶里加適量AgNO3溶液。
3.打開分液漏斗活塞,反應即開始。
4.實驗完畢,在燒瓶里有油狀的溴苯生成。燒瓶中產生淺黃色沉澱。
[注意]
1.倒置漏斗的作用是防倒吸。
實驗三
[原理]
苯分子中的氫
原子,在催化劑的作用下,能被鹵素原子取代,生成相應的鹵代苯。
苯與鹵素取代反應的機理與
烷烴取代反應不同。首先,鹵素分子在催化劑作用下發生極化,極化分子的正極原子可在與
苯環上的一個氫原子發生取代反應;極化分子的負極原子與被取代下來的氫原子結合成鹵化氫分子。這種取代反應稱為
親電取代反應。
[用品]
苯、鋁片、鐵屑、液溴、硝酸銀、氫氧化鈉、
紫色石蕊試液、托盤天平、滴管、鐵架台、導管、玻璃導管、水槽、蒸餾燒瓶、膠塞、量筒。
[操作]
(一)在乾燥的蒸餾燒瓶中,加入4mL純淨的苯和1g還原鐵粉,立即蓋上帶玻璃導管的膠塞。玻璃導管要浸入液體中,導管要稍粗些,以便於加溴操作。
(二)往水槽(或燒杯中)倒入蒸餾水及少量紫色石蕊試液。調整漏斗高度,使其下口剛好與水面相接近。為觀察倒扣漏斗中的白霧生成及氫溴酸使
指示劑發生的顏色變化。可分別使黑色和白色襯板增強直觀性。
(三)用滴管從蒸餾燒瓶單孔塞的粗玻璃管上口加入1mL液溴進入燒瓶底部的苯層下與鐵粉反應,生成三
溴化鐵,在三溴化鐵的催化下,溴即可和苯發生取代反應,生成溴苯。
(四)反應停止後,可向燒杯中滴入幾滴硝酸銀溶液,觀察溴化銀沉澱的生成,進一步證明生成的氣體是溴化氫。
(五)將燒瓶里的液體倒入另一盛有稀鹼溶液的燒杯里,用玻璃棒充分攪拌,觀察到液體顏色逐漸消失,靜置後,由於溴苯比水密度大,且不溶於水,沉於燒杯底部。純溴苯是無色的,所製得的溴苯因溶有少量溴而呈淡黃色。
[注意]
1.成敗關鍵
催化劑可用Al或Fe,實際上起
催化活性作用的是AlBr3或FeBr3,故必須使用表面清潔無油污的金屬鐵(可將還原鐵粉加入盛有Na2CO3溶液或稀NaOH溶液的燒杯中加熱除去油污),只要催化劑選的合適,本反應進行極為順利。
2.本實驗要求所用燒瓶、導管保持乾燥。所用苯也應在實驗前幾天加無水氯化鈣進行乾燥,臨用前過濾,少量水分的存在,將使反應開始緩慢,甚至不起反應;水的存在還會使生成的溴化氫不易排出,無法觀察溴化氫的生成。
3.反應停止後,將液體倒入稀鹼溶液中的目的是為了吸收剩餘的溴,反應如下:
2NaOH+Br2=NaBr+NaBrO+H2O
以利對產物溴苯的觀察。
4.溴具有強腐蝕性和刺激性,取用時必須注意安全,不要滴落在桌上或地上,儘量減少溴蒸氣的擴散。此實驗加入的液溴不要過量。
5.教材要求溴化氫導出管與燒瓶垂直且較長,還可起冷凝管作用,以利尚未參加反應的苯、溴蒸氣回流。但經多次實驗證明,由於實驗用量少,改用短導管對實驗效果無不良影響,且操作便利。
6.為提高實驗成功率,本實驗對教材中的裝置和操作進行改進。增加了一根粗玻璃管(或細玻璃管一端燒製成喇叭口),直插燒瓶底部,使液溴直接加到苯層下部。這可以防止溴揮發的蒸氣充滿燒瓶,同反應生成氣體一同逸出,溶在燒杯的水中,使溶液變成黃色,造成實驗失敗。為突出實驗的直觀效果,在吸收溴化氫的蒸餾水中增加石蕊試劑。實驗後用稀鹼溶液吸收剩餘的溴,有利於學生對溴苯的觀察。
7.演示苯和溴的取代反應時,必須突出對產物的分析與檢難,並與甲烷和
氯氣的取代
反應物對比,達到鞏固取代反應概念的目的。通過分析兩個取代反應的條件,啟發學生認識苯和鹵素的取代反應要比甲烷容易進行,從而使學生認識苯分子結構中的
化學鍵與烷烴中的單鍵不同,藉以強調
苯環的特性。
實驗四
[原理]
跟實驗方案二的原理一樣都用鐵作催化劑。
[用品]
鐵架台、燒瓶、漏斗、導管、溴、苯、鐵釘、硝酸銀溶液、5%氫氧化鈉溶液
[操作]
1.裝置如圖所示
2.在分液漏斗里加入2mL溴、5mL苯,在鐵釘附近有“沸騰”現象(反應不快可微微加熱)。產生的氣體依次通過C、D、E、F,使無色的苯變橙色,石蕊溶液變紅,在硝酸銀溶液里生成淡黃色的溴化銀沉澱。
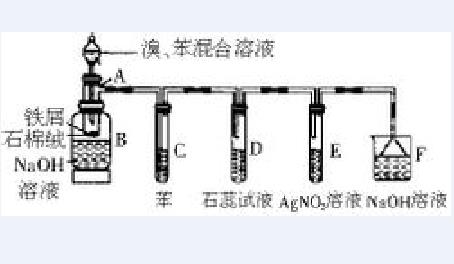
3.反應2~3min。實驗結束後,在分液漏斗里加入30mL5%的氫氧化鈉溶液,振盪燒瓶(這時有倒吸現象)。然後在燒瓶里加冰水,靜置後倒去上層液體,沉在燒瓶底部的液體就是粗溴苯。
[注意]
1.本實驗要防止污染環境。可以採取下列措施:(1)溴的用量不宜多。(2)滴加溴的速度要小。(3)用氫氧化鈉溶液吸收剩餘的氣體。(4)在原燒瓶里處理反應產物。
2.催化劑鐵釘或鐵片,在實驗前要經過酸洗、水洗、擦乾後要立即使用,切不要在空氣里停留過久。
實驗五
[原理]
以實驗一相同
[用品]
具支試管、鐵架台、燒瓶、漏斗、導管、錐形瓶、苯、液溴、鐵屑、玻璃絲、氫氧化鈉溶液、
蒸餾水[操作]
1.把具支試管的下部拉細、截口,裝置如圖所示。在拉細端放少量玻璃絲,擋住鐵屑不落下。在管里填裝鐵屑約3~4cm高。
2.苯和液溴的混合液,以3s一滴的速率滴入鐵屑中。當鐵屑被混合液潤濕後,以4s一滴的速度滴入混合液。
3.片刻後,有無色油狀溴苯滴入盛氫氧化鈉溶液的燒杯里。在錐形瓶的導管口附近有白霧。
4.實驗結束後,把硝酸銀溶液滴入錐形瓶里,有淺黃色的溴化銀沉澱生成。
[注意]
1.在本實驗中,隨著反應的進行,
反應物和生成物能分開,而且不污染環境。
2.苯和液溴以5:3混合為宜。
3.滴加混合液的速度是本實驗的關鍵。滴液太快,流出液里會呈紅棕色;如果太慢,實驗需較長時間。此外,鐵屑的用量宜稍多一點。
4.裝置里的長導管起冷凝加流作用。
5.本實驗約需6min。
實驗六
[原理]
用鐵作催化劑,苯能跟溴發生反應,苯分子裡的氫原子能被溴原子取代生成溴苯。
[用品]
具支試管(25×200mm)、錐形瓶、導管、鐵架台、分液漏斗、吸耳球、抽濾瓶、鐵粉、石棉、1mol·L-1氫氧化鈉溶液、苯、溴苯混合液、硝酸銀溶液
取25×200mm具支試管改制成反應管,在下端小管內裝好鐵粉和石棉(鐵粉、石棉柱高約2cm)。兩隻錐形瓶,左邊的盛1mol/L氫氧化鈉溶液,右邊的盛蒸餾水。中間的具支試管里裝入苯,以溶解混在
溴化氫里的溴。
[操作]
1.向反應管逐滴加入溴和苯的混合液,幾秒鐘內即可發生劇烈反應。產生的溴化氫氣體因混有溴蒸氣而略帶黃色。經苯洗滌後,溴化氫進入錐形瓶,在導管口形成
白霧。
2.向左邊的抽濾瓶里滴入硝酸銀溶液,產生淺黃色的溴化銀沉澱。
3.1~2min後,在反應管的下端流出無色(溶有少量溴而略呈黃色)液體。用吸耳球在錐形瓶的側支管減壓,使上述液體滴入瓶里,沉入底部。這油狀液體即是溴苯。
[注意]
1.溴和苯按1:2體積配製成混合液體。洗氣用的苯溶有溴後仍可回收使用。
2.可以用濃
氨水檢驗溴化氫的生成。在右邊的錐形瓶里用幾滴濃氨水代替蒸餾水,就能看到大量的濃
白煙,它是
溴化銨。可見度很高。
 苯與溴的取代反應實驗一
苯與溴的取代反應實驗一 苯與溴的取代反應實驗二
苯與溴的取代反應實驗二
 苯與溴的取代反應實驗一
苯與溴的取代反應實驗一 苯與溴的取代反應實驗二
苯與溴的取代反應實驗二
