生物學特性
大腸桿菌是人和動物腸道中的正常菌群,一般對人無害。它有三種抗原結構,即菌體抗原(又叫O抗原)、包膜抗原(又叫K抗原)和鞭毛抗原(又叫H抗原)。
O抗原是對大腸桿菌進行分型的基礎,目前已發現有170多種。其中一些特殊的
血清型具有致病性,可引起人類感染性腹瀉。引起人類感染性腹瀉的大腸桿菌又可被分為5類,即腸
致病性大腸桿菌、腸產毒性大腸桿菌、腸侵襲性大腸桿菌、腸聚集性大腸桿菌和腸出血性大腸桿菌。 腸出血性大腸桿菌因能引起人類的出血性腸炎而得名。EHEC包括幾種血清型,分為157、26、111。分離出的主要致病菌株為O157∶H7。還包括O26H11、O111及無動力的O157菌株O157NM等。目前不斷發現其他型菌株與出血性腸炎的關係。
EHEC-O157H7為革蘭氏染色陰性的、有動力、兩端鈍圓的短桿菌。沒有芽孢、有周鞭毛,大多數菌株有莢膜。它對熱敏感,最適生長溫度為37℃,30-42℃時在肉湯中也生長良好,55℃經60分鐘可有部分存活,在75℃水中1分鐘可被殺死。遲緩發酵山梨醇-
麥康凱(SMAC)
培養基可作為對O157∶H7之篩選培養基。在SMAC培養基上,O157∶H7
菌落無色,而發酵菌株呈粉紅色,但有半數EPEC菌株有類似O157∶H7之特性,應注意EPEC與EHEC之鑑別。大腸埃希桿菌O157∶H7抵抗力較強,耐酸耐低溫。在自然界的水中可存活幾周甚至幾個月,在冰櫃內則可長期生存。在酸性果汁(PH為2)中甚至可存活幾十天。對氯敏感,在
余氯為1mg/l的水中可被殺死。O157∶H7具有含60MD質粒的
纖毛,此纖毛能與Henle407細胞粘附。EHEC能產生大量類志賀樣毒素(Shiga-Like toxin,簡稱SLT)。SLT有抗原性,可被志賀I型菌毒素之兔抗血清中和。因SLT能使Hela細胞和Vero細胞(即
非洲綠猴腎細胞)變性壞死,引起組織病變,溶解,死亡,故又稱之為Veto毒素,簡稱VT。在細菌產生的毒素中,VT為最強毒素之一。加熱98℃,15min可被
滅活。根據抗原性不同,分為VT1、VT2兩種。結構上均由1個A
亞單位和5~6個B亞單位組成。分子量分別為3300及8000。
大腸埃希桿菌O157∶H7不同於其他
血清型大腸埃希桿菌,大腸埃希桿菌O157∶H7不含有一般
腸毒素基因密碼,用
基因探針及動物試驗檢測均不產生LT、ST,不具侵襲性,不屬於EPEC血清型。

生長環境
1、腸出血性大腸桿菌產生的毒素稱為志賀樣毒素或類志賀毒素,這是因為它們與志賀氏痢疾桿菌產生的毒素相似。腸出血性大腸桿菌可在7℃-50℃的溫度中生長,其最佳生長溫度為37℃。
2、一些出血性大腸桿菌可在pH值達到4.4和最低水活度(Aw)為0.95的食物中生長。通過烹調食物,使食物的所有部分至少達到70℃以上時可殺滅該菌。
3、O157:
H7大腸桿菌是與公共衛生有關的最重要的出血性大腸桿菌的血清類型;然而在散在病例和暴發中也經常涉及其它血清類型。

發病機制
動物試驗研究結果表明O157H7大腸桿菌進入人體後主要侵犯小腸遠端和結腸、腎臟、肺、脾臟和大腦。引起腸黏膜水腫、出血、液體蓄積、腸
細胞水腫、壞死及腎臟、脾臟與大腦的病變。 O157H7大腸桿菌主要依靠它產生的志賀樣毒素、溶血素和對
上皮細胞的粘附力引起人體的損害。O157H7大腸桿菌能產生一種細胞毒素,由於這種毒素能使
綠猴腎細胞(又叫Vero細胞)變性壞死,因而把它命名為VT(Vero Toxin)毒素。這種毒素還可被志賀抗毒素完全中和,因而又把它叫做志賀樣毒素。它能抑制真核細胞的蛋白合成、促進血小板聚集、損傷內皮細胞,與出血性腸炎和
血小板減少性紫癜的發生有關。大腸桿菌對上皮細胞的粘附力是許多腸道病原菌的共同特徵。研究發現幾乎所有的O157H7大腸桿菌菌株都含有一個分子量為60-70Mda的大
質粒,學者們普遍認為這個大質粒與細菌的致病力密切相關,但還沒有得到實驗證明。也有報導認為O157H7大腸桿菌可藉助一種新的基因而產生名叫“希加”的毒素對人體致病。毒素可破壞人的紅細胞導致溶血,也可吸附於腎臟,堵塞毛細血管從而可引起腎臟和腦功能障礙,導致病情惡化,但這一點也還有待於實驗的進一步證明。目前對溶血素的具體致病機制還不清楚。

EHEC從口腔侵入人體,達腸腔後,藉助
菌毛局限性黏附在腸絨毛的刷狀緣上,B
亞單位與腸
上皮細胞糖脂受體GB3結合黏附,A亞單位具有毒素活性,進入細胞並抑制
蛋白質合成,損害腸上皮細胞,重點是盲腸與結腸,肉眼可見腸黏膜瀰漫性出血、潰瘍。除腸上皮細胞,GB3受體還廣泛存在於血管內皮細胞、腎和神經組織細胞,損害血管內皮細胞,紅細胞和血小板而導致HUS。廣泛性腎小管壞死可導致急性腎衰竭。副交感神經的
興奮性由於毒素的作用而增強,可出現
竇性心動過緩以及驚厥,Vero毒素還刺激內皮細胞釋放Ⅷ因子,從而出現血栓形成性
血小板減少性紫癜。
德中聯合研究稱德國腸道病系新型病菌引發
德國和中國的一項聯合基因研究初步顯示,導致最近德國腸出血性大腸桿菌(
EHEC)疫情的致病菌是包含兩種不同菌種基因的新型病菌。
 血清型為O104型的大腸桿菌
血清型為O104型的大腸桿菌德國漢堡-埃彭多夫大學醫學院細菌專家
羅德在接受德新社採訪時說,該醫學院與
中國研究人員的聯合研究發現,造成此次腸出血性大腸桿菌疫情的病菌“是常見的腸出血性大腸桿菌的一個非常遠的遠親”。它大約80%的基因來自血清型為O104型的大腸桿菌,其餘20%的基因來自另外一種大腸桿菌。這一新組合有利於病菌在腸細胞上附著,從而使其能在腸道內
宿居更長時間,造成更大的破壞。此外,這種病菌還對抗生素具有很強的抗藥性。
世界衛生組織食品安全專家
克魯澤當天也對
美聯社表示,初步基因組測序結果顯示,德國腸出血性大腸桿菌疫情的致病菌是由兩種不同大腸桿菌基因結合的突變體,以前從未被發現過。
病菌與愛滋腸毒同源
中國
深圳華大基因研究院和德國一家大學2011年6月3日宣布,中德科學家聯合對本次流行的病菌進行了
全基因組測序,結果顯示,該病菌與愛滋病患者腹瀉標本中的大腸桿菌
同源性超過93%,兼具侵襲、產毒、抗藥等多種“凶性”,難以治療,死亡率偏高。
深圳華大的初步分析結果顯示,這次肆虐歐洲的
血清型0104大腸桿菌,該病菌帶有新型特異
基因,與2002年從
中非共和國愛滋病患者腹瀉標本中分離的腸聚集性大腸桿菌55989菌株,同源性超過93%,同時它還通過
基因水平轉移,獲得腸出血性大腸桿菌的毒力基因和毒力相關
質粒,這可能與該菌株強毒性和重症感染有關。
傳播途徑
腸出血性大腸桿菌感染是一種人畜共患病。凡是體內有腸出血性大腸桿菌感染的病人、帶菌者和家畜、家禽等都可傳播本病。動物作為傳染源的作用尤其重要,較常見的可傳播本病的動物有牛、雞、羊、狗、豬等,也有從鵝、馬、鹿、白鴿的糞便中分離出O157H7大腸桿菌的報導。其中以牛的帶菌率最高,可達16%,而且牛一旦感染這種細菌,排菌時間至少為一年。患病或帶菌動物往往是動物來源
食品污染的根源。如牛肉、奶製品的污染大多來自帶菌牛。帶菌雞所產的雞蛋、雞肉製品也可造成傳播。帶菌動物在其活動範圍內也可通過排泄的糞便污染當地的食物、草場、水源或其他水體及場所,造成交叉污染和感染,危害極大。人及家畜、家禽中O157H7大腸桿菌的感染情況,在不同國家、不同地區差異很大。
世界衛生組織對發生O157H7感染爆發地區的農場和牲畜糞便進行檢測,結果從7.1%的農場和1.8%的牲畜糞便中檢出該菌。在美國進行的另一次調查中,在3.7%的牛肉、1.5%的豬肉和2.0%的羊肉中分離到O157H7大腸桿菌。1996年
美國農業部進行的一個調查表明,在28個州中有4%的
牛犢和5%的健康奶牛攜帶O157H7大腸桿菌。可見該菌對人群健康的威脅是較為嚴重的。1999年4-6月我國福建省
衛生防疫站對福州市菜市場家畜、家禽5種肉類標本共201例進行檢測。結果從138份豬肉標本中檢出3株O157大腸桿菌(2株為O157H7,1株為O157NM ),檢出率為2.17%。
廣州鐵路局衛生防疫站從市售的50份豬大腸樣本中檢出2株O157H7,檢出率為4.0%。
上海市疾病預防控制中心從500份家畜糞便中檢出7份O157H7,檢出率為1.4%,其中奶牛檢出率為1.43%,豬糞為1.33%。秦皇島市衛生防疫站還從275例腹瀉病人糞便中分離出2株O157H7大腸桿菌,檢出率為0.73%。可見我國與經濟已開發國家一樣,也面臨著O157H7大腸桿菌的威脅,由其引起的食物中毒有隨時發生的可能。
1. 通過食物傳播O157H7大腸桿菌主要是通過污染食物而引起人的感染。O157H7大腸桿菌的致病能力和對胃酸的抵抗力均較強,對細胞的破壞性大。據專家估計100個菌就可使人發病。而1個漢堡包的牛肉餡里可含有1000個細菌,足以使人得病。在世界各地報告的腸出血性大腸桿菌感染爆發中,約有70%以上與進食可疑食物有關。動物來源的食物,如牛肉、雞肉、牛奶、奶製品等是經食物傳播的主要因素,尤其是在動物屠宰過程中這些食物更易受到寄生在動物腸道中的細菌污染。另外,其他食品,如蔬菜、水果等被污染也可造成爆發。
食品污染可發生於生產、加工、包裝、運輸和儲存等各個環節。食物引起傳播的主要原因是加工時間不充分或溫度不夠高。1982年和1993年在美國發生的O157H7大腸桿菌感染性腹瀉的爆發,就是由於食用了某快餐連鎖店的漢堡包引起的。研究證明,漢堡包的牛肉陷被O157H7大腸桿菌污染。英國曾發生一起與食用蔬菜有關的O157H7感染爆發。1991、1993、1996年在美國發生的O157H7感染爆發被證明與食用被污染的蘋果汁和蘋果酒有關。1996年5-8月份在日本發生的世界上最大的一起由O157H7大腸桿菌引起的爆發流行,可疑食物是牛肉和工業化生產的蔬菜。因而很多國家將O157H7大腸桿菌引起的感染性腹瀉歸為食源性疾病。1998年,我國黑龍江省
衛生防疫站首次從市售的熟豬頭肉中分離出EHEC,表明我國也存在由該菌引起食物中毒的危險。
2. 通過水傳播1989年,在美國
密蘇里州發生的一起O157H7大腸桿菌感染爆發,共發病240多人。調查表明,該起爆發可能為水源性,是由於飲用水被污染所致。加強飲用水源的消毒管理後,疫情得到了控制。1989年12月-1990年1月在加拿大某鎮也發生了一起O157H7大腸桿菌感染爆發。在2000多名居民中,發病243人,發病率11.6%。經證實也為水源性爆發。原因為天氣寒冷,供水管道堵塞,導致市政供水系統受污染。除了飲用水受到污染可造成感染外,其他被污染的水體如游泳池、湖水及其他地表水等都可造成傳播。這也進一步說明了O157H7在
外環境中的生存能力較強,引起人類感染可能並不需要在外環境中進行增菌。1991年在美國的
俄勒岡州發生的一起O157H7大腸桿菌感染爆發,懷疑是湖水被糞便污染,感染者在湖水裡游泳時不慎喝了湖水而被感染。對1992年在蘇格蘭發生的一起爆發的
流行病學調查發現,一個患病兒童在一個家庭用的大水盆里玩耍,污染了盆里的水,結果用過同一盆水的兒童都先後發病。鑒於O157H7大腸桿菌可經水傳播,1996年在日本大阪發生O157H7大腸桿菌感染爆發後,有關當局關閉了
大阪市的23個公共游泳池和515所學校的游泳池。
3.密切接觸傳播人與人之間的密切接觸也可引起O157H7大腸桿菌的傳播。一個人感染了O157H7大腸桿菌後,常通過密切接觸的方式把細菌傳染給其父母、子女、兄弟姐妹或其他與之密切接觸的人如老師、朋友、親戚等。在醫院裡,也發生了多起由於護士照料病人而感染了O157H7大腸桿菌的報告,並且得到了病原學上的支持。值得指出的是:在人與人之間的傳播過程中,二代病人症狀往往較輕,很少出現出血性腸炎。可能是由於接觸傳播時感染劑量小或經人傳代後細菌毒力減弱。
在上述三條傳播途徑中,以食物傳播為主。有人對美國自1982年起發生的100多起 O157H7爆發流行的感染途徑進行統計,發現食源性的占71%(52%為牛肉製品,大部分與快餐店中的漢堡包有關;14%為水果、蔬菜;5%來源於未知食品)、16%為人與人接觸感染、12%為水源性感染。
德國已於2011年6月11日查明傳染源為德國豆芽

德國2011年6月的腸出血性大腸桿菌是O104H4和以前發現的腸出血性大腸桿菌並不相同。
易感人群
人群普遍易感,但以老人和兒童為主。而且老人和兒童感染後症狀往往較重,容易並發溶血性尿毒綜合症和
血小板減少性紫癜等併發症。因而嚴重的爆發流行往往容易發生在幼稚園、學校、監獄、敬老院甚至醫院等公共場所。在1996年日本的大流行中,病人大多數為學生。

臨床表現
腸出血性大腸桿菌感染潛伏期1-14天,常見為4-8天。輕者可不出現任何症狀和體徵,或僅出現輕度腹瀉。部分病人有發熱或上感症狀,發熱為自限性,一般1-3天消退。多數患者5-10天內痊癒。重者則可引起出血性腸炎,少數人,尤其是兒童和老人可在病程1-2周出現溶血性尿毒綜合症或
血栓性血小板減少性紫癜等併發症。
1. 出血性腸炎在腸出血性大腸桿菌感染中較為常見。典型表現為右下腹劇烈疼痛、腹瀉,早期可為水樣便,接著表現類似
下消化道出血的鮮血便或鮮血樣便,量中等。常伴低熱或不發熱。病程7~10d,有時可延長達12d。部份患者感染後1周發生溶血性尿毒症征群。乙狀結腸鏡檢查見腸黏膜充血、水腫、腸壁張力低下。鋇灌腸X線檢查可見升結腸、橫結腸黏膜下水腫。其實,早在七十年代,美國、日本、歐洲等地均報導過局部缺血性腸炎的散發病例,但直到1982年才明確了O157H7大腸桿菌感染與出血性腸炎的關係。
2. 腎溶血性尿毒綜合症 (hemolytic-uremic syndrome HUS)溶血性尿毒綜合症是由一系列不同病因、不同病理機製作用引起的多因素疾病。除腸出血性大腸桿菌外,許多細菌和病毒都可引起腎溶血性尿毒綜合症,如痢疾桿菌、
傷寒桿菌、
肺炎鏈球菌、立克次體樣微生物、EB病毒、柯薩奇病毒等。腎溶血性尿毒綜合症的主要表現為急性腎衰、
血小板減少症和微血管異常溶血性貧血。主要臨床症狀和體徵為血尿、少尿、無尿、皮下黏膜出血等。在O157H7大腸桿菌感染的人群中,兒童和老人最易患腎溶血性尿毒綜合症,其造成的病死率可高達10-30%。
3.血栓性
血小板減少性紫癜在臨床特點上與腎溶血性尿毒綜合症很象,但神經系統症狀及發熱更明顯。病情發展迅速,90天內有70%的病人死亡。多數血栓性血小板減少性紫癜患者具有5種症狀,即發熱、血小板減少症、微血管異常溶血性貧血、腎功能異常(血尿、蛋白尿、急性腎衰)和神經系統症狀(頭痛、輕癱、昏迷、間歇性譫妄)。
實驗室檢查
1. 生化反應可採用山梨醇發酵試驗、
葡萄糖醛酸酶試驗、
棉子糖發酵試驗、衛矛醇發酵試驗、鳥氨酸和賴氨酸試驗進行初篩,然後用O157H7抗血清
玻片凝集試驗進行鑑定。
2.
血清學反應主要是檢查腸出血性大腸桿菌菌體抗原O157和鞭毛抗原H7。包括試管凝集、玻片凝集和針對O157抗原而發展起來的一些其他方法。
但用
生化反應和血清學反應均不能診斷非O157血清型的腸出血性大腸桿菌。
3. DNA探針技術目前已根據腸出血性大腸桿菌的
質粒和其致病性有關的假設,發展了特異性的DNA探針。該探針已被國際公認,並在世界上多數實驗室試用,其特異性和敏感性均可達99%以上,成為鑑定腸出血性大腸桿菌菌株的關鍵指標。但由於該方法對技術要求較高,主要用於臨床研究或流行病學調查。
4. PCR技術用於對腸出血性大腸桿菌的DNA序列進行分析。該方法特異、敏感、快速,可在3-4個小時內出結果。
5. 毒素檢測由於腸出血性大腸桿菌可產生志賀樣毒素,其中23%糞便中存在可中和的志賀氏樣毒素(SLT-I或Ⅱ)。因而又發展了檢測患者糞便中的志賀樣毒素和血液中志賀樣毒素抗體的方法。但這種方法需要
細胞培養技術和條件,費時、費力、特異性不高,因而一般不採用該方法。

治療原則
O157H7大腸桿菌可引起出血性腸炎、溶血性尿毒綜合症和血栓性
血小板減少性紫癜等。對出血性腸炎的治療應根據腹瀉病的一般治療原則,即支持療法和適當使用抗生素。飲食宜以流質量少為主,避免在直腸及結腸中有過多糞便。有條件時,抗生素的選擇應根據藥敏試驗結果。
江蘇省疾病預防控制中心對1999年分離到的89株O157H7大腸桿菌進行了藥敏試驗。結果顯示O157H7對氨基糖甙類、頭孢類、喹諾酮類、
呋喃類、多粘菌素B及氯黴素的敏感率較高,可供臨床治療參考。但目前國際上對是否使用抗生素有兩種不同的看法。一種認為應該使用抗生素以殺滅細菌;另一種認為使用抗生素殺傷細菌後,可使
細菌毒素釋放出來,堵塞毛細血管,誘發溶血性尿毒綜合症。而且根據對患者臨床資料的研究發現,出血性腸炎為一種自限性疾病,抗生素的使用並不能夠縮短病程或住院時間,因而不主張使用抗生素。溶血性尿毒綜合症和血栓性
血小板減少性紫癜的治療可採用輸入新鮮血漿、透析療法、血小板減少療法或用肝素、
蛋白酶抑制劑抗凝等,必要時行腎切除與腎移植。
防護措施
1. 開展和健全監測、報告系統腸出血性大腸桿菌感染為一種新發現的食源性傳染病。在我國該病尚未納入法定管理傳染病報告系統。而在美國、英國、日本等許多國家最初採用的也是非法定的報告方式。報告的感染率和發病率不能反映實際情況。後來許多國家使用了統一的診斷和檢驗標準,對病例進行法定報告管理。加拿大最早於1990年開始對腸出血性大腸桿菌感染病例進行依法管理。美國於1993年,日本、
瑞典、德國於1996年開始對腸出血性大腸桿菌感染病例依法進行管理。
歐洲的大腸桿菌監測系統已取代了
沙門氏菌監測系統。美國 CDC食源性疾病監測系統也已開展了對腸出血性大腸桿菌感染的監測。我國於2000年在全國開展了對腸出血性大腸桿菌感染性腹瀉的監測。腸出血性大腸桿菌感染主要是由於食入被污染的家畜、家禽的肉類、奶類及蔬菜、水果等引起,因而要大力加強對這類產品的監測,以便早期發現疫情,了解O157H7大腸桿菌的分布特徵及疾病流行趨勢,評價各項預防措施的實施效果,為制定有效的防制對策提供依據。
2. 加強對食物和水源的管理,避免經食物和水傳播腸出血性大腸桿菌。
大多數的腸出血性大腸桿菌爆發都是由於食物和水源被污染所致。因而要加強對家畜、家禽、肉產品和奶類的管理。要從
食物鏈的每個環節,即從農牧業生產活動、副食品的加工和在工廠及家庭條件下的製備過程採取控制措施。重點應加強對冷凍食品的管理,防止食品被污染,同時要養成良好的生活習慣。飯菜食用前要充分加熱、飯前便後要洗手、避免生食蔬菜、水果要洗淨再吃等。


 血清型為O104型的大腸桿菌
血清型為O104型的大腸桿菌


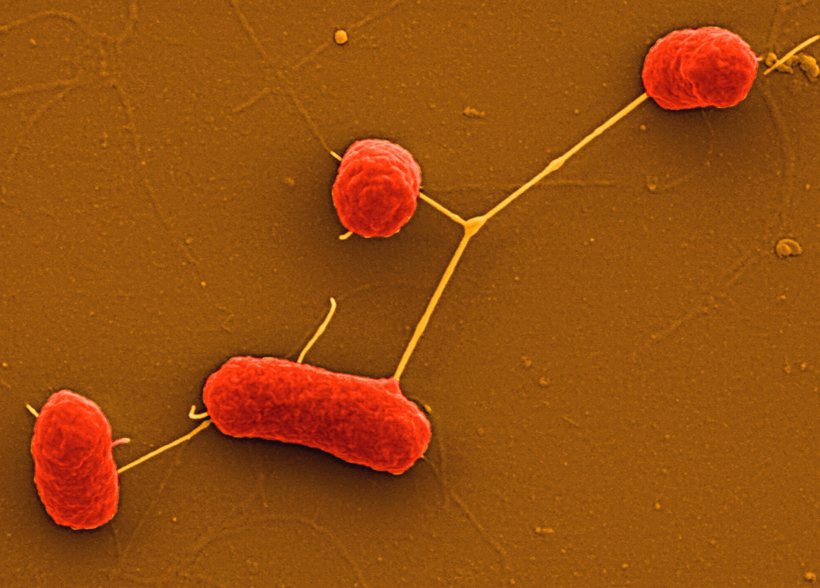


 血清型為O104型的大腸桿菌
血清型為O104型的大腸桿菌


