基本介紹
- 中文名:熱力學自由能
- 外文名:Thermodynamic free energy
簡介
吉布斯自由能和亥姆霍茲自由能
亥姆霍茲自由能





吉布斯自由能

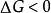
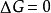








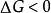
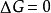


熱力學自由能(英語:Thermodynamic free energy)是指一個熱力學系統的能量中可以用來對外做功的部分,是熱力學態函式。自由能可以作為一個熱力學過程能否自發進行的判據...
自由能是指在某一個熱力學過程中,系統減少的內能中可以轉化為對外做功的部分,它衡量的是:在一個特定的熱力學過程中,系統可對外輸出的“有用能量”。可分為...
吉布斯自由能(Gibbs free energy)在化學熱力學中為判斷過程進行的方向而引入的熱力學函式。又稱自由焓、吉布斯自由能或自由能。自由能指的是在某一個熱力學過程中...
按照國際純粹與套用化學聯合會( IUPAC)的定義,吉布斯自由能或吉布斯函式是焓(H)減去熱力學溫度(T)和熵(S)的乘積,即G=H-TS,常稱為自由能或自由焓。其 SI ...
反應的標準自由能變化△G°是一個重要的熱力學函式,用它可以判斷過程自動進行的方向,生產中可以創造條件使反應沿著預期的方向進行,以達到預期的目的。 [1] ...
熱力學(thermodynamics)是從巨觀角度研究物質的熱運動性質及其規律的學科。屬於物理學的分支,它與統計物理學分別構成了熱學理論的巨觀和微觀兩個方面。熱力學主要是從...
高等工程熱力學中,表示系統基本熱力學關係的微分方程。表征內能、熱力學焓、亥姆霍茲自由能、吉布斯自由能由熱力學的基本微分方程可得:dU=TdS-pdV (1)由H=U+pV...
A 稱為亥姆霍茲自由能(Helmholz free energy),是狀態函式,具有容量性質。 [1] 亥姆霍茨自由能亥姆霍茲自由能的引出原因 編輯 從熱力學第一定律和第二定律,我們...
熱力學函式之一的曲線 含義 分為兩種 研究 微分幾何學研究的主要對象 目錄 1 自由能 2 曲線 自由能曲線自由能 編輯 有兩種含義。英國和美國的冶金及一部分化...
黑姆荷茲自由能是Helmholtz free energy英文的音譯,也譯為亥姆霍茲自由能(在物理學中也常直接簡稱為自由能),是一個重要的熱力學參數,常用F或A表示,它的定義是:F...
常套用的八個熱力學函式--p、V、T、U、H、S、A、G。其中 U 和 S 分別由熱力學第一定律和第二定律導出;H、A、G 則由定義得來。而 U、H、A、G 為...
熱力學分析通常包括三方面的內容:(1)確定過程中工質狀態變化的規律以及相應的狀態參數;(2)確定過程中能量轉換的數量關係;(3)揭示過程中的不可逆程度,反映能量轉換...
熱力學本構方程Helmholtz 自由能或者利用Gibbs自由能來實現的方程,主要套用於形狀記憶聚合物(SMP)的研究。基於不同預應變率下的熱力學實驗結果,通過考慮材料凍結/...
在熱力學里,自由焓,又稱吉布斯自由能、吉布斯函式、吉布斯能,常用英文字母“”標記。吉布斯能是國際化學聯會建議採用的名稱。吉布斯能是描述系統的熱力性質的一種...
亥姆霍茲自由能(Helmholtz free energy,在物理學中也常直接簡稱為自由能),是一個重要的熱力學參數,常用 F 表示(或 A )。...
其實在化學、熱力學和統計物理中都可以有不同的理解,用純粹的物理化學角度來理解會很抽象。我們可以把部分莫耳自由能看作一種類似溫度的強度物理量,溫度是能量關於...
《分子物理與熱力學》是2006年科學出版社出版的圖書,作者是成元發。...... 《分子物理與熱力學》根據現行教學大綱編寫而成,對分子物理學與熱力學的基本概念、基本...
熱力學定律指出,在等壓條件下,一切自發過程都是朝著系統自由能(即能夠對外做功的那部分能量)降低的方向進行。同一物質的液體和晶體自由能隨溫度變化曲線如圖所示。...
《熱力學·統計物理》是2008年北京藍色暢想圖書發行有限公司(原高等教育出版社)出版的圖書,作者是汪志誠。...
核熱力學可用來研究凹形微結構在汽相沉積過程中點狀結構的生長速率。凹結構內的穩定原子團生長速率遠遠大於平面處穩定原子團的生長速率。因此,與平面相比,凹結構內...
剩餘性質就是實際物系與同溫同壓(同組成,對於混合物)的理想氣體(混合物)某熱力學性質的差。...
《水文地球化學熱力學》是1993年原子能出版社出版的圖書,作者是李寬良。...... 《水文地球化學熱力學》是1993年原子能出版社出版的圖書,作者是李寬良。...
也稱巨觀生物力能學,它廣泛套用了物理學中的熱力學理論,首先是經典熱力學的基本定律,並用熱力學參數來表達數量關係。例如,從葡萄糖和果糖合成蔗糖是一個ATP(腺苷...
《新概念熱力學》是2010年5月1日華東理工大學出版社出版的圖書,作者是德國作家久保。本書介紹了作者多年來在熱力學研究上取得的實際套用成果。...
《無機化學熱力學》是2010年科學出版社出版的圖書,作者是唐宗薰。...... 全書共7章,分別介紹無機化學熱力學的基本知識...自由能-溫度圖、自由能-氧化態圖、電勢-p...
此後,為了在各種不同條件下討論系統狀態的熱力學特性,又引進了一些輔助的狀態函式,如焓、亥姆霍茲函式(自由能)、吉布斯函式等。這會帶來運算上的方便,並增加對熱力...
