高等工程熱力學中,表示系統基本熱力學關係的微分方程。表征內能、熱力學焓、亥姆霍茲自由能、吉布斯自由能
由熱力學的基本微分方程可得:dU=TdS-pdV (1)
由H=U+pV可得:dH=TdS+Vdp (2)
由F=U-TS可得:dF=-SdT-pdV (3)
由G=F+pV可得:dG=-SdT+Vdp (4)
基本介紹
- 中文名:熱力學函式的全微分
- 外文名:Complete differentials of Thermodynamic Functions
- 套用學科:熱力學、統計物理、工程熱力學
- 適用領域範圍:換熱計算、強化傳熱、流體傳熱
正文
式中為內能;為焓;為亥姆霍茲函式;為吉布斯函式;為熵;為熱力學溫度;為體積;為壓力。這一組關係式就稱為封閉系統的熱力學函式基本關係式。式(1)~(4)只適用於內部平衡且不做非體積功的封閉系統。
利用上述基本關係式的積分,可以求得一個封閉系統經歷一個任意可逆過程後狀態函式的變化。對於只由兩個獨立變數便可描述的封閉系統(即沒有不可逆的化學變化和相變化的封閉系統),上述基本關係式實際上可看作狀態函式、、和的全微分表達式。無論過程是否可逆,它們的積分都存在,且只由系統的始、終態決定。因此,對這樣的系統,不可逆過程的狀態函式的變化,也可由上述基本關係式積分求得。
利用封閉系統的熱力學基本關係式,還可以推導出許多重要的關係式。例如,從式(1)~(4)可導出:
利用數學上的全微分性質,還可由式(1)~(4)導出:
式(9)~(12)稱為麥克斯韋關係式組。利用此關係式,可把一些實驗上難以測量的量〔如(д/д)〕轉化為易於測量的量〔如(д/д)〕。
利用麥克斯韋關係式,可從式(1)和(2)導出:
式(13)、(14)描述了系統的內能和焓隨系統的體積和壓力的變化關係,通常稱為熱力學狀態方程。
對化學組成可變的均相系統,式(1)~(4)可改寫為:
式(15)~(18)稱為開放系統的熱力學函式基本關係式。式中為系統中物質B的化學勢;d為物質B的物質的量的微小變化值。
如果系統在變化過程中除體積功和化學功外還有其他功(如電、磁、表面功等),則熱力學函式基本關係式的形式為
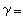 熱力學函式基本關係式
熱力學函式基本關係式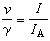 熱力學函式基本關係式
熱力學函式基本關係式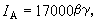 熱力學函式基本關係式
熱力學函式基本關係式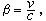 熱力學函式基本關係式
熱力學函式基本關係式式中′為除體積功以外的其他功。
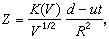 熱力學函式基本關係式
熱力學函式基本關係式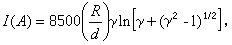 熱力學函式基本關係式
熱力學函式基本關係式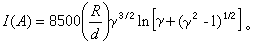 熱力學函式基本關係式
熱力學函式基本關係式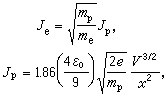 熱力學函式基本關係式
熱力學函式基本關係式
