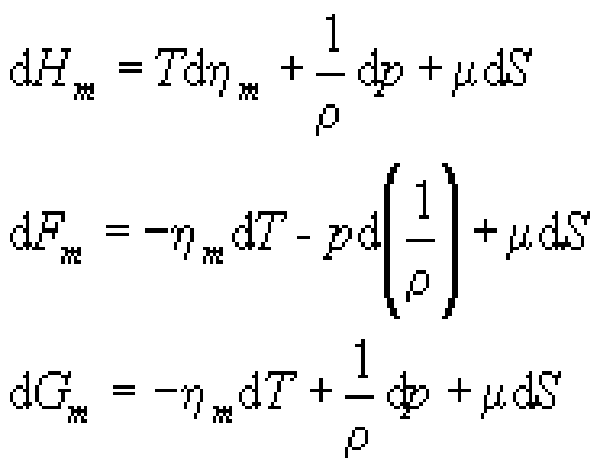海水熱力學特徵量之間的相互關係。它是研究海水平衡熱力學的基礎。若把質量為 m的海水看作平衡的熱力學系統,則此系統的熱力學關係可通過一些基本的熱力學函式(態函式)和熱力學參數加以描述。
基本介紹
- 中文名:海水熱力學基本關係
- 外文名:Basic relationship of seawater thermodynamics
- 簡介:海水熱力學特徵量之間的相互關係
- 熱力學函式:內能、熵、焓、自由能和化學勢等
- 關係式:J=4.186×107爾格/卡
海水熱力學基本關係,
海水熱力學基本關係
熱力學函式 包括內能、熵、焓、自由能和化學勢等。
系統內部所具有的總能量,稱為該系統的內能 (U)。在非絕熱過程中,外界對系統作功(W),或者系統從外界吸收熱量(Q),都會使系統的內能增加。內能的增量△U服從
△U=W+Q
在準靜態過程(過程的變化速度趨於0)中,壓力(p)對可壓縮流體所作的功與流體體積 (V)的改變數(dV)的關係為:W=-pdV。於是上式可改寫為微分形式
dU=dQ-pdV
以上各式描述了系統能量的轉化和守恆的定律,即熱力學第一定律。
在一個任意可逆循環過程中,系統內的熱量改變(dQ)與其熱力學溫度(T)的關係為引入一個態函式η,即 其中η稱為熵;η0為熵的初值。在絕熱過程中,系統內的熱量不變,dQ=0,則η=η0。它表示在一個可逆循環過程中,系統的熵不變。這是熵的一個重要特性。但是在海水中,一切與熱現象有關的實際巨觀過程都是不可逆的。將上式寫成微分的形式 所以Tdη=dU+pdV這就是熱力學第二定律的微分方程式。
在研究熱力學問題時,還引進一些與U,η,p,V,T相互有關的熱力學函式,這些函式定義為
H=U+pV
F=U-Tη
G=U+pV-Tη
H、F和G分別稱為焓、亥姆霍茲自由能和吉布斯自由能。
熱力學問題通常是以研究單位質量的系統為對象的,為此引進一些比值,例如比內能、比熵等,於是,上述表達式分別改寫為 其中ρ為海水的密度。比內能、比熵、比焓、比亥姆霍茲自由能和比吉布斯自由能等,都是熱力學的基本函式。
海水是含有多種物質的水溶液。由於海水的鹽分組成幾乎為常數,可以把海水看作是比例一定的兩種成分──純水和鹽分的混合物,故稱海水為雙組分的熱力學平衡系統,並可近似地用鹽度S代替含鹽量。在雙組分系統中,其內能的改變也和系統內的化學組成的變化有關。對於單位質量的雙組分系統,這種關係的微分形式為 式中μ是描述系統化學特徵的係數,是鹽分和純水在海水中的化學勢之差,簡稱化學勢。上式稱為海水熱力學的基本方程。相應的熱力學關係式為 許多熱力學問題都是根據基本方程和這些關係式展開的。
海水熱力學參數 定義列於表中(pa為海面大氣壓力)。 這些熱力學參數除聲速外都反映了海水熱性質,並可根據實驗資料估算出來。因為在海洋里測量溫度、壓力和鹽度比較容易,所以選擇它們作為獨立變數。
聲波在海水中傳播的速度和海水的壓縮率有關。由於水中壓縮與稀疏的頻率很大,熱量來不及通過熱傳導和輻射耗散出去,所以聲波在海水中的傳播過程是絕熱過程(見海洋聲學)。由於聲速可以準確地直接測量,因此常以聲速的量來檢驗一些其他的熱力學參數計算值的準確性。
根據熱力學基本方程和熱力學參數的定義,可以導出下列關係式 式中J=4.186×107爾格/卡,為熱功當量。這些關係式反映了海水熱力學特徵量之間的相互關係。
系統內部所具有的總能量,稱為該系統的內能 (U)。在非絕熱過程中,外界對系統作功(W),或者系統從外界吸收熱量(Q),都會使系統的內能增加。內能的增量△U服從
△U=W+Q
在準靜態過程(過程的變化速度趨於0)中,壓力(p)對可壓縮流體所作的功與流體體積 (V)的改變數(dV)的關係為:W=-pdV。於是上式可改寫為微分形式
dU=dQ-pdV
以上各式描述了系統能量的轉化和守恆的定律,即熱力學第一定律。
在一個任意可逆循環過程中,系統內的熱量改變(dQ)與其熱力學溫度(T)的關係為引入一個態函式η,即 其中η稱為熵;η0為熵的初值。在絕熱過程中,系統內的熱量不變,dQ=0,則η=η0。它表示在一個可逆循環過程中,系統的熵不變。這是熵的一個重要特性。但是在海水中,一切與熱現象有關的實際巨觀過程都是不可逆的。將上式寫成微分的形式 所以Tdη=dU+pdV這就是熱力學第二定律的微分方程式。
在研究熱力學問題時,還引進一些與U,η,p,V,T相互有關的熱力學函式,這些函式定義為
H=U+pV
F=U-Tη
G=U+pV-Tη
H、F和G分別稱為焓、亥姆霍茲自由能和吉布斯自由能。
熱力學問題通常是以研究單位質量的系統為對象的,為此引進一些比值,例如比內能、比熵等,於是,上述表達式分別改寫為 其中ρ為海水的密度。比內能、比熵、比焓、比亥姆霍茲自由能和比吉布斯自由能等,都是熱力學的基本函式。
海水是含有多種物質的水溶液。由於海水的鹽分組成幾乎為常數,可以把海水看作是比例一定的兩種成分──純水和鹽分的混合物,故稱海水為雙組分的熱力學平衡系統,並可近似地用鹽度S代替含鹽量。在雙組分系統中,其內能的改變也和系統內的化學組成的變化有關。對於單位質量的雙組分系統,這種關係的微分形式為 式中μ是描述系統化學特徵的係數,是鹽分和純水在海水中的化學勢之差,簡稱化學勢。上式稱為海水熱力學的基本方程。相應的熱力學關係式為 許多熱力學問題都是根據基本方程和這些關係式展開的。
海水熱力學參數 定義列於表中(pa為海面大氣壓力)。 這些熱力學參數除聲速外都反映了海水熱性質,並可根據實驗資料估算出來。因為在海洋里測量溫度、壓力和鹽度比較容易,所以選擇它們作為獨立變數。
聲波在海水中傳播的速度和海水的壓縮率有關。由於水中壓縮與稀疏的頻率很大,熱量來不及通過熱傳導和輻射耗散出去,所以聲波在海水中的傳播過程是絕熱過程(見海洋聲學)。由於聲速可以準確地直接測量,因此常以聲速的量來檢驗一些其他的熱力學參數計算值的準確性。
根據熱力學基本方程和熱力學參數的定義,可以導出下列關係式 式中J=4.186×107爾格/卡,為熱功當量。這些關係式反映了海水熱力學特徵量之間的相互關係。