亥姆霍茲(von Helmholz, H.L.P.,1821~1894,德國人)定義了一個狀態函式:A=U-TS。A 稱為亥姆霍茲自由能(Helmholz free energy),是狀態函式,具有容量性質。
基本介紹
- 中文名:亥姆霍茨自由能
- 外文名:Helmholz free energy
- 領域:熱力學
- 屬性:狀態函式
- 提出者:亥姆霍茲
簡介,亥姆霍茲自由能的引出原因,亥姆霍茲自由能和亥姆霍茲自由能判據,亥姆霍茲自由能和吉布斯自由能的區別,
簡介
亥姆霍茲(von Helmholz, H.L.P.,1821~1894,德國人)定義了一個狀態函式:A=U-TS。A 稱為亥姆霍茲自由能(Helmholz free energy),是狀態函式,具有容量性質。
亥姆霍茲自由能的引出原因
從熱力學第一定律和第二定律,我們分別得到了兩個狀態函式----內能和熵,為便於處理熱化學問題,定義了輔助狀態函式----焓。並得到了熵判據: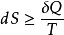 。
。
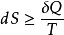
但用熵判據判斷過程的方向時,必須是隔離體系,或者是考慮環境的封閉體系,這很不方便。因此,有必要引入新的函式,利用體系自身的某種變化值判斷其自發變化的方向,而不用考慮環境。為此亥姆霍茲和吉布斯分別定義了兩個新的函式,這兩個函式和焓一樣,都是人為定義的輔助函式,不是熱力學定律的直接結果,但它們都是體系自身的性質,是狀態函式。
結合第一定律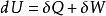 和第二定律
和第二定律 ,得
,得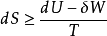 ,因T>0,故有:
,因T>0,故有: ,該式在不同的條件下,有不同的表現形式。
,該式在不同的條件下,有不同的表現形式。
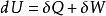

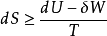

亥姆霍茲自由能和亥姆霍茲自由能判據
亥姆霍茲自由能:
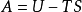
或





或 。
。

即:等溫、可逆過程中,體系對外所作的最大功等於體系亥姆霍茲自由能的減少值,所以把 A 稱為功函(work function)。若是不可逆過程,體系所作的功小於A 的減少值 。
。

如體系在等溫、等容且不作其它功的條件下

或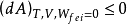 。
。
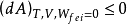
等號表示可逆過程,不等號表示是一個自發的不可逆過程,即自發變化總是朝著亥姆霍茲自由能減少的方向進行。這就是亥姆霍茲自由能判據。
此式的意義是:在等溫可逆過程中,封閉體系的亥姆霍茲自由能的減少等於體系對外所得做的最大功(含體積功和非體積功)。故亥姆霍茲自由能可視為等溫條件下體系作功的本領。這是該函式被稱為功焓的原因。若過程不可逆,則體系亥姆霍茲自由能的增加小於體系所獲得的功。因而,可用該式來判斷過程的方向性。
若體系經歷一個等溫等容過程,則:

即: 。這說明在等溫等容過程中,體系亥姆霍茲函式的增加小於等於體系所獲得的非體積功,或體系亥姆霍茲函式的減少大於等於體系對外所做的非體積功(
。這說明在等溫等容過程中,體系亥姆霍茲函式的增加小於等於體系所獲得的非體積功,或體系亥姆霍茲函式的減少大於等於體系對外所做的非體積功( )。
)。


若體系在等溫等容且不做其它功的情況下,則: 。這就是亥姆霍茲自由能判據。
。這就是亥姆霍茲自由能判據。

亥姆霍茲自由能和吉布斯自由能的區別
(1)亥姆霍茲自由能(Helmholtz free energy):F=U-TS
U 是系統的內能,T 是溫度,S 是熵。
吉布斯自由能(Gibbs free energy):G=H-TS
H為焓,S為熵,T為當前溫度。
由於吉布斯自由能 G 可以表示為 G = F + pV,另有G = μN,所以F = μN – pV;
(2)亥姆霍茲自由能的微分形式是:dF = - SdT -PdV + μdN,其中 P 是壓強,V 是體積,μ是化學勢,在統計物理學中,亥姆霍茲自由能是一個最常用的自由能,因為它和配分函式Z直接關聯:F = -kTlnZ
吉布斯自由能的微分形式是:dG = − SdT + Vdp + μdN,其中μ是化學勢,也就是說每個粒子的平均吉布斯自由能等於化學勢;ΔG叫做吉布斯自由能變(吉布斯自由能判據)。吉布斯自由能的變化可作為恆溫、恆壓過程自發與平衡的判據。吉布斯自由能改變數。表明狀態函式G是體系所具有的在等溫等壓下做非體積功的能力。反應過程中G的減少量是體系做非體積功的最大限度。這個最大限度在可逆途徑得到實現。
(3)反應進行方向和方式判據。(功函判據)
亥姆霍茲函式是一個重要的熱力學參數,等於內能減去絕對溫度和熵的乘積:兩個狀態差值的負數等於一個可逆等溫等容過程的最大功輸出。
亥姆霍茲自由能是等溫下做所有功的能力,亦稱功函。
吉布斯自由能是等溫等壓下除體積功以外的功的能力。
