基本介紹
- 中文名:熔點
- 外文名:melting point
- 定義:純物質固態和液態呈平衡時的溫度
- 縮寫:m.p.
- 詞性:名詞
- 所屬學科:物理學
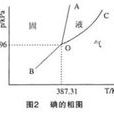
物理原理
理論發展
測定方法
比較規律
二、不同類型晶體的比較規律
一般來說,不同類型晶體的熔、沸點的高低順序為:原子晶體>離子晶體>分子晶體,而金屬晶體的熔、沸點有高有低。這是由於不同類型晶體的微粒間作用不同,其熔、沸點也不相同。原子晶體間靠共價鍵結合,一般熔、沸點最高;離子晶體陰、陽離子間靠離子鍵結合,一般熔、沸點較高;分子晶體分子間靠范德華力結合,一般熔、沸點較低;金屬晶體中金屬鍵的鍵能有大有小,因而金屬晶體熔、沸點有高有低。
例如:金剛石>食鹽>乾冰
三、同種類型晶體的比較規律
⒈原子晶體:熔、沸點的高低,取決於共價鍵的鍵長和鍵能,鍵長越短,鍵能越大,熔沸點越高。
例如:晶體矽、金剛石和碳化矽三種晶體中,因鍵長C—C<C—Si< Si—Si,所以熔沸點高低為:金剛石>碳化矽>晶體矽。
⒉離子晶體:熔、沸點的高低,取決於離子鍵的強弱。一般來說,離子半徑越小,離子所帶電荷越多,離子鍵就越強,熔、沸點就越高。
例如:MgO>CaO,NaF>NaCl>NaBr>NaI。
⒊分子晶體:熔、沸點的高低,取決於分子間作用力的大小。一般來說,組成和結構相似的物質,其分子量越大,分子間作用力越強,熔沸點就越高。
例如:F2<Cl2<Br2;CCl4<CBr4<CI4。
⒋金屬晶體:熔、沸點的高低,取決於金屬鍵的強弱。一般來說,金屬離子半徑越小,自由電子數目越多,其金屬鍵越強,金屬熔沸點就越高。
例如:Na<Mg<Al,Li>Na>K。
熔點表
各種元素熔點
6 | 碳(石墨) | 3652 |
6 | 碳(金剛石) | 3550 |
74 | 鎢 | 3410±20 |
75 | 錸 | 3180 |
76 | 3045 | |
73 | 鉭 | 2996 |
41 | 2468 | |
77 | 銥 | 2410 |
78 | 1772 | |
26 | 1535 | |
27 | 鈷 | 1495 |
28 | 鎳 | 1453 |
14 | 矽 | 1410 |
4 | 1278 | |
25 | 錳 | 1244±3 |
29 | 銅 | 1083.4 |
79 | 金 | 1064 |
47 | 銀 | 961.78 |
20 | 鈣 | 839±2 |
13 | 660.37 | |
12 | 鎂 | 648.9 |
30 | 鋅 | 419.5 |
82 | 鉛 | 327.502 |
15 | 紅磷 | 280 |
50 | 231.87 | |
3 | 180.54 | |
53 | 碘 | 113.5 |
16 | 硫 | 112 |
11 | 鈉 | 97.81 |
19 | 鉀 | 63.25 |
15 | 白磷 | 40 |
37 | 38.89 | |
31 | 鎵 | 29.8 |
55 | 28.44 | |
35 | 固態溴 | -7.2 |
80 | 固態水銀(汞) | -38.87 |
86 | 固態氡 | -71 |
17 | 固態氯 | -101 |
54 | 固態氙 | -111.9 |
36 | 固態氪 | -156.6 |
18 | 固態氬 | -189.2 |
7 | 固態氮 | -210.00 |
8 | -218.4 | |
9 | 固態氟 | -219.62 |
10 | 固態氖 | -248.67 |
1 | -259.125 |