簡介
凝固特點
達到一定溫度才開始凝固;
凝固時溫度保持不變;
凝固時固液並存;
非晶體凝固特點:
凝固時溫度持續下降;
凝固時放熱。
凝固圖像
凝固圖像清楚地說明了晶體與非晶體的凝固狀態,以及各個時間段的凝固性質。
物質的凝固點
金剛石:3550
鎢:3410
純
鐵:1535
各種鋼:1300~1400
各種鑄鐵:1200左右
銅:1083
金:1064
銀:962
鋁:660
鎂:648.8
硫:112
鈉:97.8
溴:-7.2
氨:-77.7
氯:-101
酒精:-117
氮:-210
氧:-218
氫:-259
從上可以得出:凝固點指的是一個溫度,在這個溫度時,液體會逐漸變成固體。各種
液體的凝固點是不一樣的。
例題:凝固點高是什麼意思,是溫度高還是溫度低?
解析:凝固點高是一個相對概念,一個物體的凝固點相對於另一個物體的凝固點高,那就說明這個物體凝固的時候比另一個物體凝固的時候對溫度的要求低一些,也就是說,在一個比較高的溫度就能凝固了。 所以說,凝固點高就是相對來說溫度高。
凝固點和熔點的區別
熔點是指晶體由固態轉為液態的
臨界溫度,凝固點是晶體由
液態變成
固態的臨界溫度。所以,這兩個點都是晶體在統一臨界狀態下的溫度。同一種物質的熔點和凝固點是同一個溫度,只不過是考慮的物態變化方向不同,從而叫出了不同的名字,當物質從固態變化為液態時,叫熔點;當物質從液態變化為固態時,這個溫度叫凝固點。
凝固點(熔點)改變的因素
壓強
平時所說的物質的熔點(凝固點,下同),通常是指一個
大氣壓時的情況;如果壓強變化,熔點也要發生變化。熔點隨
壓強的變化有兩種不同的情況。對於大多數物質,熔化過程是體積變大的過程,當壓強增大時,這些物質的熔點要升高;對於像水這樣的物質,與大多數物質不同,冰熔化成水的過程體積要縮小 (金屬
鉍、
銻等也是如此) ,當壓強增大時凍的熔點要降低。
溶有雜質
如果液體中溶有少量其他物質,或稱為
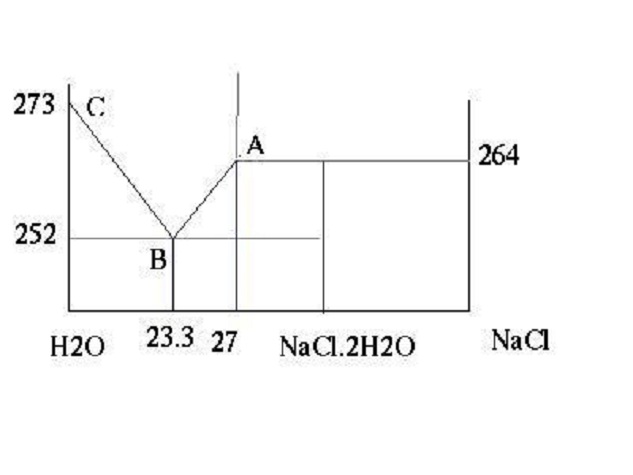
雜質,即使數量很少,物質的熔點(凝固點,下同)也會有很大的變化。例如水中溶有鹽,熔點(固液兩相共存並平衡的溫度)就會明顯下降,海水就是溶有鹽的水,海水冬天結凍的溫度比河水低,就是這個原因。
飽和食鹽水的熔點可下降到約-22℃。
例題:為了分離
酒精和
水的混合物,張小同學依據已學過的知識,提出一種方案:依據水和酒精凝固點不同可將水和酒精分開。為此,他利用家中的電冰櫃的冷凍室做了如下實驗:他將配有不同比例的水和酒精的混合物放入冷凍室中,並用溫度計
監測混合液的溫度,定時觀察,他所測數據和觀察到的現象如下表:
V酒精/mL | V水/mL | V酒精/V水 | 觀察現象 |
12.5 | 12.5 | 1/2 | -8℃未發現凝固 |
12.5 | 30 | 1/4 | -8℃未發現凝固 |
12.5 | 75 | 1/6 | -8℃混合液開始凝固 |
12.5 | 370 | ≈1/30 | -6℃混合液開始凝固,酒精並未從水中分離出來 |
12.5 | 750 | ≈1/60 | -4℃混合液開始凝固,酒精並未從水中分離出來 |
(1)請你仔細看一看錶中的數據和記錄的現象,張小同學是否能將水和酒精從混合液中分開?
(2)在水中添加酒精對水的凝固點有何影響?
解析:
(1)從實驗表格的最後一列可以看出,水和酒精剛開始沒有凝固,而當體積比達到一定值時,混合液可以凝固,但是並沒有將水和酒精分離開,所以用張小同學的方案不能將水和酒精從混合液中分開。
(2)通常情況下水的凝固點是0℃,從表格的最後一列不難看出,在水中添加酒精後,凝固點低於0℃,所以添加酒精後會導致水的凝固點降低。
故答案為:(1)不能;(2)水的凝固點會變低。
所以,溶有雜質是影響凝固點的重要因素。反過來講,凝固點(熔點)有時也可以進行雜質分離。