烏帕替尼緩釋片是艾伯維開發的一種選擇性JAK抑制劑,2022年2月國家藥品監督管理局批准,用於對其他系統治療(如激素或生物製劑)應答不佳或不適宜上述治療的成人和12歲及以上青少年的難治性、中重度特應性皮炎患者。烏帕替尼緩釋片的上市,為特應性皮炎患者的治療提供了更多選擇。2022年3月國家藥品監督管理局批准,用於治療對一種或多種TNF抑制劑應答不佳或不耐受的中度至重度活動性類風濕關節炎成人患者和對一種或多種DMARDs療效不佳或不耐受的活動性銀屑病關節炎(PsA)成人患者。烏帕替尼緩釋片成為治療PsA首個在中國獲批的靶向療法,開啟了中國PsA的靶向治療新時代。2023年2月20日,烏帕替尼緩釋片獲國家藥監局批准用於治療對一種或多種TNF抑制劑應答不佳或不耐受或禁忌的中度至重度活動性潰瘍性結腸炎成人患者,成為繼特應性皮炎、銀屑病關節炎、類風濕關節炎後在華獲批的四個適應症,也是該藥物在中國胃腸病學領域首個獲批的適應症。
通過阻斷 JAK-STAT 信號通路中 Janus 激酶的活性起作用,JAK-STAT 信號通路是一種細胞內通路,在促炎細胞因子的釋放中起主要作用,這些細胞因子刺激類風濕關節炎、銀屑病關節炎和特應性皮炎的炎症。
基本介紹
- 藥品名稱:烏帕替尼緩釋片
- 商品名稱:瑞福
- 商品名英文名:RINVOQ
- 主要成分:烏帕替尼
成分,適應症,用法用量,規格,藥理作用,臨床試驗,特殊人群用藥,獲批歷史,劑型,醫保信息,研發計畫,包裝規格,批准文號,上市許可持有人,
成分
本品主要成分為烏帕替尼。
化學名稱:(3S ,4R )-3-Ethyl-4-(3H -imidazo[1,2- a ]pyrrolo[2,3- e ]pyrazin-8-yl)- N - (2,2,2-三氟乙基)吡咯烷-1-甲醯胺水合物 (2:1)。分子式為C17H19F3N6O •½ H2O
適應症
特應性皮炎
本品適用於對其他系統治療(如激素或生物製劑)應答不佳或不適宜上述治療的成人和12歲及以上青少年的難治性、中重度特應性皮炎患者。
類風濕關節炎
本品適用於對一種或多種TNF抑制劑應答不佳或不耐受的中度至重度活動性類風濕關節炎成人患者。
銀屑病關節炎
本品適用於對一種或多種改善病情抗風濕藥(DMARD)應答不佳或不耐受的活動性銀屑病關節炎成人患者。
潰瘍性結腸炎
本品適用於對一種或多種TNF抑制劑應答不佳或不耐受或禁忌的中度至重度活動性潰瘍性結腸炎成人患者。
用法用量
特應性皮炎
對於12歲及以上且體重≥40kg的兒童和不超過65歲的成人:
起始劑量為15mg每日一次。如果應答不佳,考慮將劑量增加至30mg每日一次。如果30mg未達到充分應答,則停用本品。應使用所需的最低有效劑量以維持應答。
65 歲及以上的成年人推薦劑量為 15 mg每日一次。
年齡≥75歲患者的數據有限。
推薦劑量為 15 mg每天一次。
銀屑病關節炎
推薦劑量為 15 mg每天一次。
規格
按C17H19F3N6O計(1)15mg(2)30mg
藥理作用
烏帕替尼是一種Janus激酶(JAK)抑制劑。JAK是細胞內酶,可傳遞細胞膜上的細胞因子或生成因子受體相互作用產生的信號,從而影響血細胞生成的細胞過程和免疫細胞功能。在此信號轉導通路中,JAK磷酸化並激活信號轉導與轉錄活化因子(STAT),STAT調節細胞內基因表達等活動。烏帕替尼在JAK位點調節此信號傳導通路,阻滯STAT的磷酸化和活化。
JAK酶通過自身的配對(如JAK1/JAK2、JAK1/JAK3、JAK1/TYK2、JAK2/JAK2、JAK2/TYK2)傳遞細胞因子信號。在不含細胞的分離酶活性測定中,烏帕替尼對JAK1和JAK2的抑制作用高於對JAK3和TYK2的抑制作用。在人白細胞中開展的細胞測定中,烏帕替尼對JAK1和JAK1/JAK3介導的細胞因子誘導的STAT磷酸化的抑制作用比對JAK2/JAK2介導的STAT磷酸化的抑制作用更強。但是,目前尚不清楚這種特異性JAK酶抑制作用與治療效果的相關性。
臨床試驗
特應性皮炎
在“頭對頭”III期Heads Up研究中:烏帕替尼與度普利尤單抗相比在主要終點和全部次要終點方面均表現出療效優勢。與度普利尤單抗相比,烏帕替尼起效更快,患者在治療1周內瘙癢減輕、2周后皮損清除改善、治療16周后有更高比例的患者實現高水平的皮損清除。
Measure Up 1 和 Measure Up 2:評估烏帕替尼與安慰劑相比治療中度至重度重度患者的療效和安全性。第 16 周,兩項研究均達到了共同主要終點(所有 p<0.0001): EASI-75 的患者比例在烏帕替尼 15 mg(281 名患者中的 196 名 [70%])和 烏帕替尼 30 mg(285 名患者中的 227 [80%])組中顯著高於安慰劑組(281 名患者中的 46 名 [16%]); vIGA-AD 反應的患者比例在烏帕替尼 15 mg(135 [48%] 患者)和烏帕替尼 30 mg(177 [62%] 患者)組顯著高於安慰劑組(24 [8%] 患者)。研究數據證明: 單藥治療可能是一種有效的治療選擇,並且在患有中度至重度特應性皮炎的青少年和成人中具有積極的獲益-風險特徵。
AD Up:評估烏帕替尼加外用糖皮質激素與安慰劑相比治療中度至重度特應性皮炎的療效和安全性。第 16 周,達到 EASI-75 的患者比例在烏帕替尼 15 mg 加局部外用糖皮質激素組(300 名患者中的 194 [65%] 名)和 烏帕替尼 30 mg 加局部外用糖皮質激素組(229 [77%] 297 名患者)優於安慰劑組(304 名患者中的 80 名 [26%];vIGA-AD 反應的患者比例在烏帕替尼 15 mg 加局部外用糖皮質激素組(119 [40%] 例患者)和烏帕替尼 30 mg 加局部外用糖皮質激素組(174 [59%] 例患者)中顯著更高) 比安慰劑組(33 名 [11%] 患者。研究數據證明:烏帕替尼加外用糖皮質激素的耐受性良好,優於安慰劑加外用糖皮質激素。烏帕替尼作為聯合療法在患有中度至重度特應性皮炎的成人和青少年中具有積極的獲益-風險特徵。
類風濕關節炎
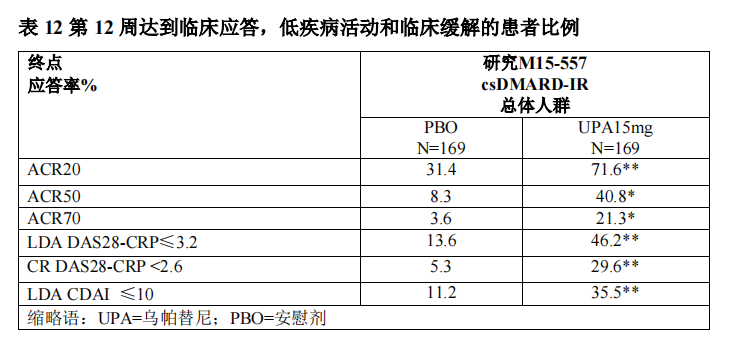
M15-557:是一項在 338 例來自中國、韓國和巴西的 csDMARDs 應答不佳的中度至重度活動性類風濕關節炎患者中進行的 64 周臨床研究。患者在背景csDMARDs 基礎上接受每日一次本品 15mg 或安慰劑治療。完成 12 周訪視(研究第 1 階段)的患者將進入 52 周開放標籤的擴展研究(研究第 2 階段),接受每日一次本品 15mg。
接受本品 15mg 患者與安慰劑組相比在第 12 周時 DAS28-CRP 較基線的變化(總體人群:-2.56 vs -0.95, p<0.001),顯示出更大的疾病活動度的改善。
總體達到ACR20,ACR50和 ACR70 應答,以及 DAS28-CRP ≤ 3.2,DAS28- CRP < 2.6 和 CDAI≤10 的比例見表 12。
臨床試驗
HAQ-DI 結果顯示,12 周時接受本品 15mg 的治療組相比於安慰劑組獲得更顯著的軀體功能改善(總體人群:-0.62 vs -0.18, p<0.001),並且患者在 PCS 評分、MCS 評分以及 SF-36 的所有 8 個領域中均得到更大的較基線的改善。在研究的前 12 周(第 1 階段)本品 15mg 在改善疾病症狀和體徵方面明顯優於安慰劑,與全球 csDMARD-IR 臨床研究(RA-III)的療效結果一致。
研究第 2 階段的療效評價指標包括 ACR20/50/70,單個 ACR 組分,DAS28- CRP, 和 CDAI。最初隨機分配至本品治療組並在第 2 階段繼續接受本品的患者在 64 周治療期間療效持續改善或維持。第 12 周時由安慰劑轉為本品治療的患者在轉換治療後的首次或第二次訪視時,症狀和體徵、疾病活動、軀體功能和健康相關生活質量均有迅速改善。
中國亞組的研究結果與總體人群一致。
銀屑病關節炎
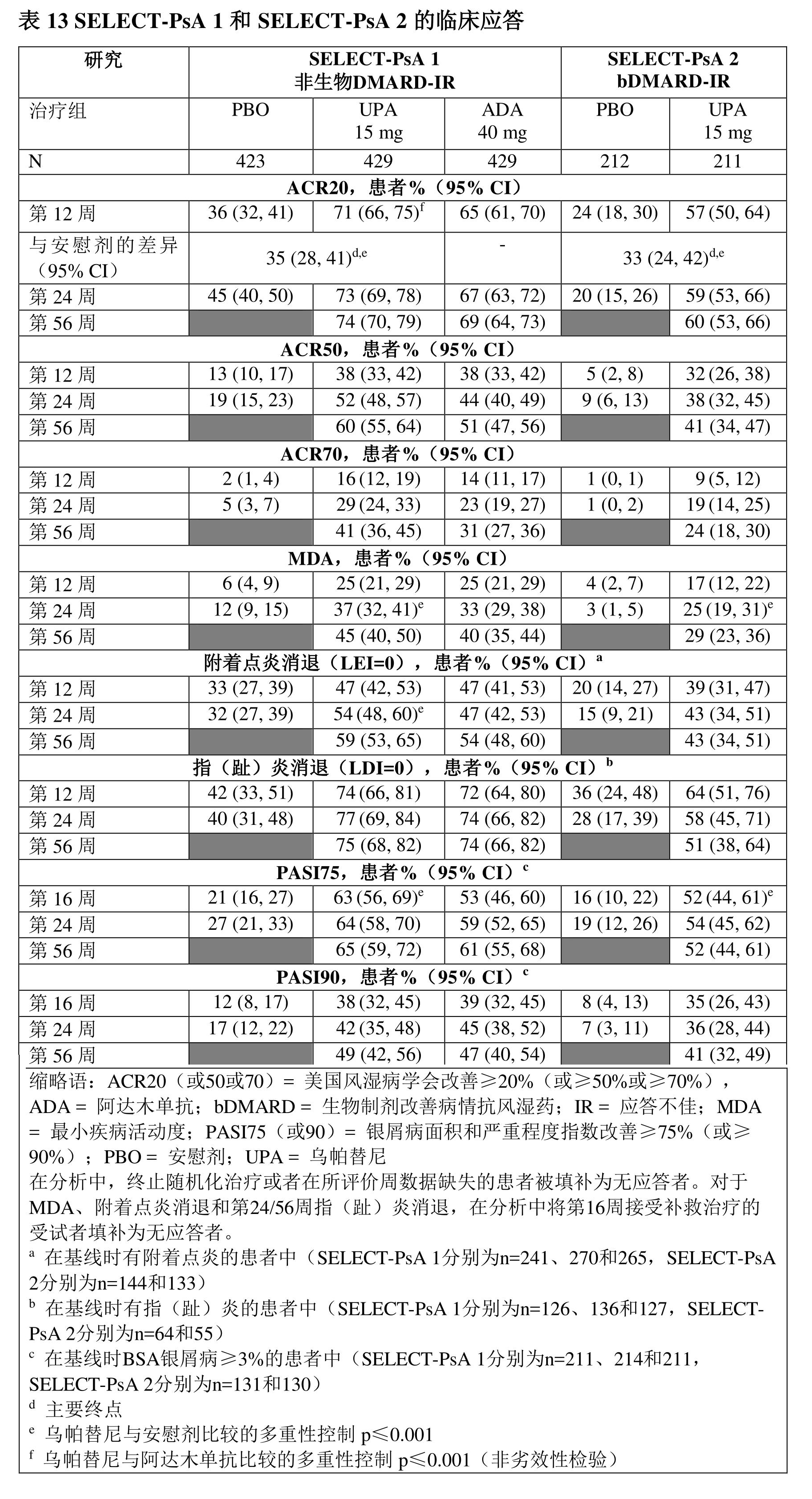
SELECT-PsA 1:是一項在1705例對至少一種非生物DMARD應答不佳或不耐受的患者中進行的24周研究。
SELECT-PsA 2:是一項在642例對至少一種生物製劑DMARD應答不佳或不耐受的患者中進行的24周研究。
研究中,接受烏帕替尼15 mg治療的患者在第12周達到ACR20應答的比例均顯著高於安慰劑組(表13)。
與安慰劑相比,烏帕替尼15 mg治療實現ACR的各個組分改善,包括壓痛/疼痛和關節腫脹計數、患者和醫生總體評估、HAQ-DI、疼痛評估和hsCRP。
在SELECT-PsA 1中,在第12周達到ACR20應答的患者比例方面,烏帕替尼15 mg與阿達木單抗相比具有非劣效性。
這兩項研究中,單用或與甲氨蝶呤聯用時均觀察到一致的應答(主要和關鍵次要終點)。
在所評價的各亞組中,無論基線BMI、基線hsCRP和既往非生物DMARDs使用數量(≤1或>1)如何,均證實了烏帕替尼15 mg的療效。
臨床試驗
潰瘍性結腸炎
U-ACHIEVE和U-ACCOMPLISH:採用烏帕替尼每日一次45 mg,持續給藥8周的方案;在隨後的維持研究(U-ACHIEVE維持研究)中使用15 mg或30 mg,每日一次,持續至52周的給藥方案。在所有的臨床試驗中,相比於安慰劑,在第8周和52周時接受烏帕替尼治療達到臨床緩解的患者顯著更多。此外,研究還達到了所有次要終點,包括內鏡改善和組織學-內鏡黏膜改善(HEMI),以及維持期無激素臨床緩解。與安慰劑相比,所有的主要終點和按次次要終點的p值均<0.001。
特殊人群用藥
腎功能損害:輕度或中度腎功能損害的患者無需調整劑量。有重度腎功能損害的患者,推薦劑量為15 mg每天一次。
肝功能損害:輕度(Child Pugh A)或中度(Child Pugh B)肝功能損害的患者無需調整劑量。不應在重度肝功能損害(Child Pugh C)的患者中使用本品。
獲批歷史
2019年8月,烏帕替尼獲批FDA批准用於治療中重度類風濕關節炎患者。
2019年12月,烏帕替尼獲得EMA批准用於治療對一種或多種緩解疾病的抗風濕藥物 (DMARD)應答不佳或不耐受的中度至重度活動性類風濕關節炎。
2021年1月,烏帕替尼獲得EC批准用於治療對一種或多種緩解疾病的抗風濕藥(DMARDs)應答不佳或不耐受的活動性銀屑病關節炎 (PsA)成年患者。
2021年8月,烏帕替尼獲得EMA批准用於治療適合接受系統性治療的中度至重度特應性皮炎的成人和12歲及以上的青少年患者。
2022年1月,烏帕替尼獲得美國FDA批准用於治療成人和12歲及以上兒童難治性、中度至重度特應性皮炎。
2022年3月,烏帕替尼獲得美國FDA批准用於治療既往對一種或多種腫瘤壞死因子(TNF)抑制劑應答不足或不耐受的成年中重度活動性潰瘍性結腸炎(UC)患者。
2022年04月,烏帕替尼獲得美國FDA批准用於治療對一種或多種腫瘤壞死因子(TNF)抑制劑應答不佳或不耐受的活動性強直性脊柱炎(AS)成人患者。
2022年7月,烏帕替尼獲得歐盟委員會(EC)批准用於用於治療對非甾體類抗炎藥(NSAID)應答不足、C反應蛋白(CRP)升高和/或磁共振成像(MRI)顯示有客觀炎症體徵的活動性放射學陰性中軸型脊柱關節炎(nr-axSpA)成人患者。
2022年10月,烏帕替尼獲得美國食品藥品監督管理局(FDA)批准用於治療對腫瘤壞死因子(TNF)抑制劑治療療效欠佳或不耐受並顯示有客觀炎症證據的活動性放射學陰性中軸型脊柱關節炎(nr-axSpA)成人患者。