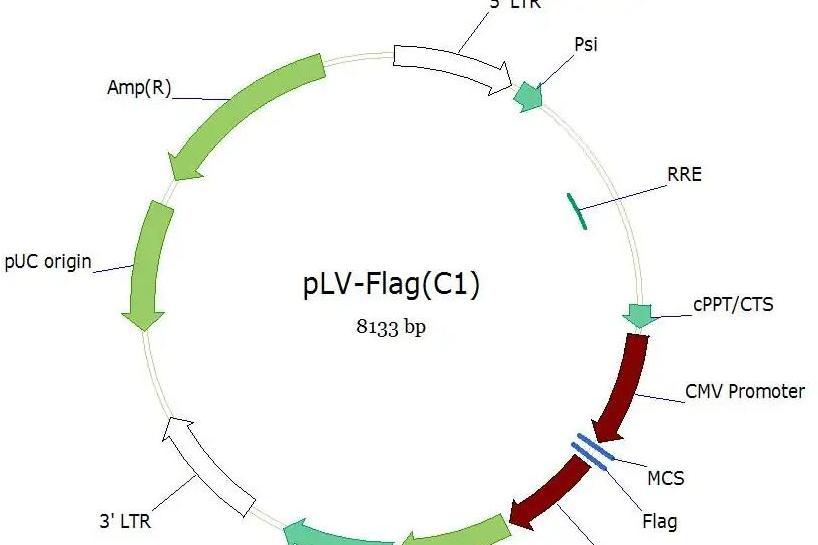
概念
慢病毒載體是指以人類免疫缺陷病毒-1 (H IV-1) 來源的一種
病毒載體,慢病毒載體包含了包裝、轉染、穩定整合所需要的遺傳信息,是慢病毒載體系統的主要組成部分。攜帶有
外源基因的慢病毒載體在慢
病毒包裝質粒、細胞系的輔助下,經過病毒包裝成為有感染力的病毒顆粒,通過感染細胞或活體組織,實現外源基因在細胞或活體組織中表達。
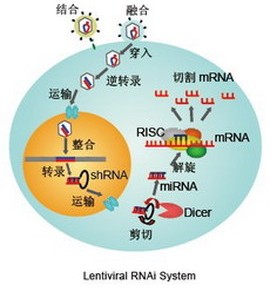
慢病毒載體
輔助成分
基本原理
慢病毒載體系統由兩部分組成,即包裝成分和載體成分。
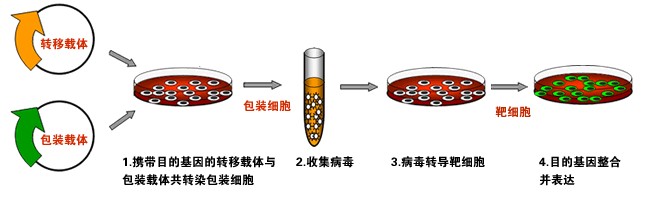
慢病毒包裝流程
包裝成分
由HIV-1基因組去除了包裝、
逆轉錄和整合所需的
順式作用序列而構建,能夠反式提供產生病毒顆粒所必需的蛋白。包裝成分通常被分開構建到兩個質粒上,一個質粒表達Gag和Pol蛋白,另一個質粒表達Env蛋白,其目的也是降低恢復成野生型病毒的可能。將包裝成分與載體成分的3個質粒共轉染細胞(如人腎293T細胞),即可在細胞上清中收穫只有一次性感染能力而無複製能力的、攜帶目的基因的HIV-1載體顆粒。
載體成分
與包裝成分互補,即含有包裝、逆轉錄和整合所需的HIV順式作用序列,同時具有異源
啟動子控制下的
多克隆位點及在此位點插入的目的基因。
為降低兩種成分
同源重組恢復成野生型病毒的可能,需儘量減少二者的
同源性,如將包裝成分上5′LTR換成
巨細胞病毒(CMV)立即早期啟動子、3′LTR換成
SV40 polyA等。
改進
包膜蛋白
採用表達
水皰性口炎病毒(VSV)
糖蛋白G的質粒和雙嗜性小鼠
白血病病毒(MLV)包膜蛋白Env的質粒,分別取代表達
HIV本身包膜蛋白Env的質粒,使HIV-1載體顆粒包上了VSV或雙嗜性MLV的 包膜。這樣做的結果至少具有三個方面的積極意義:①包膜的更換進一步降低了慢病毒載體恢復成野生型病毒的可能;②使HIV載體感染宿主的範圍不再僅限於
CD4+細胞,而擴大到幾乎能感染所有組織來源的細胞;③VSV的包膜賦予慢病毒載體顆粒高度的穩定性,使其能夠通過
超速離心而濃縮,達到高
滴度。Naldini等已使慢病毒載體滴度由105
轉錄單位(TU)/ml達到108TU/ml。
包裝成分
包裝成分的構建應在不重組病毒的裝配和感染力的前提下,儘可能地減少無關的HIV-1蛋白的表達,為野生型病毒的恢復設定障礙。Naldini等在構建包裝質粒時,阻止env基因的表達。在此基礎上,Zufferey等將包裝包裝質粒上表達
調節蛋白Nef、Vif、Vpr和Vpu的4個基因分別刪除或聯合刪除。這4個調節蛋白或已被證實、或被高度懷疑是構成HIV毒性的因素,將其刪除、加上包膜蛋白的替換,可使製備HIV載體過程中產生野生型病毒的可能必微乎其微。
載體質粒
載體質粒上HIV-1的順式序列通常包括兩端的
LTR、剪下位點及
包裝信號Ψ等。此外,研究表明,gag基因
5′端的序列可提高載體
RNA的包裝效率;Rev蛋白需要與Rev反應元件(RRE)相作用,將未剪下的載體轉錄產物從
細胞核轉運到
胞漿。因此,Naldini等在載體上保留了gag基因5′端350bp的序列及位於env序列中的RRE,提高了產生載體顆粒的能力。
套用前景
對於AIDS的基因治 療方案,基本上是以
逆轉錄病毒載體介導的方式,將
抗病毒基因體外導入CD4+
T淋巴細胞或CD34+的
造血祖細胞,再回輸體內。常用的抗病毒基因包括
自殺基因、
反義RNA、
核酶、RNA誘餌的相應
DNA序列以及調節蛋白或
結構蛋白的突變體基因等。由於這些治療基因不能到達
巨噬細胞和
多能幹細胞,因此難以重建免疫;此外,體外操作費用昂貴,不適於大規模套用。 慢病毒載體的為AIDS的基因治療帶來了新的希望,它可能具有以下優勢:第一,利用HIV-1本身包膜蛋白Env包裹的載體顆粒可以將抗病毒基因直接運抵CD4+T淋巴細胞和巨噬細胞,適於直接的體內治療,而包被了VSV包膜的載體顆粒又能感染多能幹細胞,有利於免疫重建;第二,患者體內的野生型HIV-1可將攜帶抗病毒基因的載體拯救出來,使載體擴增並擴散到周圍更多的細胞中發揮抗病毒作用;第三,如果將抗病毒基因置於HIV-1本身的
長末端重複序列(LTR)控制之下轉導細胞,則只有當HIV-1感染該細胞時,Tat蛋白反式激活LTR中的TAR元件,抗病毒基因才會表達,使
基因表達具有了靶向性。
神經系統疾病的基因治療
血液系統疾病的基因治療
存在問題
儘管慢載體的研究有了很大進展,但距離臨床套用還有很長的路要走。首先,重組病毒的滴度還不夠高,除Naldini等報導的結果外,其餘均在101TU/ml~103TU/ml之間,難以達到體內套用的需要;其次,由於HIV複雜的生物學性質,要像常用的小鼠逆轉錄病毒載體那樣建立穩定的HIV載體
包裝細胞十分困 難,已建立的包裝細胞均不理想。據報導,Vpr是一種使細胞進入
靜止期的強誘導劑,也是建立包裝細胞的主要障礙之一。如果確如前文所述,包裝質粒中的vpr基因並非必需、去除後不影響載體的轉導能力,則建立穩定的包裝細胞是大有希望的。
在保證HIV-1載體的安全性上,迄今已做了種種努力,要產生有複製力的HIV,必須在不同的質粒上發生多次
非同源重組事件。即使如此,一旦用於
人體試驗,仍然不能打消人們對感染有複製力的HIV-1的顧慮。更為謹慎的做法是,以非人類的慢病毒為基礎構建載體,如猴
免疫缺損病毒(
SIV)、貓和牛免疫缺損病毒(
FIV和BIV)、
馬傳染性貧血病病毒等,而這些工作尚屬空白。
參考資料