分子內親核取代反應(internal nucleophilic substitution)用SNi表示,其中S代表取代,N代表親核,i代表分子內。
基本介紹
- 中文名:分子內親核取代
- 外文名:internal nucleophilic substitution
背景知識
有機反應類型分類
反應物與試劑
分子內親核取代反應歷程
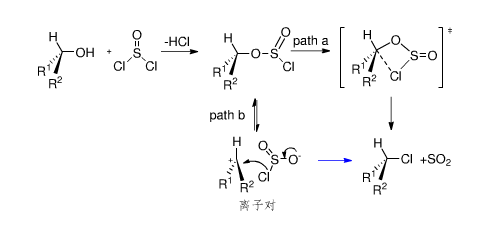
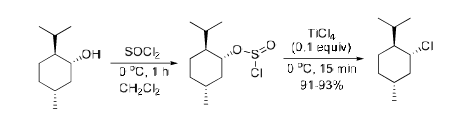
前沿研究
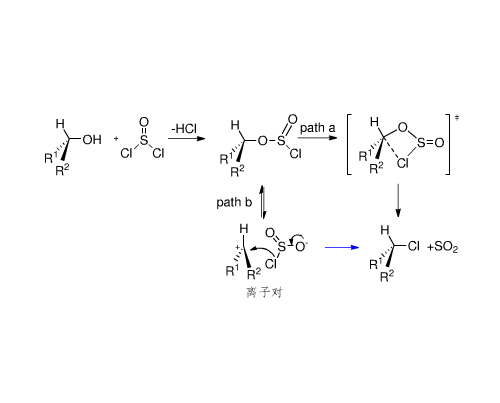
分子內親核取代反應(internal nucleophilic substitution)用SNi表示,其中S代表取代,N代表親核,i代表分子內。
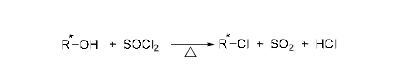


分子內親核取代反應(internal nucleophilic substitution)用SNi表示,其中S代表取代,N代表親核,i代表分子內。背景知識有機反應類型分類根據共價鍵斷裂的方式,有機化學反應可以分為協同反應...
親核取代反應,或稱親核性取代反應,通常發生在帶有正電或部分正電荷的碳上,碳原子被帶有負電或部分負電的親核試劑(Nu:-)進攻而取代。兩種反應機制 單分子親核取代反應(SN1)第一步是原化合物的解離生成碳正離子和離去基團,然後親核...
分子內親核取代[反應]分子內親核取代[反應](internal nucleophilic substitution [reaction])是2016年公布的化學名詞。公布時間 2016年經全國科學技術名詞審定委員會審定發布。出處 《化學名詞》第二版。
單分子親核取代反應(unimolecular nucleophilic substitution,S1)是只有一種分子參與了決定反應速率關鍵步驟的親核取代反應,簡寫為S1,其中S表示取代反應,角標表示親核,1表示只有一種分子參與速控步驟。反應機制 S1反應的反應機理可概述為...
取代反應可分為親核取代、親電取代和均裂取代三類。如果取代反應發生在分子內各基團之間,稱為分子內取代。有些取代反應中又同時發生分子重排(見重排反應)。需要注意,取代反應可以發生在無機化學中,例如:B₂H₆ + BCl₃⇌ B...
雙分子親核取代反應(S2)是親核取代反應的一類,其中S代表取代(Substitution),N代表親核(Nucleophilic),2代表反應的決速步涉及兩種分子。S2反應是由於起始物質與陰離子Y之間發生衝突所產生的反應,因此稱為雙分子反應。S2反應只有1個...
取代是指有機分子里的某些原子或原子團通過化學反應被其他原子或原子團所替代。相關概念 由親核試劑如HO⁻、:NR₃、CN、H₂N等與有機分子相互作用而發生的取代反應,稱為親核取代(SN)。在親核取代反應中,親核試劑Nu進攻被作用...
雙分子SNAr2機理 芳香親核取代最重要的機理;分為兩步,與脂肪族親核取代四面體機理,以及芳香族親電取代芳基正離子機理類似,第一步進攻試劑與底物成鍵形成中間體,然後離去基團離去;通常第一步為決速步驟;機理的證明:1)二級動力學...
反應物分子中的一個基團被另一基團所取代的反應,稱為取代反應。其中與親核試劑作用者稱為親核取代反應;與親電試劑作用者稱為親電取代反應。SN1表示單分子(或一級)親核取代反應;SN2表示雙分子(或二級)親核取代反應。SE1和SE2則表示...
整個反應速率只決定於第一個慢的步驟。由於在決定反應速率的慢步驟中只有一個反應物(RL)分子參加,所以一般把按這種過程進行的反應叫做單分子親核取代反應SN1(S代表取代,N代表親核,1代表單分子)。在單分子親核取代反應過程中,離解...
羰基碳正電性強的活性強,空間阻礙小的活性強, 連有吸電子基可使正電性加強,推電子基減弱, 這部分不會考活性比較的, 重點是親核取代,即先加成再消除的機理 還要有負碳離子反應。親核加成反應活性最強的化合物是:CCl₃CHO。其他...
綜上所述,芳烴親電取代反應歷程可以表示如下:2.脂肪體系親電取代反應與芳香體系有較大不同,其機理更類似於脂肪族的親核取代反應,一般可分為SE1和SE2,這與脂肪族親核取代機理中的SN1和SN2類似。而卡賓插入反應這樣先插入,再消去的...
芳族取代反應(aromatic substitution)是一個化學反應,分為芳族親電取代反應SEAr和芳族親核取代反應SNAr兩類,Ar表示芳基。反應類型 芳烴通過硝化、鹵化、磺化和烷基化或醯基化反應,可分別在芳環上引進硝基、鹵原子、磺酸基和烷基或醯基...
Smiles重排反應是一種人名反應,實質為分子內親核芳香取代反應。定義 硫醚、碸等化合物在鹼性條件下發生分子內芳香親核重排的過程 機理 底物在鹼的作用下攫氫形成相應的親核位點,隨後其構象進行調整,發生重排的芳香環所在的平面與Z-Z鍵...
離核體(nucleofuge) 是指會從原鍵結中帶走孤對電子的離去基團。例如,在SN2反應中,親核體攻擊一個含有離核體(溴官能基)的有機化合物,同時打破離核體和有機化合物的鍵結。簡介 雙分子親核取代反應反應(SN2)是親核取代反應的...
2)對消除和取代比率的影響 同E1和取代反應相比,強鹼對E2有利。在非離子的溶劑中,用高濃度的強鹼對雙分子歷程有利,用低濃度的鹼或完全不用鹼,在離子溶劑中,對單分子歷程有利,且對SN1比E1更有利。用強親核的弱鹼試劑,有...
這些具有孤對電子或π電子的基團在反應過程中能夠作為親核試劑優先發生分子內的親核取代,形成的不穩定環狀中間體再接受親核試劑的進攻,得到穩定的取代產物。分類及機理 (1)氧原子的鄰基參與 羧基的氧原子容易發生鄰基參與。例如,(S)...
通過對鹵代烷和各種親核試劑反應的動力學研究結果表明:SN反應主要有兩種反應歷程,一種是單分子親核取代反應(SN1),另一種為雙分子親核取代反應(SN2)。一個SN反應究竟以何種歷程進行,取決於各種因素:反應物的結構、試劑的親核性、溶劑的...
碸的另一個 α-位(α'-位)被鹼去質子化,然後發生分子內親核取代反應,失去鹵離子,形成順式和反式三元環狀碸,最後環狀碸失去二氧化硫生成順式和反式烯烴的混合物。套用 1、1,2-二亞甲基環己烷的合成 2、α,β-環氧碸經過...
當試劑的親核原子為碳時,取代結果形成碳-碳鍵,從而得到碳鏈增長產物,如鹵代烷與氰化鈉、炔化鈉或烯醇鹽的反應。由於反應物結構和反應條件的差異,SN有兩種機理,即單分子親核取代反應SN1和雙分子親核取代反應SN2。2、SN1的過程分...
由於決定反應速率的一步是過渡態勢能最高的一步,即C—X鍵的離解,此步只涉及到一種分子,因此,反應稱單分子親核取代反應。S反應的立體化學:從S反應機理可以看出,親核試劑從離去基團的背面進攻,其結果發生了構型的轉化。Ingold等人...
1966年,心環烯首次由多步有機合成並從產物中分離出來。由熒的溴代衍生物在鹼催化下通過分子內的親核取代關環得四溴代的心環烯。結構與性質 心環烯分子中的C-C 鍵分四類,分別為Rim,Flank,Hub 和Spoke。心環烯的X-射線晶體...
加熱或光照下,氮鹵鍵發生均裂,產生的氮自由基發生分子內1,5-或1,6-氫遷移,生成相應的碳自由基,然後和鹵素自由基偶聯。形成的鹵代胺中間體進一步發生分子內親核取代反應,然後在鹼的作用下,得到環胺產物。反應實質是氮自由基進行...
脫鹵化氫反應是從有機化合物分子中脫掉鹵化氫的反應。在強鹼作用下,鹵代烷脫去HX生成烯烴。在親核取代反應中同時伴隨著消除反應的發生,取代產物或消除產物那種為主,取決於鹵代烷的結構及鹼的濃度。沒有鹼存在時,主要得取代產物;...
(1)非催化氨解:反應屬於S2歷程,雙分子親核取代反應,首先是帶有未共用電子對的氨分子向芳環與氯相連的碳原子發生親核進攻,得到帶有極性的中間加成物,此加成物迅速轉化為銨鹽,並恢復環的芳香性,最後脫掉質子,得到產物,第一步...
這類雜環表現在化學性質上是親電取代反應變難,親核取代反應變易,氧化反應變難,還原反應變易。鹼性和成鹽 吡啶氮原子上的未共用電子對可接受質子而顯鹼性。吡啶的共軛酸(N原子上接受一個質子後的吡啶)的pKₐ為5.25,比氨(pK...
離去基團(leaving group),或稱離去基,在化學反應中從一較大分子中脫離的原子或官能基,是親核取代反應與消除反應中套用的術語。當離去基團共軛酸的pKa越小,離去基團越容易從其他分子中脫離。原因是因為當其共軛酸的pKa越小,相應...
