單分子反應是反應機理之一,其特點是在決定反應速率的步驟中僅涉及一個反應物分子的變化。
舉例,詳解,參考書目,
舉例
詳解
整個反應速率只決定於第一個慢的步驟。由於在決定反應速率的慢步驟中只有一個反應物(RL)分子參加,所以一般把按這種過程進行的反應叫做單分子親核取代反應SN1(S代表取代,N代表親核,1代表單分子)。
在單分子親核取代反應過程中,離解速率取決於離解後所生成的正碳離子中間體的穩定性,它是決定整個反應速率的步驟。而被離解出來的正碳離子中間體與親核試劑的結合成鍵,是不決定反應速率的步驟。反應速率只與反應物濃度成正比,而與親核試劑的濃度無關: 反應速率=k1【RL】
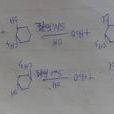
k1為反應速率常數。例如,用三級鹵代烴在極性較強的溶劑中與鹼反應:
反應中間體(CH3)3C的穩定性是單分子反應的內在因素。極性較大的溶劑具有較大的介電能力,能促進RL離解成R和L,是單分子反應的外部條件。
在離子型消除反應中,在溶劑的影響下,離去基團先帶著一對電子離去,生成的正碳離子失去一個質子,生成烯鍵:
與取代反應一樣,反應物的離解是決定整個反應速率的步驟,並且只有一個反應物分子參加,所以將按這種過程進行的反應稱為單分子消除反應E1(E代表消除,1代表單分子)。E的反應速率與反應物的濃度成正比。它與SN1反應一樣,也是分兩步進行的,中間體也是正碳離子。
參考書目
王積濤編:《高等有機化學》,人民教育出版社,北京,1980。