化學性質
化學變化的本質是舊鍵的斷裂和新鍵的形成,
化學反應中,
共價鍵存在兩種斷裂方式,在化學反應尤其是有機化學中有重要影響。
均裂與自由基反應
共價鍵在發生均裂時,成鍵電子平均分給兩個
原子(團),均裂產生的帶單電子的原子(團)稱為
自由基,用“R·”表示,自由基具有反應活性,能參與化學反應,自由基反應一般在光或熱的作用下進行。
異裂與離子型反應
·
親電反應(electrophilic reaction)
·
親核反應(nucleophilic reaction)
主要特點
飽和性
在
共價鍵的形成過程中,因為每個
原子所能提供的未成對電子數是一定的,一個原子的一個未成對電子與其他原子的未成對電子配對後,就不能再與其它電子配對,即,每個原子能形成的共價鍵總數是一定的,這就是共價鍵的飽和性。
共價鍵的飽和性決定了各種原子形成分子時相互結合的數量關係,是
定比定律(law of definite proportion)的內在原因之一。
方向性
除s軌道是球形的以外,其它原子軌道都有其固定的延展方向,所以共價鍵在形成時,軌道重疊也有固定的方向,共價鍵也有它的方向性,共價鍵的方向決定著分子的構形。
兩點性質
一
共價化合物中一定含有至少一個共價鍵,且一定沒有離子鍵!
共價化合物大多是分子晶體,故又叫分子化合物。
分子化合物一定是共價化合物。共價化合物包括分子化合物和
原子化合物
比如二氧化矽是原子化合物,但是它也是共價化合物
另外,絕大多數的稀有氣體間的作用力都是范德華力
二
共價化合物的分子是
原子間以
共用電子對所形成的。兩種
非金屬元素原子(或不活潑金屬元素和非金屬元素)化合時,原子間各出一個或多個電子形成
電子對,這個電子對受兩種元素原子的
原子核的共同吸引,為兩種元素原子所共有,使兩種元素的原子形成化合物分子。例如,
氯化氫是氫原子和氯原子各以最外層一個電子形成一個共用電子對而組成的化合物分子。非金屬
氫化物(如HCl、H2O、NH3等)、
非金屬氧化物(如CO2、SO3等)、無水酸(如H2SO4、HNO3等)、大多數有機化合物(如甲烷、
酒精、蔗糖等)都是共價化合物。多數共價化合物在固態時,熔點、沸點較低,硬度較小。
當兩種非金屬元素的
原子形成分子時,由於兩個原子都有通過得電子形成8電子穩定結構的趨勢,它們得電子的能力差不多,誰也不能把對方的電子奪過來,這樣兩個原子只能各提供一個電子形成
共用電子對,在兩個原子的核外空間運動,電子帶負電,
原子核帶正電。兩個原子的原子核同時吸引共用電子對,產生作用力,從而形成了一個分子。
由於兩個原子對電子的吸引能力不一樣,共用電子對總是偏向得電子能力強的一方,這一方的原子略顯負電性,另一方的原子略顯
正電性,作為整體,分子仍顯電中性。
比較典型的共價化合物是水、
氯化氫以及二氧化碳。共用電子對總是偏向
氧原子的一方,偏離氫原子的一方。 不同同種元素的
原子間形成的叫
極性共價鍵,一般共價化合物都是極性的共價化合物。共價化合物一般硬度小,熔沸點低。
某些單質的分子也是依靠
共用電子對形成的。例如氯氣的分子就是由兩個氯原子各提供一個電子形成共用電子對,電子對同時受兩個
原子核的作用形成氯分子。由於同種原子吸引電子能力相仿,電子對不偏向任何一方。同種元素的原子間形成的叫
非極性共價鍵,共用電子對在成鍵兩原子的中間,不向任何一方偏轉。
早期
在古希臘,化學還沒有從自然哲學中分離的時代,
原子論者對
化學鍵有了最原始的構想,
恩培多克勒(
Empedocles)認為,世界由“氣、水、土、火”這四種
元素組成,這四種元素在“愛”和“恨”的作用下分裂並以新的排列重新組合時,物質就發生了質的變化。這種作用力可以被看成是最早的化學鍵思想。
隨後,原子論者
德謨克利特構想,原子與原子間,存在著一種“鉤子”,也可以說是粗糙的表面,以致它們在相互碰撞時黏在一起,構成了一個穩定的
聚集體。德謨克利特對化學鍵的構想相比於之前的自然哲學家,是更加先進的,他剔除了此類構想中的唯心主義因素。
中世紀的J.R.
格勞伯則提出了物質同類相親、異類相斥的思想。其後還出現了關於物質結合的親和力說,認為物質的微粒具有親和力,由此互相吸引而結合在一起。總之,人們關於
化學鍵朦朧的認識,啟發了後來的化學家。
18世紀,
燃素(
phologiston)的概念進入了化學,並為恩斯特·
施塔爾(
Ernst Stahl)、
亨利·卡文迪許(HenryCavendish)和
約瑟夫·普利斯特里(
Joseph Priestley)等先進的化學家所接受。當時,
牛頓力學已經提出,他們希望把
原子間的作用力和牛頓力學結合起來,給出
經典物理學的解釋,但限於當時的條件,這無疑是無法完成的。
1916年,德國化學家阿爾布雷西特·柯塞爾(
A.Kossel)在考察大量事實後得出結論:任何元素的原子都要使最外層滿足8電子穩定結構,但柯塞爾只解釋了
離子化合物的形成過程,並沒有解釋
共價鍵的形成。
1919年,化學家歐文·朗繆爾首次使用“共價”來描述
原子間的成健過程
“(原文)
we shall denote by the termcovalence
the number of pairs of electrons which a given atom shares with its neighbors”(我們應該用“共價”一詞表示原子間通過
共用電子對形成的作用力)
1922年,
尼爾斯·玻爾(
N.Bohr)從
量子化的角度重新審視了
盧瑟福的核式模型,這為化學家對
化學鍵的認識,提供了全新的平台,他認為電子應該位於確定的軌道之中,並且能夠在不同軌道之間躍遷,
定態躍遷可以很好的解釋
氫原子光譜的各個譜線。
1923年,美國化學家
吉爾伯特·路易斯(
G.N.Lewis)發展了柯塞爾的理論,提出
共價鍵的電子對理論。路易斯假設:在分子中來自於一個
原子的一個電子與另一個原子的一個電子以“
電子對”的形式形成原子間的化學鍵。這在當時是一個有悖於正統理論的假設,因為
庫侖定律表明,兩個電子間是相互排斥的,但路易斯這種構想很快就為化學界所接受,並導致原子間
電子自旋相反假設的提出。
1924年,路易斯·
德布羅意(
Louis de Broglie)提出
波粒二象性的假說,建立了一個原子的數學模型,用來將電子描述為一個三維波形。在數學上不能夠同時得到位置和動量的精確值。
1926年,薛丁格提出量子力學的
波動方程,它可以直接用來解釋
化學鍵的“形成”和“斷裂”,這成為
量子化學最初的開端。
1927年,沃爾特·
海特勒(
W.H.Heitler)和弗里茨·倫敦(
F.London)用量子力學處理氫分子,用近似方法算出了氫分子體系的
波函式,首次用量子力學方法解決
共價鍵問題。
價鍵理論在這一方法的推廣中誕生,他們研究共價鍵的方法就被稱為HL法。
1928年,
恩利克·費米(
Enrica Fermi)提出了一個基於
泊松分布的單
電子密度模型試圖解決
原子結構問題。之後,道格拉斯·哈特里(
Douglas Rayner Hartree)運用
疊代法,將體系電子的
哈密頓運算元分解為若干個單電子哈密頓運算元的簡單加和,進而將體系多電子波函式表示為單電子波函式的積,改進這一模型,提出哈特里
方程。
1930年,哈特里的學生福克(
Fock)與約翰·斯萊特(
John Clarke Slater)完善了哈特里方程,稱為哈特里-福克方程(
HF)。50年代初,斯萊特得到了HF的近似波函式:哈特里-福克-斯萊特方程(
HFS)。1963年,赫爾曼(
F.Hermann)和斯基爾曼(
S.Skillman)把HFS套用於
基態原子函式。
1950年,克萊蒙斯·羅瑟恩(
C. C. J. Roothaan)進一步提出將
方程中的
分子軌道用組成分子的原子軌道線性展開,發展出了著名的RHF方程,1964年,計算機化學家恩里克·克萊門蒂(
E.Clementi)發表了大量的RHF波函式,該方程以及後續的改進版已經成為現代處理量子化學問題的主要方法。
1929年,貝特等提出
配位場理論,最先用於討論過渡金屬離子在晶體場中的能級分裂,後來又與
分子軌道理論結合,發展成為現代的配位場理論。
1930年,美國化學家萊納斯·鮑林(
L.C.Pauling)在研究碳的
正四面體構形時提出
軌道雜化理論,認為:
能級相近的軌道在受激時可以發生雜化,形成新的
簡併軌道,其理論依據就是電子的波粒二象性,而波是可以疊加的。他計算出了多種
雜化軌道的形狀,並因在價鍵理論方面的突出貢獻而獲得
諾貝爾化學獎。
1932年,弗里德里希·洪德(
F.Hund)將
共價鍵分為
σ鍵、
π鍵、
δ鍵三種,使價鍵理論進一步系統化,與經典的
化合價理論有機地結合起來。
同年,美國化學家
羅伯特·馬利肯(RobertS.Mulliken)提出分子軌道理論。認為化合物中的電子不屬於某個
原子,而是在整個分子內運動。他的方法和經典化學相距太遠,計算又很繁瑣,一時不被化學界所接受。後經過羅伯特·密立根(
Robert A.Millikan)、菲利普·倫納德(
Philipp Lenard)、埃里希·休克爾(
Erich Hückel)等人的完善,在化學界逐漸得到認可。
1940年,亨利·希吉維克(
H.Sidgwick)和托馬斯·坡維爾(
Thomas A.Powell)在總結實驗事實的基礎上提出了一種簡單的
理論模型,用以預測簡單分子或離子的
立體結構。這種理論模型後經羅納德·吉列斯比(
R.J.Gillespie)和羅納德·尼霍爾姆(
R.S.Nyholm)在20世紀50年代加以發展,定名為
價層電子對互斥理論,簡稱VSEPR。VSEPR與
軌道雜化理論相結合,可以
半定量地推測分子的成鍵方式與分子結構。
1951年,
福井謙一提出
前線軌道理論,認為,分子中能量最高的分子軌道(
HOMO)和沒有被電子占據的,能量最低的分子軌道(
LUMO)是決定一個體系發生
化學反應的關鍵,其他能量的分子軌道對於化學反應雖然有影響但是影響很小,可以暫時忽略。
HOMO和LUMO便是所謂
前線軌道。
由於計算機技術的迅猛發展,和
蒙特卡羅方法的套用,
量子化學與
計算機化學日新月異,對
分子結構的推算變得愈發精確期間也誕生了一大批優秀的化學家,據估計,20世紀中期,量子化學還將有新的突破.

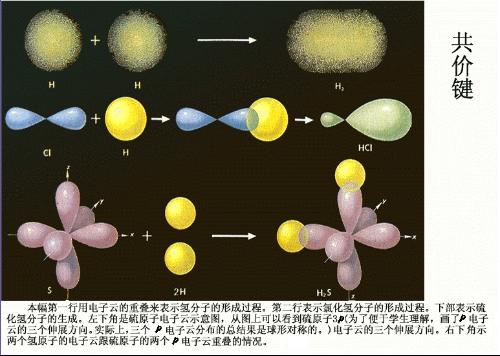 共價化合物
共價化合物