發展歷史
分子軌道理論(Molecular Orbital,簡稱MO)最初是由Mulliken和Hund提出,經過Huckel(簡單分子軌道理論,簡稱HMO),Roothaan(自洽場分子軌道理論),福井謙一(前線分子軌道理論,簡稱FMO),Woodward和Hoffmann(分子軌道對稱守恆原理)等眾多科學家的不斷探索,形成了一套成熟的理論,與價鍵理論(VB)和配位場理論(LF)一樣解決分子結構問題。
分子軌道理論經過半個世紀的迅猛發展,已經成為當代化學鍵理論的主流。如今多用於共軛分子的性質的研究,量子化學的研究,分子的化學活性和分子間的相互作用的研究,基元化學反應的研究,指導某些複雜有機化合物的合成。
分子軌道理論的產生
1926-1932年,在討論分子(特別是雙原子分子)光譜是,Mulliken和Hund分別對分子中的電子狀態進行分類,得出選擇分子中電子量子數的規律,提出了分子軌道理論。他們還提出能級相關圖和成鍵、反鍵軌道等重要概念。
1931-1933年,Huckel提出了一種簡單分子軌道理論(HMO),用以討論共軛分子的性質,相當成功,是分子軌道理論的重大進展。
1951年,Roothaan在Hartree-Fock 方程的基礎上,把分子軌道寫成原子軌道的線性組合,得到Roothaan方程。1950年,Boys用Gauss函式研究原子軌道,解決了多中心積分的問題,從Hartree-Fock-Roothaan方程出發,套用Gauss函式,是今天廣為套用的自洽場分子軌道理論的基礎,在量子化學的研究中占有重要地位。
1952年,福井謙一提出了前線軌道理論,用以討論分子的化學活性和分子間的相互作用等,可以解釋許多實驗結果。
1965年,Woodward和Hoffmann提出了分子軌道對稱守恆原理,發展成為討論基元化學反應可能性的重要規則,已成功的用於指導某些複雜有機化合物的合成。
含義
分子軌道(MO)可用原子軌道線性組合(Linear Combination of Atomic Orbital,簡寫為LCAO),也是常用的構成分子軌道的方法。由n個原子軌道組合可得到n個分子軌道,線性組合係數可用變分法或其它方法確定。兩個原子軌道形成的分子軌道,能級低於原子軌道的稱為成鍵軌道;能級高於原子軌道的稱為反鍵軌道;能級接近原子軌道的一般為非鍵軌道。
兩個原子軌道要有效的組合成分子軌道,必須滿足對稱性匹配、能級相近和軌道最大重疊三個條件。其中對稱性匹配是先決條件,其他條件影響成鍵的效率。
原子A及B相互作用,即可形成分子A-B中的兩個分子軌道,其中一個分子軌道能量比原來的軌道要低,叫分子的
成鍵軌道;而另一個則比原來要高,叫
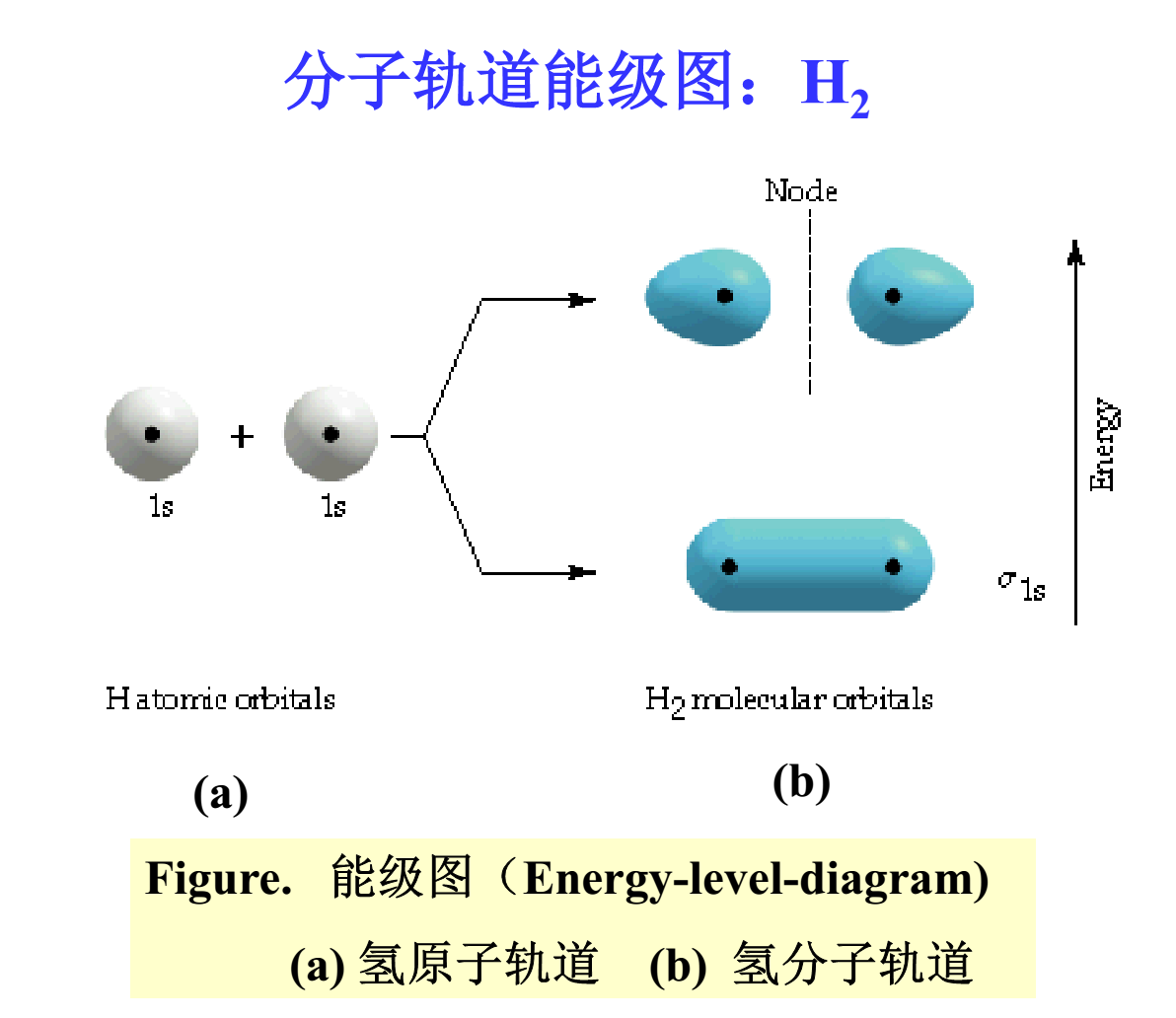
反鍵軌道。例如,兩個H原子相互作用形成H2分子時,其分子軌道
能級上的電子排列情況可用線性組合圖來表示,其上反鍵軌道是空著的。
詳解
分子運動描述
分子當中的電子在遍及整個分子範圍內運動,每一個電子的運動狀態都可以用一個分子
波函式(或者稱為分子軌道)Ψ來描述。|Ψ|^2表示了電子在空間各處出現的
幾率密度。
軌跡原則
原子軌道在組成分子軌道時候,必須滿足下面三條原則才能有效的組成分子軌道。
(1)
對稱性匹配原則:兩個原子軌道的對稱性匹配時候它們才能夠組成分子軌道。那么什麼樣子的原子軌道才是對稱性匹配呢?可將兩個原子軌道的角度分布圖進行兩種對稱性操作,即旋轉和反映操作,“旋轉”是繞
鍵軸(以x軸為鍵軸)旋轉180度,“反映”是包含鍵軸的某一個平面(xy或者xz)進行反映,即是照鏡子。
若操作以後它們的
空間位置,形狀以及波瓣符號均沒有發生改變稱為旋轉或者反應操作對稱,若有改變稱為
反對稱。兩個原子軌道“旋轉”“反映”兩種對稱性操作均為對稱或者反對稱就稱為兩者“對稱性匹配”。
s和Px
原子軌道軌道對於旋轉以及反應兩個操作均為對稱;Px以及Pz原子軌道對於旋轉以及反映兩個操作均是反對稱,所以它們都是屬於對稱性匹配,可以組成分子軌道,同理我們還可以得到Py與Py,Pz與Pz原子軌道也是對稱性匹配。
(2)能量近似原則:當參與組成分子軌道的原子軌道之間能量相差太大時候,不能有效的組成分子軌道。原子軌道之間的能量相差越小,組成的分子軌道成鍵能力越強,稱為“能量近似原則”。
(3)最大重疊原則:原子軌道發生重疊時,在可能的範圍內重疊程度越大,形成的
成鍵軌道能量下降就越多,成鍵效果就越強,即形成的化學鍵越牢固,這就叫最大重疊原則。例如兩個
原子軌道各沿x軸方向相互接近時,由於Py和Px軌道沒有重疊區域,所以不能組成分子軌道;s與s以及Px與Px之間有最大重疊區域,可以組成分子軌道;而s和Px軌道之間只要能量相近也可以組成分子軌道。
分子形成原則
類型
在
價鍵理論當中
共價鍵可以分為σ和
π鍵。在分子軌道當中我們如何區別它們呢?在氫
分子離子形成過程當中我們看到了由兩個1s軌道形成了一個成鍵的σ1s軌道(形狀像橄欖)和另一個反鍵σ1s*(形狀像兩個雞蛋)。凡是分子軌道
對稱軸形成圓柱形對稱的叫做“
σ軌道”。在成鍵δ軌道上的電子稱為“成鍵σ電子”,它們使得分子穩定化;在反鍵δ*軌道上的電子稱為“反鍵σ電子”,它們使得分子有解離的傾向。由成鍵σ電子構成的共價鍵稱為
δ鍵。(見圖6)同樣,我們可以用參加組合的
原子軌道圖形,按照一定的重疊方式定性的繪出其他的分子軌道。比如沿著x軸靠近則兩個px軌道將“頭碰頭”的組成兩個σ型分子軌道,如果是py和py,pz和pz就是“肩並肩”的組合稱為另一種形狀的分子軌道,稱為π軌道
它們有一個通過
鍵軸與紙面垂直的
對稱平面,好像兩個長型的冬瓜,分別置於界面的上下。成鍵π軌道上的電子叫做成鍵
π電子,它們使得分子穩定。圖下部反鍵π2p*軌道,它們能量較高,好像四個雞蛋分別置於截面上下。反鍵π軌道上的電子叫做“反鍵π電子”,它們有使得分子解離的傾向。由成鍵π電子構成的
共價鍵稱為“
π鍵”
由兩個p
原子軌道形成的π鍵稱為p-pπ鍵。除此之外,p軌道還可以和對稱性的d軌道形成p-dπ鍵,例如px-dxz。相同對稱性的d軌道之間還能形成d-dπ鍵,例如dzx-dzx。
我們可以看出,無論是δ型軌道還是π軌道,
成鍵軌道中的都是
電子云在兩核之間的密度比較大,因此有助於兩個原子的組合。在
反鍵軌道中,電子云遠離兩核中間區域偏向於兩核的外側,從而使得兩個原子的分離。
鍵級
分子的鍵級等於成鍵
電子數減
反鍵電子數再除以二。鍵級越大,鍵越穩定,鍵級為0的分子只有稀有氣體。
發展展望
如今,前線軌道理論還在進一步的發展中,其套用範圍也在擴展。現在研究較多集中於各種游離基反應、聚合反應、無機物和絡合物的電子結構等方面;對含N-N,N-S, C-Si,S-Cl,氫鍵等結構的化合物也有大量研究。
對於分子軌道,我認為今後發展的方向將會在指導某些複雜有機化合物的合成。很多具有特異性功能的基團在已經存在的化合物上並不能很好的作用,同時也不有可能因為有毒性,所以導致不能使用。所以,將這些特異性的基團連線在一些有利於其發揮功能的底物上使其發揮功能。但是如今很多化合物由於很多原因導致並不能連線。我認為以後可以用到分子軌道中的相關知識使其更易連線形成功能性更好的複雜高分子。