基本介紹
- 中文名:葡萄糖異構酶
- 外文名:glucose isomerase
- 別名:D-木糖異構酶
- 簡稱:GI
- 套用:生產高果糖漿
物質介紹
結構特點
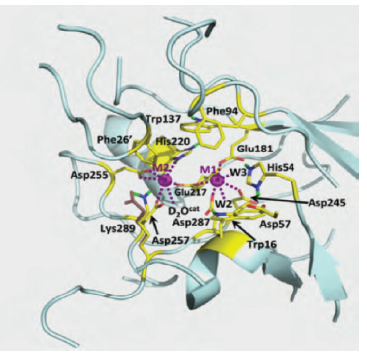


葡萄糖異構酶(glucose isomerase , GI),又稱木糖異構酶,指的是能將D一木糖,D-葡萄糖,D核糖等醛糖異構化為相應酮糖的異構酶。GI的來源非常廣泛,細菌、真菌和放線菌等微生物以及植物和動物細胞中均有G...
FAO/WHO,1994〕。對來自凝結芽孢桿菌和銹赤霉鏈黴菌的非固定化葡萄糖異構酶,不能提出ADI。而對紫黑鏈黴菌(Streptomyces violaceoniger)葡萄糖異構酶的ADI,無需規定(FAO/WHO,1994)。推薦品牌 諾維信公司 ...
磷酸葡萄糖異構酶是一種多功能的蛋白質,在類風濕關節炎中可以升高。同時,心臟梗死,或者肝炎,肝硬化等也可以明顯升高。臨床意義 急性心肌梗塞可引起病人血清GPI活性升高,在胸痛後24小時即達峰值,48小時~3天內很快恢復正常。有63%的...
固定化葡萄糖異構酶製劑是由中國食品發酵工業研究院、諾維信(中國)生物技術有限公司單位起草。基本信息 標準號 StandardNo: GB/T 23533-2009 中文標準名稱 StandardTitle in Chinese: 固定化葡萄糖異構酶製劑 英文標準名稱: Immobilizod...
葡萄糖-6-磷酸異構酶(G6PI)是一種多功能的胞質酶,存在於細胞質和細胞外液中,尤其是關節腔內。其主要功能是催化D-葡萄糖-6-磷酸鹽和D-果糖-6-磷酸鹽之間的互換,是糖酵解和糖異生的重要的酶類,除了具有酶活性還有細胞和生長...
葡萄糖異構酶 用於將葡萄糖轉化為甜度高的果糖,生產高果糖漿。 澱粉酶:廣泛地套用於紡織品的褪漿,其中細菌澱粉酶能忍受100~110℃的高溫操作條件。醫學中的套用 人體內已發現的酶近千種。酶的缺乏或不足,就會影響某種生物化學反應...
《酶製劑工業下冊》由科學出版社出版。本書分上下兩冊出版。上冊介紹酸製劑生產基本原理和生產設備、試驗室精製方法以及酶的固定化技術等;本書為下冊,分別介紹蛋白酶、澱粉酶、葡萄糖異構酶等二十多種酶製劑的性質、測定方法、菌種來源...
葡萄糖在醫學上主要用作注射用營養劑(葡萄糖注射液)。食品工業上葡萄糖經異構酶處理後可製造果糖,尤其是含果糖42%的果葡糖漿,其甜度同蔗糖,已成為當前製糖工業的重要產品。葡萄糖是生物體內新陳代謝不可缺少的營養物質。它的氧化...
中國已批准使用於食品工業的酶製劑有α-澱粉酶、糖化酶、固定化葡萄糖異構酶、木瓜蛋白酶、果膠酶、β-葡聚糖酶、葡萄氧化酶、α-乙醯乳酸脫氨酶等,主要套用於果蔬加工、焙烤、乳製品加工等方面。澱粉酶行業發展快速,產量成倍增長...
接著系統地闡述了目前酶製劑工業常用的澱粉酶、纖維素酶、蛋白酶等,以及目前市場份額不大,但套用前景廣泛的木聚糖酶、植酸酶、脂肪酶、葡萄糖異構酶、果膠酶、青黴素醯化酶、漆酶、凝乳酶等的特點與生產工藝。全書內容豐富,條理清晰,...
至於共固定化法,指的是將葡萄糖氧化酶或葡萄糖異構酶與菌體細胞共固定化,條件更複雜,難以控制,中國國內外學者對此尚有爭議,而且截至2001年8月未能實現產業化。《用固定化果糖基轉移酶生產蔗果低聚糖的方法》發明人在實驗室研究了...
葡萄糖漿由澱粉水解製得,60年代套用微生物酶法生產葡萄糖。這是一項重大革新,比酸水解法有明顯的優點。在生產中原料不必精製,不需耐酸、耐壓的設備,而且糖液無苦味,產糖率高。食品工業上葡萄糖經異構酶處理後可製造果糖,尤其是含...
我國生物酶製劑的研製和生產起步較晚,以醫用為主的蛋白質或酶的蛋白質工程,如胰島素、尿激酶原、天花粉蛋白、胰蛋白酶及其抑制劑、枯草桿菌蛋白酶、凝乳酶、葡萄糖異構酶及金屬硫蛋白等,對這些天然酶的改造,為生物酶在醫療領域的套用...
玉米澱粉生產高果糖漿的整體工藝大致可分為:澱粉調漿、用α-澱粉酶液化得到糊精、用葡萄糖澱粉酶糖化得到葡萄糖、用葡萄糖異構酶將部分葡萄糖轉化為果糖,得到42%的高果糖漿。(2)以蔗糖為原料生產高果糖漿 由蔗糖製備高果糖漿需要先將...
1968年,柯林頓又介紹了“異構糖100”,含有42%的果糖;也是用間歇法生產的,一開始是用液體葡萄糖異構酶,後來用了把酶固定於不溶性基質上的方法,一直到1972年11月,用固相酶的連續系統投入生產。從間歇法到連續法的轉變減少了與酶...
朱國萍,張穎,徐暘,唐建國,徐沖。葡萄糖異構酶突變體酶GIG138P和GIG138P- G247D在變鉛青鏈黴菌中的高效表達及檢測。生物工程學報,2002,18(3):304–307 朱國萍。葡萄糖異構酶的生物工程研究進展。生物化學與生物物理進展,2000,...
1973年,用固定化葡萄糖異構酶從葡萄糖生產高果糖漿獲得成功,產量迅速增加,已達幾百萬噸,正在逐步取代蔗糖作為食品與飲料的甜味劑。美國可口可樂公司所用甜味劑幾乎100%是高果糖漿。最近食用甜味劑又出現了一顆新星——天冬氨素。科學家...
吸附介質和一些添加劑對酶有保護作用,能夠降低交聯的激烈程度。辛嘉英等以Al2O3為載體,在明膠的保護作用下,通過吸附交聯法固定化葡萄糖異構酶,酶活力由62.3%提高到92.6%,這是因為明膠中富含氨基基團,能替代酶表面的氨基和戊二醛的...
提高蛋白質的穩定性包括以下幾個方面:(1)延長酶的半壽期;(2)提高酶的熱穩定性;(3)延長藥用蛋白的保存期;(4)抵禦由於重要胺基酸氧化引起的活性喪失。葡萄糖異構酶(GI)在工業上套用廣泛,為提高其熱穩定性,朱國萍等人在...
在工業方面,如利用產葡萄糖異構酶的固定化細胞生產果葡糖漿;將糖化酶與含α澱粉酶的細菌、黴菌或酵母細胞一起共固定,可以直接將澱粉轉化成葡萄糖;利用海澡酸鈣或卡拉膠包埋酵母菌,通過批式或連續發酵方式生產啤酒;利用固定化酵母...
60年代中期,酶固定化的技術進展迅速。1969年,用於拆分乙醯基-DL-胺基酸的固定化酶投入使用。70年代以後,製成了多種大規模套用的固定化酶。1973年製成生產高果糖糖漿的葡萄糖異構酶,不久即大規模使用。1985年,丙烯腈水解酶投入工業...
乳製品工業: 凝乳酶 乳酪生產的凝結劑,並可用於分解蛋白質。 乳糖酶降解乳糖為葡萄糖和半乳糖,獲得沒有乳糖的牛乳製品,有利於乳品的消化吸收。製糖工業: 澱粉酶等將澱粉轉化為葡萄糖及各類糖漿 葡萄糖異構酶 用於將葡萄糖轉化為...
D-果糖是一種化學物質,分子式為C₆HO₆。工業上規模生產採用澱粉水解制葡萄糖,經固定化葡萄糖異構酶轉化為轉化糖,其中含有42%的果糖和58%的葡萄糖,將其分離後即得到果糖。用於生化和微生物研究及硼酸的測定。物化性質 外觀與...
任務七 抑制劑對酶促反應速率的影響 項目五 酶的活力測定 任務一 酶的活力與活力單位 任務二 測定酶活力的兩種方式 項目六 食品工業中重要的酶及其套用 任務一 水解酶類 任務二 氧化還原酶類 任務三 葡萄糖異構酶 任務四 固定化酶...
3 果葡糖漿:如果把精製的葡萄糖液流經固定化葡萄糖異構酶柱,使其中葡萄糖一部分發生異構化反應,轉變成其異構體果糖,得到糖分組成主要為果糖和葡萄糖的糖漿,再經活性炭和離子交換樹脂精製,濃縮得到無色透明的果葡糖漿產品。這種...
第五章酶蛋白質工程 第一節酶的分子結構與催化功能 第二節蛋白酶工程 第三節葡萄糖異構酶工程 第四節酶蛋白的定向進化 第六章抗體工程 第一節概述 第二節抗體及其基因結構與抗體多樣性的分子基礎 第三節鼠單抗的人源化 第四節小...
