指標介紹 機體對氧的攝取和利用是一個複雜的生物學過程。一般來講,判斷組織獲得和利用氧的狀態要檢測二個方面因素:組織的供氧量、組織的耗氧量。測定血氧參數對了解機體氧的獲得和消耗是必要的:
1.1 氧分壓 (partial pressure of oxygen,P O2 ) 為物理溶解於血液的氧所產生的張力。動脈血氧分壓( Pa O2 )約為 13.3kPa (100mmHg),
靜脈 血氧分壓 (Pv O2) 約為 5.32kPa ( 40mmHg ), Pa O2 高低主要取決於吸入氣體的氧分壓和外呼吸功能,同時,也是氧向組織彌散的動力因素;而 PvO2 則反映內呼吸功能的狀態。
1.2 氧容量 (oxygen binding capacity ,CO2max )
CO2max 指 PaO2 為 19.95kPa (150mmHg) 、PaCO2為 5.32kPa(40mmHg) 和38℃ 條件下,100ml血液中血紅蛋白(Hb)所能結合的最大氧量。CO2max高低取決於Hb質和量的影響,反映血液攜氧的能力。正常
血氧容量 約為 8.92mmol/L(20ml%)。
1.3 氧含量(oxygen content,CO2)
CO2是指100ml血液的實際帶氧量,包括血漿中物理溶解的氧和與 Hb 化學結合的氧。當PO2為13.3kPa(100mmHg)時,100ml血漿中呈物理溶解狀態的氧約為 0.3ml ,化學結合氧約為 19ml。正常動脈血氧含量(CaO2)約為8.47mmol/L(19.3ml/dl) ;靜脈血氧含量(CvO2)為5.35-6.24mmol/L(12ml%-14ml/dl)。氧含量取決於氧分壓和Hb的質及量。
1.4 氧飽和度 (oxygen saturation , SO2) SO2是指Hb結合氧的百分數。
SO2 =(氧含量–物理溶解的氧量)/氧容量×100%
此值主要受PO2的影響,兩者之間呈氧合Hb解離曲線的關係。正常動脈
血氧飽和度 為 93%-98% ;靜脈血氧飽和度為 70%-75%。
1.5 動–靜脈氧差(A-Vd O2 )
A-Vd O2為CaO2 減去CvO2 的差值,差值的變化主要反映組織從單位容積血液內攝取氧的多少和組織對氧利用的能力。正常
動脈血 與混合
靜脈血 的氧差為 2.68-3.57mmol/L(6ml%-8ml%)。當血液流經組織的速度明顯減慢時,組織從血液攝取的氧可增多,回流的靜脈血中氧含量減少,A-Vd O2 增大;反之組織利用氧的能力明顯降低、 Hb 與氧的親和力異常增強等回流的靜脈血中氧含量增高,A-Vd O2 減小。Hb 含量減少也可以引起 A-Vd O2 減小。
1.6 P50
P50 指在一定體溫和血液pH條件下,Hb 氧飽度為 50% 時的氧分壓。P50 代表Hb與O2的親和力,正常值為 3.47-3.6kPa(26-27mmHg)。
氧離曲線 右移時P50 增大,氧離曲線左移時P50 減小,比如紅細胞內2,3-DPG 濃度增高1mmol/gHb 時, P50將升高約0.1kPa。
類型特點 根據缺氧的原因和血氣變化的特點,可把單純性缺氧分為四種類型:
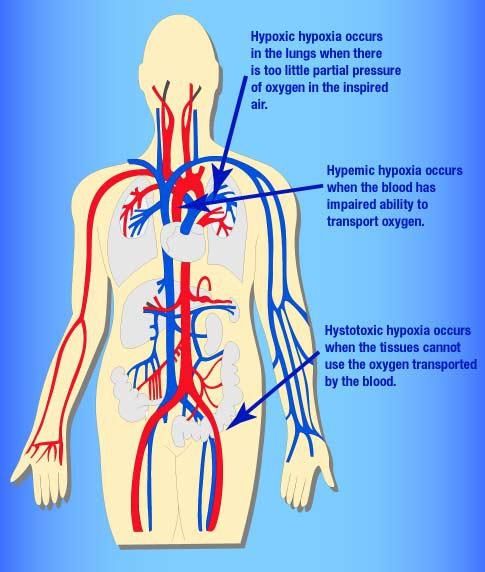
2.1 低張性缺氧 低張性缺氧 (hypotonic hypoxia)指由 Pa O2 明顯降低並導致組織供氧不足。當 Pa O2 低於 8kPa (60mmHg)時,可直接導致CaO2和SaO2 明顯降低,因此低張性缺氧也可以稱為低張性低氧血症( hypotonic hypoxemia )。
2.1.1 原因
低張性缺氧的常見原因為吸入氣體氧分壓過低、肺功能障礙和靜脈血摻雜入
動脈血 增多。
(1) 吸入氣體氧分壓過低:因吸入過低氧分壓氣體所引起的缺氧,又稱為大氣性缺氧( atmospheric hypoxia )。
(3) 靜脈血分流入動脈:多見於先天性心臟病。
2.1.2 血氧變化的特點
①由於彌散入
動脈血 中的氧壓力過低使PaO2降低,過低的PaO2可直接導致CaO2和SaO2降低;
②如果Hb無質和量的異常變化,CO2max 正常;
③由於PaO2降低時,紅細胞內2,3-DPG增多,故血SaO2 降低;
④低張性缺氧時, PaO2 和血SaO2 降低使CaO2降低;
⑤動-靜脈氧差減小或變化不大。通常 100ml 血液流經組織時約有 5ml 氧被利用,即 A-V d O2 約為 2.23mmol/L(5ml/dl)。氧從血液向組織彌散的動力是二者之間的氧分壓差,當低張性缺氧時, Pa O2 明顯降低和CaO2明顯減少,使氧的彌散速度減慢,同量血液彌散給組織的氧量減少,最終導致 A-V d O2 減小和組織缺氧。如果是慢性缺氧,組織利用氧的能力代償增加時, A-Vd O2 變化也可不明顯。
正常毛細血管中脫氧 Hb 平均濃度為 26g /L( 2.6g /dl)。低張性缺氧時,
動脈血 與靜脈血的氧合 Hb 濃度均降低,毛細血管中氧合 Hb 必然減少,脫氧 Hb 濃度則增加。當毛細血管中脫氧 Hb 平均濃度增加至 50g /L( 5g /dl) 以上(SaO2 ≤80% ~ 85% )可使皮膚黏膜出現青紫色,稱為
紫紺 (cyanosis)。在慢性低張性缺氧很容易出現紫紺。紫紺是缺氧的表現,但缺氧的病人不一定都有紫紺,例如貧血引起的血液性缺氧可無紫紺。同樣,有紫紺的病人也可無缺氧,如
真性紅細胞增多症 患者,由於 Hb 異常增多,使毛細血管內脫氧 Hb 含量很容易超過 50g /L ,故易出現紫紺而無
缺氧症狀 。
2.2 血液性缺氧 血液性缺氧 (hemic hypoxia )指 Hb 量或質的改變,使CaO2減少或同時伴有氧合 Hb 結合的氧不易釋出所引起的組織缺氧。由於 Hb 數量減少引起的血液性缺氧,因其 Pa O2 正常而CaO2減低,又稱等張性缺氧( isotonic hypoxemia )。
2.2.1 原因
(1) 貧血:又稱為貧血性缺氧 (anemic hypoxia)。
(2) 一氧化碳( CO )中毒:Hb 與 CO 結合可生成碳氧 Hb ( carboxyhemoglobin,HbCO )。CO 與 Hb 結合的速度雖僅為 O2 與 Hb 結合速率的 1/10 ,但 HbCO 的解離速度卻只有 HbO2 解離速度的 1/2100 ,因此, CO 與 Hb 的親和力比 O2 與 Hb 的親和力大 210 倍。當吸入氣體中含有0.1%CO時,血液中的Hb可有50%轉為 HbCO ,從而使大量Hb 失去攜氧功能;CO 還能抑制紅細胞內
糖酵解 ,使2,3-DPG生成減少,
氧解離曲線 左移, HbO2不易釋放出結合的氧;HbCO中結合的 O2 也很難釋放出來。由於 HbCO 失去攜帶 O2 和妨礙 O2 的解離,從而造成組織嚴重缺氧。在正常人血中大約有 0.4%HbCO。當空氣中含有 0.5%CO 時,血中 HbCO 僅在 20 ~ 30min 就可高達 70%。CO 中毒時,代謝旺盛、需氧量高以及
血管吻合 支較少的器官更易受到損害。
(3)
高鐵血紅蛋白血症 :當
亞硝酸鹽 、過氯酸鹽、磺胺等中毒時, 可以使血液中大量( 20% ~ 50% ) Hb 轉變為高鐵血紅蛋白( methemoglobin,HbFe 3+ OH )。高鐵 Hb 形成是由於 Hb 中二價鐵在氧化劑的作用下氧化成三價鐵,故又稱為變性 Hb 或羥化 Hb。高鐵 Hb 中的Fe3+ 因與羥基牢固結合而喪失攜帶氧能力;另外,當 Hb 分子中有部分Fe2+ 氧化為Fe3+ ,剩餘吡咯環上的Fe2+ 與 O2 的親和力增高,氧離曲線左移,高鐵 Hb 不易釋放出所結合的氧,加重組織缺氧。患者可因缺氧,出現頭痛、衰弱、昏迷、呼吸困難和
心動過速 等症狀。臨床上常見的是食用大量新醃鹹菜或腐敗的蔬菜,由於它們含有大量硝酸鹽,經胃腸道細菌作用將
硝酸鹽還原 成亞硝酸鹽並經腸道黏膜吸收後,引起高鐵 Hb 血症,患者皮膚、黏膜(如口唇)呈現青灰色,也稱為
腸源性紫紺 (enterogenous cyanosis)。
在生理狀態下,血液中也有少量的高鐵 Hb 不斷形成,但可以通過體內還原劑如 NADH 、維生素C 、
還原型谷胱甘肽 等還原為Fe2+ ,使正常血液中高鐵 Hb 含量限於 Hb 總量的 1% ~ 2%。高鐵 Hb 血症還可見於一種 HbM 遺傳性高鐵 Hb 血症。這種疾病是由於 a 58 組 → 酪 突變,酪氨酸占據了血紅素 Fe 原子的配基位置,使之呈現穩定的高鐵狀態,患者有紫紺症狀和繼發性
紅細胞增多 。
(4)Hb 與氧的親和力異常增加:見於輸入大量庫存血液或鹼性液體,也見於某些
血紅蛋白病 。庫存血液的紅細胞內 2,3-DPG 含量低使
氧合血紅蛋白 解離曲線左移;基因的突變, a 鏈第 92 位精氨酸被亮氨酸取代時, Hb 與 O2 的親和力比正常高几倍。
2.2.2 血氧變化的特點
貧血引起缺氧時,由於外呼吸功能正常,所以 Pa O2 、SaO2 正常,但因 Hb 數量減少或性質改變,使氧容量降低導致CaO2減少。
CO 中毒時,其血氧變化與貧血的變化基本是一致的。但是CO2max 在體外檢測時可以是正常的,這因在體外用氧氣對血樣本進行了充分平衡,此時O2已完全競爭取代HbCO中的 CO 形成氧合 Hb ,所以血 CO2 max 可以是正常的。
血液性缺氧時,血液流經毛細血管時,因血中HbO2總量不足和PO2下降較快,使氧的彌散動力和速度也很快降低,故 A-V d O2 低於正常。
Hb與O2 親和力增加引起的血液性缺氧較特殊,其PaO2 正常;CaO2和SaO2 正常,由於Hb與O2親和力較大,故結合的氧不易釋放導致組織缺氧,所以 PvO2升高;CvO2和 Sv O2升高,A-V d O2 小於正常。
2.2.3 皮膚、黏膜顏色變化
單純 Hb 減少時,因氧合血紅蛋白減少,另外患者毛細血管中還原 Hb 未達到出現紫紺的閾值,所以皮膚、黏膜顏色較為蒼白; HbCO 本身具有特別鮮紅的顏色, CO 中毒患者時,由於血液中 HbCO 增多,所以皮膚、黏膜呈現櫻桃紅色,嚴重缺氧時由於皮膚血管收縮,皮膚、黏膜呈蒼白色;高鐵 Hb 血症時,由於血中高鐵 Hb 含量增加,所以患者皮膚、黏膜出現深咖啡色或青紫色;單純的由Hb與O2 親和力增高時,由於毛細血管中脫氧Hb量少於正常,所以患者皮膚、黏膜無紫紺。
2.3 循環性缺氧 循環性缺氧( circulatory hypoxia )指組織血流量減少使組織氧供應減少所引起的缺氧,又稱為低動力性缺氧( hypokinetic hypoxia )。循環性缺氧還可以分為缺血性缺氧( ischemic hypoxia )和淤血性缺氧( congestive hypoxia )。缺血性缺氧是由於動脈供血不足所致;淤血性缺氧是由於
靜脈回流 受阻所致。
2.3.1 原因
循環性缺氧 的原因是血流量減少,血流量減少可以分為全身性和局部性二種。
(1) 全身性血流量減少
(2) 局部性血流量減少
2.3.2 血氧變化的特點
單純性循環障礙時,
血氧容量 正常; Pa O2 正常、CaO2正常、SaO2 正常。由於血流緩慢,血液流經毛細血管的時間延長,使單位容積血液彌散到組織氧量增加, C v O2 降低,所以 A-Vd O2 血氧差也加大;但是單位時間內彌散到組織、細胞的氧量減少,還是引起組織缺氧。局部性循環性缺氧時,血氧變化可以基本正常。
2.3.3 皮膚、黏膜顏色變化
由於靜脈血的 CvO2 和PvO2較低,毛細血管中脫氧 Hb可超過50g/L ,可引發皮膚、黏膜紫紺。
2.4 組織性缺氧 組織性缺氧( histogenous hypoxia )是指由於組織、細胞利用氧障礙所引起的缺氧。
2.4.1 原因
(1) 抑制細胞氧化磷酸化
細胞色素分子中的鐵通過可逆性
氧化還原反應 進行電子傳遞,這是細胞氧化磷酸化的
關鍵步驟 。以
氰化物 ( cyanide )為例,當各種無機或有機氰化物如:HCN 、 KCN 、 NaCN 、 NH4CN 和氫氰酸有機衍生物(多存在於杏、桃和李的核仁中)等經消化道、呼吸道、皮膚進入體內, CN- 可以迅速與細胞內氧化型
細胞色素氧化酶 三價鐵結合形成氰化高鐵細胞色素氧化酶( CNˉ+ Cytaa 3Fe3+ →Cyt aa 3Fe3+ -CNˉ ),失去了接受電子能力,使呼吸鏈中斷,導致組織細胞利用氧障礙。0.06gHCN可以導致人的死亡。高濃度 CO 也能與氧化型細胞色素氧化酶 aa 的Fe2+ 結合,阻斷呼吸鏈。
硫化氫 、砷化物和甲醇等中毒是通過抑制細胞色素氧化酶活性而阻止細胞的氧化過程。抗黴菌素 A 和苯乙雙胍等能抑制電子從細胞色素 b 向細胞色素 c 的傳遞,阻斷呼吸鏈導致
組織中毒性缺氧 。
引起線粒體損傷的原因有:強輻射、細菌毒素、
熱射病 、
尿毒症 等。線粒體損傷,可以導致組織細胞利用氧障礙和 ATP 生成減少。
(3) 呼吸酶合成障礙
維生素 B1 、 B2 、尼克醯胺等是機體能量代謝中輔酶的輔助因子,這些維生素缺乏導致組織細胞對氧利用和 ATP 生成發生障礙。
2.4.2 血氧變化的特點
組織性缺氧時,
血氧容量 正常, Pa O2 、CaO2、SaO2 一般均正常。由於組織細胞利用氧障礙(內呼吸障礙),所以 Pv O2 、 C v O2 、 S v O2 增高,( A-V ) d O2 小於正常。患者的皮膚、黏膜顏色因毛細血管內氧合 Hb 的量高於正常,故常呈現鮮紅色或玫瑰紅色。
各型缺氧的血氧變化特點 缺氧類型 缺氧類型 動脈氧分壓 血氧容量 動脈血紅蛋白氧飽和度 動靜脈血氧含量差 低張性缺氧
下降
不變
下降
下降或不變
血液性缺氧
不變
下降或不變
不變
下降
循環性缺氧
不變
不變
不變
上升
組織性缺氧
不變
不變
不變
下降
功能變化 機體吸入氧,並通過血液運輸到達組織,最終被細胞所感受和利用。因此,缺氧的本質是細胞對低氧狀態的一種反應和適應性改變。當急性嚴重缺氧時細胞變化以線粒體能量代謝障礙為主(包括組織中毒性缺氧);慢性輕度缺氧細胞以氧感受器的代償性調節為主。
3.1 代償性變化 3.1.1 缺氧時細胞能量代謝變化
(1) 無氧酵解增強:當 Pa O2 降低時,線粒體周圍的 P O2 低於 0.04 ~ 0.07kPa 時,氧作為有氧氧化過程的最終的電子接受者出現缺額,線粒體的有氧代謝發生障礙, ATP 生成減少,胞漿內 ADP 增加。胞漿內 ADP 增高可使
磷酸果糖激酶 、糖酵解過程加強,並在一定的程度上可補償細胞的能量不足,但酸性產物增加。
(2) 利用氧的能力增強:長期慢性和輕度缺氧時,細胞內線粒體數量增多,
生物氧化 還原酶(如
琥珀酸脫氫酶 、細胞色素氧化酶)活性增強和含量增多,使細胞利用氧的能力增強。
3.1.2 細胞的氧敏感調節與適應性變化
(1) 化學感受器興奮
(2) 血紅素蛋白( hemeprotein )感受調節:血色素蛋白是指含有卟啉環配體的一類蛋白質,如血紅蛋白、細胞色素aa3 、P450、含細胞色素 b 558 的輔酶 Ⅱ ( NADPH )氧化酶等。感受調節方式有兩種:
①構象改變 當 O2 結合於血紅素分子中央的Fe2+ ,引起Fe2+ 轉位到卟啉環平面上,反之相反。這種構象的變化可能影響血紅素蛋白的功能。例如:CO 與氧化型細胞色素氧化酶 aa 的Fe2+ 結合,使氧化型細胞色素氧化酶失去了傳遞電子的作用。
②信使分子 NADPH 氧化酶可與細胞周圍環境中 O2 結合,並把 O2 轉變為 O2- ,再生成 H2O2。H2O2 經過 Feton 反應轉變為
羥自由基 ( OH- )進行氧信號的傳導。正常時,細胞內 H2O2 濃度相對較高,抑制低氧敏感基因的表達。低氧時,細胞內 H2O2 和 OH- 生成減少,還原型谷光甘肽( GSH )氧化轉變成氧化型谷光甘肽( GSSG )受到抑制,導致某些蛋白巰基還原型增加,從而使一些轉錄因子的構象發生改變,促進低氧敏感基因的轉錄表達。
3.1.3 HIF-1 感受調節
研究認為, HIF-1 ( hypoxia induced factor-1 )是受控於氧濃度變化的一個至關重要的轉錄因子。細胞核內 HIF-1 作為低氧敏感基因的啟動子與靶基因的低氧反應元件( HRE,5-RCGTG-3 )結合,啟動基因轉錄和蛋白質翻譯。
3.1.4 紅細胞適應性增多
在高原居住的人和長期慢性缺氧的人,紅細胞可以增加到 6×106/㎜ 3 , Hb達21g/dl。其增加機制是,當缺氧時,低氧血可以刺激近球細胞,使其生成
促紅細胞生成素 ( erythropoiesis-stimulating factor,EPO )增加。EPO可以刺激RBC系單向乾
細胞分化 為原 RBC 和增殖、成熟。另外。EPO 可促使 Hb 合成和
網織紅細胞 進入血液,血中紅細胞和 Hb 增加,提高了血液中
血氧容量 。最終提高了血液攜帶氧的能力使氧含量增加,從而增強對組織器官的 O2 供應。
3.1.5 肌紅蛋白( Mb )增加
由於 Mb 與氧的親和力比 Hb 的大,如氧分壓降為 10mmHg 時, Hb 的氧飽和度約為 10% ,而 Mb 的氧飽和度可達 70% ,因此,當運動員進行劇烈運動使肌組織氧分壓進一步降低時, Mb 可釋放出大量的氧供組織、細胞利用。Mb 增加可能具有儲存氧的作用。
3.2 細胞損傷 缺氧性細胞損傷( hypoxic cell damage )常為嚴重缺氧時出現的一種失代償性變化。其主要表現為細胞膜、線粒體及溶酶體的損傷。
3.2.1 細胞膜變化
細胞膜電位降低常先於細胞內ATP含量的減少,膜電位降低的原因為細胞膜對離子的通透性增高,導致離子順濃度差通過細胞膜,繼而出現鈉內流、鉀外流、鈣內流和
細胞水腫 等一系列改變。
( 1 ) Na+ 內流:使細胞內 Na+ 濃度增多並激活 Na+ -K+ 泵,在泵出胞內 Na+ 同時又過多消耗 ATP , ATP 消耗又將促進線粒體氧化磷酸化過程和加重細胞缺氧。細胞內 Na+ 濃度過高必然伴隨水進入胞內增加引起細胞水腫。細胞水腫是線粒體、溶酶體腫脹的基礎。
( 2 ) K+ 外流:由於Na+-K+泵功能障礙,細胞外K+不能被泵到胞漿內,細胞內缺 K+ 導致合成代謝障礙,各種酶的生成減少並進一步影響 ATP 的生成和
離子泵 的功能。
( 3 ) Ca2+內流:細胞內外 Ca2+ 濃度相差約 1000 倍,細胞內低 Ca2+ 濃度的維持依賴膜上 Ca2+ 泵功能。嚴重缺氧時,由於 ATP 生成減少,膜上 Ca2+ 泵功能降低,胞漿內 Ca2+ 外流和肌漿網攝取 Ca2+ 障礙,使胞漿內 Ca2+ 濃度增高。細胞內 Ca2+ 增多並進入線粒體內抑制了呼吸鏈功能; Ca2+和鈣調蛋白( calmodulin )激活
磷脂酶 ,使膜磷脂分解,引起溶酶體損傷及其水解酶的釋放,細胞自溶;胞漿內 Ca2+濃度過高可以使
黃嘌呤脫氫酶 轉變為黃嘌呤氧化酶,增加
自由基 形成,加重細胞損傷。
3.2.2 線粒體的變化
缺氧可損傷線粒體,線粒體損傷又可導致缺氧,兩者互為因果。缺氧引起線粒體受損的原因是嚴重缺氧可明顯抑制線粒體呼吸功能和氧化磷酸化過程,使 ATP 生成更減少;持續較長時間嚴重缺氧,可以使線粒體的基質顆粒減少或消失,基質電子密度增加,脊內腔擴張,脊腫脹、崩解,外膜破裂等。
3.2.3 溶酶體的變化
缺氧時因糖酵解增強使乳酸生成增多和脂肪氧化不全使
酮體 增多,導致
酸中毒 。pH 降低和胞漿內鈣增加使磷脂酶活性增高,使溶酶體膜的磷脂被分解,膜通透性增高,溶酶體腫脹、破裂和釋出大量
溶酶體酶 ,進而導致細胞及其周圍組織的溶解、壞死。細胞內
水腫 、自由基的作用也參加溶酶體損傷機制。
代謝變化 缺氧對器官的影響,取決於缺氧發生的程度、速度持續時間和機體的功能代謝狀態。慢性輕度缺氧主要引起器官代償性反應;急性嚴重的缺氧,器官常出現代償不全和功能障礙,甚至引起重要器官產生不可逆損傷,導致機體的死亡。
4.1 呼吸系統的變化 4.1.1 代償性反應
4.1.1.1 呼吸加深加快
主要是低氧血症引起的呼吸運動增加使胸內負壓增大,促進了靜脈回流增加,增加
心輸出量 和肺血流量,有利於氧的攝取和運輸。
低張性缺氧所引起的
肺通氣 變化與缺氧持續的時間有關。
4000m 高原的空氣 PO2 為 100mmHg ,
肺泡 氣 P O2 為 55mmHg 左右。因此,在化學感受器的低氧感受下,
肺通氣量 立即增加,由於空氣稀薄, PCO2 也低, CO2 呼出增加(發生
呼吸性鹼中毒 和低氧血症), PaCO2降低,減低了對
延髓 的中樞化學感受器的刺激,限制肺的通氣量增加,所以,早期肺通氣量只比海平面高65% ;數日後,通過腎代償性排除 HCO3- ,
腦脊液 內的HCO3-也通過血腦屏障進入血液使腦組織中pH逐漸恢復正常,對延髓的中樞化學感受器的刺激抑制逐漸解除,肺的通氣量可增加至海平面的5-7 倍;長期居住者肺通氣量逐漸回落,至僅比海平面高 15% ,這可能與外周化學感受器對低氧的敏感性降低有關。這也是一種慢性適應過程,因為肺通氣每增加 1L ,呼吸肌耗氧增加 0.5ml ,所以長期呼吸運動增加顯然對機體不利。
4.1.2 呼吸功能障礙
高原
肺水腫 (high altitude pulmonary edema,HAPE),表現為呼吸困難、咳嗽、血性泡沫痰、肺部有濕性羅音,皮膚黏膜
發紺 等。其發病機制與以下因素有關:
①缺氧引起外周血管收縮,回心血量增加和肺血量增多,加上缺氧性肺血管收縮反應使肺血流阻力增加,導致
肺動脈高壓 。
②肺血管收縮強度不一使肺血流分布不均,在肺血管收縮較輕或不發生收縮的部位,肺泡毛細血管血流增加、流體靜壓增高,引起壓力性肺水腫。
③肺內血壓高和流速快對微血管的切應力(流動血液作用於血管的力在管壁平行方向的分力)增高。
④肺的微血管壁通透性增高,例如,補體 C3a 、 LTB4 和 TXB2 等血管活性物質可能導致微血管內皮細胞損傷和通透性增高。
肺水腫影響肺的換氣功能,可使PaO2 進一步下降,加重缺氧。PaO2 過低可直接抑制呼吸中樞,使呼吸抑制,肺通氣量減少,導致
呼吸衰竭 。
4.2 循環系統的變化 4.2.1 心輸出量增加
導致心輸出量增加的主要機制是:
①
心率 加快:當吸入含 8%O2 的空氣時,心率可增加一倍。認為,心率加快很可能是通氣增加所至肺膨脹對
肺牽張感受器 的刺激,反射性抑制
迷走神經 對心臟的效應;但呼吸運動過深產生過度牽張刺激使心率減慢和血壓下降。
③靜脈回流增加:缺氧時胸廓運動和心臟活動增強,胸腔內負壓增大,靜脈回流增加和心輸出量增加。
4.2.2 血液重分布
急性缺氧時,皮膚、腹腔內臟因交感神經興奮,縮血管作用占優勢,使血管收縮;而腦血管收縮不明顯;冠脈血管在局部代謝產物(如 CO2 、 H+ 、 K+ 、磷酸鹽、腺苷及 PGI 2 等)的擴血管作用下血流增加。這種全身性血流分布的改變,顯然對於保證生命重要器官氧的供應是有利的。
4.2.3 肺血管收縮(肺血管對缺氧的反應與體血管相反)
①
交感神經興奮 作用使肺血管收縮 急性缺氧時所致
交感神經興奮性 可作用於肺血管的α1 受體引起血管收縮反應。慢性低氧時肺內血管平滑肌出現受體分布的改變:α1 受體增加,β受體密度降低,導致肺血管收縮增強。
③血管平滑肌對低氧的直接感受。正如缺氧時細胞的代謝和功能變化一節所述,缺氧可直接通過肺血管平滑肌細胞膜上對氧敏感的鉀通道關閉,使細胞內 K+ 外流減少,膜電位下降,細胞興奮性增高、極化加速和細胞外 Ca2+ 內流增強,最終導致了肺血管收縮。
慢性缺氧除了肺血管收縮導致肺動脈高壓外,還有肺內血管壁中層平滑肌肥大、增厚以及彈力纖維和膠原纖維增生使血管的管徑變小、血流阻力增加。
4.2.4 毛細血管增生
組織細胞的長期輕度缺氧,可通過 HIF-1a 的低氧感受使細胞合成與釋放
VGEF 增多,毛細血管在缺氧的組織增生(見缺氧時細胞的代謝和功能變化)。這種現象在腦、肥大的心肌、實體腫瘤和骨骼肌中,毛細血管增生更加顯著。
4.3 血液系統的變化 缺氧可使骨髓造血增強和氧合血紅蛋白解離曲線右移。
4.3.2 氧合血紅蛋白解離曲線右移
缺氧時,紅細胞內 2,3-DPG 增加,導致氧合 Hb 解離曲線右移, Hb 易將結合的
氧釋放 出供組織利用。
( 1 )紅細胞內生成 2,3-DPG 增多的原因有兩個方面:
①低張性缺氧時氧合 Hb 減少,脫氧 Hb 增多,前者中央穴孔小,不能結合 2,3-DPG ;後者中央孔穴較大,可結合 2,3-DPG。當脫氧 Hb 增多時,紅細胞內游離的 2,3-DPG 減少, 2,3-DPG 對磷酸果糖激酶及二磷酸甘油變位酶( diphosphoglycerate mutase,DPGM )的抑制作用減弱,從而使糖酵解增強, 2,3-DPG 生成增多。
②低張性缺氧因代償性肺
過度通氣 引起呼吸性鹼中毒,以及缺氧時紅細胞記憶體在的大量脫氧 Hb 稍偏鹼性,使紅細胞內 pH 增高,從而激活磷酸果糖激酶和抑制 2,3-DPG
磷酸酶 ( 2,3-DPG phosphatase,2,3-DPGP )活性。前者使糖酵解增強, 2,3-DPG 合成增加;後者使 2,3-DPG 的分解減少。
( 2 ) 2,3-DPG 增多使氧合 Hb 解離曲線右移的機制是:
① 與 2,3-DPG 結合的脫氧 Hb 其空間構型較為穩定,不易於氧結合;
② 2,3-DPG 是一種不能透出紅細胞的有機酸,其增多可降低紅細胞內 pH , pH 下降通過 Bohr 效應使氧合 Hb 解離曲線右移。但是,當 Pa O2 低於 8kPa 時,氧離曲線右移可明顯影響肺部血液對氧的攝取。
4.3.3 血紅蛋白表型重建
4.4 中樞神經系統的變化 中樞神經系統是對缺氧最為敏感的器官,因為腦對氧的需求非常高。腦重量僅為體重的 2% ,而腦血流占心輸出量 15% ,腦耗氧量占總耗氧量 23% ,所以,腦對缺氧十分敏感,臨床上腦完全缺氧 5-8min後可發生不可逆的損傷。
急性缺氧可引起頭痛、情緒激動,思維力、記憶力、判斷力下降或喪失以及運動不協調等。嚴重缺氧可使腦組織發生
細胞腫脹 、變性、壞死及腦間質水腫等形態學變化,這與缺氧及酸中毒使腦微血管通透性增高引起腦間質水腫有關。這些損傷常常在缺氧幾分鐘內發生。且不可逆。腦血管擴張、
腦細胞 及腦間質水腫可使
顱內壓增高 ,由此引起頭痛、嘔吐、煩躁不安、驚厥、昏迷,甚至死亡。慢性缺氧則易疲勞、嗜睡、注意力不集中等症狀。
極嚴重缺氧可導致昏迷、死亡的發生機制是由於神經細胞膜電位降低,神經遞質合成減少;腦細胞能量代謝障礙, ATP 減少,細胞膜通透性增加;酸中毒,細胞內游離 Ca2+ 增多,溶酶體酶的釋放以及細胞水腫等因素導致引起
中樞神經系統 功能障礙 。
所謂高原
腦水腫 ( high altitude cerebral edema,HACE )發病機制除了缺氧引起腦血管擴張、腦血流增多外,可能還與下列因素有關。1 )腦細胞水腫; 2 )血腦屏障功能受損, 3 )腦靜脈內
血栓形成 ,進一步加重腦水腫形成。
治療方法 1.物理性制氧
通過分子篩的變壓吸附作用,在常溫下直接將空氣中的氧氣、氮氣分離,提取高純度
醫用氧氣 ,能實現持續不間斷的供氧。
該方法適用於中老年人、體質較差者、孕期婦女、高考學生、過度肥胖人士等存在不同程度生理性缺氧的人群,也可在重體力或腦力消耗後消除疲勞、恢復身體機能中起到一定的作用。
2.化學性制氧
利用化學物質發生的化學反應生成氧氣的原理,多採用二氧化錳和氯酸鉀。
制氧機供氧的方法多用於環境性缺氧症狀,改善外界環境的缺氧環境對身體的影響。
可根據自身情況選用不同的方法改善自身的缺氧狀況。
液體氧治療方法
使用生物有效氧溶液,繞過呼吸道,直接通過黏膜、消化道、皮膚等吸收補氧。該方法尤其適用於有
呼吸道疾病 的患者,缺氧需要補氧,但補氧不便的人群,如:高原旅遊人士等。這是補氧科技的里程碑,突破了補氧只能通過肺呼吸的生命瓶頸。