介紹
稀有氣體化合物指含有
稀有氣體元素的
化合物。由於稀有氣體元素原子外層為閉殼結構,化學性質不活潑,因此它們化合物的製備頗費了一些周折。
 四氟化氙晶體的圖片
四氟化氙晶體的圖片 廣義上看,稀有氣體化合物可以包括稀有氣體元素形成的眾多
包合物和
水合物,但現在一般認為1962年得的
六氟合鉑酸氙是最早製得的稀有氣體化合物,因為它的成功合成不僅意味著稀有氣體元素有可能形成化合物,而且極大推動了對稀有氣體化合物的系統研究。
氙的眾多簡單化合物也是在此不久之後發現。
製備歷史
稀有氣體是第
0族的元素,共包括
氦、
氖、
氬、
氪、
氙和
氡、以及最新合成的
Oganesson共七個。所有的稀有氣體元素外層s和p軌道都填充滿了
電子,氦有2個外層電子,其它的都為8個。它們的
電離能很高,
電子親合能幾乎為零,生成化合物的傾向很小。因此直到20世紀,化學家都認為稀有氣體化合物不存在,並將這些元素稱為“惰性氣體”。
然而,萊納斯·鮑林在1933年時預測,
原子序數較大的稀有氣體元素有可能與
氟和
氧生成化合物。他預言了六氟化氪和
六氟化氙的存在,提出八氟化氙可能是個不穩定的化合物,以及
氙酸會以
高氙酸鹽的形式成鹽。
現在看來,這些預測相當準確,只是八
氟化氙這個化合物不僅在
熱力學上不穩定,而且在
動力學上也不穩定。2006年時仍未製得。
在1962年以前,唯一可以分離出來的稀有氣體化合物都是
包合物,包括水合包合物。其它則是只有在光譜中才可觀測到的
配位化合物。
化合物
氦化合物
理論上一些氦化合物在低溫高壓下能穩定存在,可喜的是,最近一批可敬的中國學者將理論化為現實,氦鈉化合物橫空出世。
如果你還記得高中化學,那么可能知道氦的奇異特性。作為
惰性氣體,它是元素周期表中最不容易發生化學反應的元素。拜其“外殼”所賜,一般人們認為氦無法和其他原子發生作用從而創建穩定的化合物。
在極端壓力環境下,其他
稀有氣體已經顯示出形成化合物的能力。而氦至今仍是獨一無二地穩定。現在,這鐵一樣的規律已經被來自南開大學的王慧田、周向鋒團隊及其合作者打破。他們創造出了穩定的氦鈉化合物,而這已經撼動了現代化學的基本認知。該研究日前剛剛發表在《Nature Chemistry》。
我們知道,氦是宇宙中含量第二多的元素,是六種惰性氣體元素之一,很難與其他元素髮生作用。然而,在極端條件下,惰性氣體又可以分為兩類:其中氪、氙、氡相對活躍,而氬、氖、氦則非常冷漠。
此前,研究人員已經找到其他元素與氦進行配對的方法。但一直以來,都沒有形成什麼能夠穩定存在的物質。最常見的例子就是氦與其他元素的范德華力,無需共價鍵或者離子鍵就可以存在。在極低的溫度下,氦確實可以形成范德華力,但極其微弱,無法長久保持。
氦這種堅固的穩定力源於其閉殼層電子組態:其外殼層是完滿的狀態,沒有空間和其他原子通過共用電子進行結合。不過這是地球表面環境中的情況。
作為宇宙中第二豐富的元素,氦在恆星和巨型氣體行星的構成中起著重要作用。在外太空或者地球深處的極端條件下,它可能遵循著不同尋常的規律。如今,研究人員剛剛驗證這種奇異的現象。
猶他州立大學的文章共同作者Alex Boldyrev說:“極高的壓力,比如在地球的核心或者其他巨型星體中,能夠完全改變氦的化學特性。”
研究人員通過“晶體結構預測”模型進行演算發現,在極度的壓力之下,一種穩定的氦鈉化合物能夠形成。然後他們在金剛石壓腔實驗中真的創造出了前所未見的化合物:Na2He。實驗可以為氦和鈉原子提供相當於110萬倍地球大氣壓的條件。
這一結果太出人意料,因此發表的時候遇到了巨大的困難,研究人員花了兩年多的時間去說服審稿人和編輯。
基於這些結果,研究團隊預測,如果壓力達到他們實驗水平的一千萬倍,那么鈉將可以很容易地和氦氣反應生成穩定的Na2He。更為奇妙的是,這種化合物的構成並不需要任何化學鍵。
南開大學王慧田教授是本次研究的共同通訊作者,據他介紹:“所發現的化合物非常奇特:氦原子通常不會形成任何化學鍵,而新物質的存在從根本上改變了鈉原子間的化學相互作用,迫使電子集中在該結構的立方空間內,同時具有絕緣能力。”
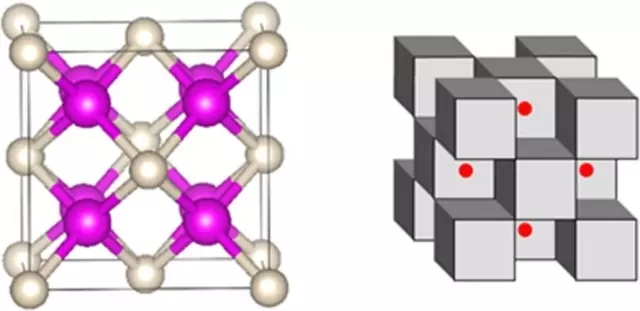
Na2He的晶體結構,由鈉原子(紫色)和氦原子(綠色)交替,共用電子(紅色)存在於其間的區域。
“這並不是真的化學鍵,”Popov說,“但是氦能夠使這一結構穩定存在。如果你把氦原子挪走,該結構將無法保持穩定。”
下面是該化合物的其他表現形式,左圖中粉色為鈉,白色為氦;右圖中鈉和氦成立方體狀,紅色的點則是電子。
亞晶格分析表明,He的占位導致電子被局域到了原子縫隙中並在Na原子核的引力下形成多中心鍵,從而整個體系變成了電子鹽體系。該過程中,孤立電子,Na的內層電子與He的內層1s電子和外層的2s,2p軌道產生強烈的交疊。受泡利不相容原理的影響,He的1s電子密度和外層電子軌道的分布被迫發生變化導致在Na2He形成過程中He得到了0.15個電子。該工作證實了高壓下He會具有弱的化學活性能夠與在高壓下還原性顯著增強的Na形成化合物。
雖然最近關於金屬氫的突破研究遇到很大的質疑,但這篇文章的數據要紮實很多。來自倫敦帝國學院的物理學家Henry Rzepa在把這項研究和金屬氫的發現對比時表示:“這是更為可靠的科學,氦化合物是一項重大突破。”
這一研究涉及中、美、俄、意、德五國學者。參與的中國研究單位還有北京高壓科學研究中心、西北工業大學、中科院固態物理研究所、和南京大學。特別值得一提的是,這一研究開始於南開大學研究生Xiao Dong在美國交換訪問期間,根據作者貢獻介紹,Xiao Dong設計了研究工作、並展開了相關計算。Xiao Dong目前已經在上海高壓科學研究中心工作。
氖化合物
(來自英文維基,其中Van der Waals Molecule不知如何翻譯,暫譯為范德華力分子,懷疑就是所謂包合物。)
低溫高壓下,氖可以與很多物質形成“范德華力分子”,例如NeAuF和NeBeS,原子被隔離在惰性氣體母體中。NeBeCO3固體可以在氖氣氛圍中利用紅外光譜法檢測到。它是由鈹氣體、氧氣和一氧化碳製得的。
與金屬形成的“范德華力分子”包括Ne-Li。
更多相似的的“范德華力分子”包括Ne-CF4和Ne-CCl4、Ne2-Cl2、 Ne3-Cl2、Nex-I2(x=1-4)、NexHey-I2(x=1-5,y=1-4)。
與有機分子,包括苯胺,二甲醚,1,1-二氟乙烯、嘧啶、氯苯、環戊酮、環丁腈和環戊二烯等也可形成所謂“范德華力分子”。
氖還可以作為一種配體,對過渡金屬原子形成非常薄弱的鍵,例如Cr(CO)5Ne、Mo(CO)5Ne和W(CO)5Ne。
氬化合物
氬已知唯一的化合物為
氟氬化氫,由馬庫·拉薩能領導的
芬蘭化學家團隊發現。
他們將
氬氣和
氟化氫在
碘化銫表面冷凍至-265°C,使氬氣凝華,然後再用大量的
紫外線照射氬(s)和氟化氫的
混合物,使之發生反應。經過
紅外光譜分析後,他們發現
氬原子已經和
氟原子、
氫原子產生
化學鍵,但該化學鍵非常的弱,只要溫度高於-256°C它就會再分解為氬和氟化氫。
氪化合物
氪與氟反應可得
二氟化氪。有報導稱二氟化氪與水在-30℃時反應得到2-3%的“氪酸”KrO
3·xH
2O,該溶液有氧化性,能將
碘離子氧化為碘單質,與
氫氧化鋇溶液反應得到產率7%的白色晶體“氪酸鋇”。這些報導可信度不高,後來也未能重現。在含放射性同位素
二氧化硒衰變產物中用光譜檢測到Kr-O鍵的存在,還沒有方法合成氧化氪。
氙化合物
氙在稀有氣體元素中是化合物最多的。
1962年,巴特列在研究無機
氟化物時,發現強氧化性的
六氟化鉑可將O
2氧化為O
2+。由於O
2到O
2+的電離能(1165kJ/mol)與Xe到Xe
+的電離能相差不大(1170kJ/mol),因此他嘗試用PtF
6氧化Xe。結果反應得到了橙黃色的
固體。巴特利特認為它是
六氟合鉑酸氙(Xe[PtF
6])。 這是第一個製得的稀有氣體化合物。後期的實驗證明該化合物
化學式並非如此簡單,包括XeFPtF
6和XeFPt
2F
11。
在成功合成六氟合鉑酸氙後,化學家又嘗試用類似的六氟化釕來
氧化氙。結果發現除了生成Xe(RuF
6)x外,還存在有氙和
氟氣直接生成二元氙氟化物的副反應。因此克拉森(Howard Claassen)通過讓氙和氟在高溫下反應,成功合成了
四氟化氙。
已經製得的、較重要的氙化合物包括:
氙的氟氧化物——XeOF
2、
XeOF4、XeO
2F
2、XeO
3F
2、XeO
2F
4二氟化氙可由Xe和F2混合氣暴露在陽光下製得。但有趣的是,1960年代之前的半個世紀中,卻沒有人發現僅僅混合這兩種氣體就有可能發生反應。
除此之外,化學家們還製得了一大批形式為XeOxY2的化合物,其中x = 1、2、3,Y是任何
電負性強的基團,比如-CF
3、-N(SO
2F)
2或-OTeF5。這類化合物範圍相當廣,可以有上千個之多,並且涉及氙和氧、氮、碳甚至金之間的
化學鍵。一同報導的還有
高氙酸、一些稀有氣體
鹵化物和
配離子。化合物Xe
2Sb
2F
11中含有目前已知最長的化學鍵,其中的Xe-Xe
鍵長308.71 pm。
氡化合物
氡可與氟反應生成
二氟化氡,在固態時會發出黃色光。它與
氙的相應化合物類似,但更穩定,更不易揮發。
包合物
稀有氣體
包合物在近幾十年曾被廣泛研究過,它們由於有可能用於儲存稀有氣體而引起了人們的興趣。在這些包合物中,稀有氣體原子基本上都是被包容在籠狀的主體分子中,即主體分子構成籠狀
晶格,將稀有氣體包藏在籠中。能否形成包合物主要決定於主體分子和客體分子間的幾何因素是否合適。例如,氬、氪和氙可以與β-
氫醌形成包合物,氦和氖卻因為體積太小而無法包合在內。
稀有氣體包合物中,研究較多的主體分子是
水、氫醌、
苯酚和氟代苯酚。
包合物可以用來從稀有氣體中分離出He和Ne,及運輸Ar、Kr和Xe。此類化合物亦可用作
放射源,Kr的包合物是
β粒子的安全來源,Xe的
包合物則是
γ射線的來源。
配位化合物
曾經一度認為諸如Ar·BF
3之類的
配位化合物可在低溫下存在,但始終未經實驗驗證。並且,有報導稱化合物WHe
2和HgHe
2可由電子轟擊製得。然而最近的研究表明,它們並不是真正的化合物,He很有可能只是被金屬表面吸附。
水合物
水合物可由將稀有氣體壓入水中製得。有理論認為,強極性的
水分子使稀有氣體原子產生誘導偶極,產生
偶極-偶極作用力。因此
原子序數較大的稀有氣體所形成的水合物,如Xe·6H2O,比原子序數小的稀有氣體元素形成的要更加穩定。但2010年來對於這些化合物是否存在產生了疑問。
內嵌富勒烯型包合物
稀有氣體原子可以被包覆在
富勒烯分子中,形成多種多樣的
內嵌富勒烯型包合物。它們首先在1993年合成。用C
60與He或Ne在3bar壓力下反應,得到的大約650000個富勒烯分子中,只有一個可以與稀有氣體原子形成
包合物He@C
60或Ne@C
60;壓力增大至3000bar時,
產率增至0.1%。
氫合離子
He,Ne,Ar(Kr,Xe,Rn尚未發現)與質子在一定條件下均可製取相應的氫合離子(一種神奇的
鎓離子),存在於氣態中,通過紅外光譜觀測到。
氦合氫離子(HeH
+)首次發現於1925年,是已知最強的酸,質子親和能為177.8kJ/mol。有人認為,這種物質可以存在於自然星際物質中。這是最簡單的異核離子,它有一個永久的鍵
偶極矩,使它更容易表現出光譜特徵。
雖然不同於氦合氫離子,氫和氦構成的
中性分子在
基態不穩定,但它們的
激發態可以作為準分子存在,20世紀80年代中期首次在光譜中觀測到。
套用
稀有氣體化合物主要被用作
氧化劑。這一類型的試劑包括:
氙酸、
高氙酸鹽、
三氧化氙。它們被稱為所謂“綠色氧化劑”,所參與的反應中,最終
還原產物是氣態的稀有氣體,不會干擾反應,而且比較容易分離。受氧化性影響,氙
氟化物容易放出氟,是有機化學中比較新穎高效的氟化試劑,以
二氟化氙的用途最廣。氙元素穩定的鹽中氟和氙的
質量分數非常高,比如七氟合氙(VI)酸
四氟銨(NF
4XeF
7)以及類似的(NF
4)
2XeF
8已經被用作
火箭推進劑中的高能氧化劑。
由於氪和氙的放射性
核素不易儲存,因此常將它們以相應化合物的形式來存放及使用。
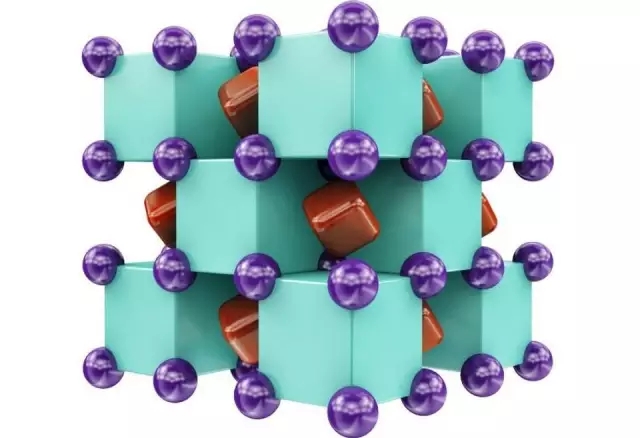

 四氟化氙晶體的圖片
四氟化氙晶體的圖片