基本介紹
- 中文名:相態
- 別名:物態
- 釋義:物質的形態
- 定義:指巨觀物理系統具有的一組狀態
簡介,形成和萬能性,定義,相圖,相態的分離,
簡介
物質在一定溫度、壓強下所處的相對穩定的狀態。物質聚集狀態的簡稱,也稱聚集態。氣態、液態、固態是物質三態,相應的物質分別稱為氣體、液體、固體。它們是以分子或原子為基元的3種聚集狀態。水汽、水 、冰是常見的同一物質的三態;氧、氫、氦等在常溫下是氣態,只在極低溫度下才是液態或固態;金、鎢等在常溫下是固態,只在極高溫度下才是液態或氣態,固態物質的分子或原子只能圍繞各自的平衡位置微小振動,固體有一定的形狀、大小;液態物質的分子或原子沒有固定的平衡位置,但還不能分散遠離,液體有一定體積,形狀隨容器而定,易流動,不易壓縮;氣態物質
 相態
相態的分子或原子作無規則熱運動,無平衡位置,也不能維持在一定距離,氣體沒有固定的體積和形狀,自發地充滿容器,易流動,易壓縮。
除上述三態外,在極高溫下電離的氣體成為由離子和電子組成的電漿,稱為物質第四態。這是宇宙中普遍存在的物質聚集狀態。在超高壓、超高溫下原子結構被破壞,原子外圍的電子被擠壓到原子核範圍,這種狀態稱為超固態 ,亦稱物質第五態。
形成和萬能性
相態的另一個特性是它的萬能性。不論一個巨觀系統下的微觀系統是怎樣組成的,它們的相態有非常類似的特性。比如鐵和冰都是固態的,雖然從微觀結構來說冰和鐵的結構非常不同,但它們的固態都具有類似的特性,比如保持它們的形狀。
定義
對自由能的分析
雖然相態的概念從表面上來看非常簡單,但要對它作一個精確的定義卻很困難。一個比較好的定義是一個相態是一個在其範圍內其熱力學參數的自由能在參數空間中的函式是解析的。這個定義實際上就是說,假如兩個系統是同一個相態的話,那么在從一個系統轉換到另一個系統的時候它們的熱力學參數不會突然改變。
假如一個系統從一個相態演變為另一個相態,那么在這個過程中總會有一個階段里自由能是不解析的。這個過程被稱為相變。最常見的相變有溶化(從固態到液態)、凍結(從液態到固態)、沸騰(從液態到氣態)和凝結(從氣態到液態)。由於自由能在這個過程中是不解析的,因此在這個過程的兩邊它是兩個完全不同的函式。兩個相態中熱力學的參數也完全不同。最顯著的是熱容量,在相變過程中熱容量可以達到無窮大,從一個值跳到另一個值。
相關的熱力學參數
實際上每個相態與另一個相態之間總有一些相關的熱力學參數非常不同。比如固體比液體要堅固得多,固體不象液體或氣體那樣,它可以保持它的形狀。而液體則比氣體的壓縮性小得多。在一個大的容器中,氣體可以充滿整個容器,而液體則只占據一小部分。固體、液體和氣體之間也有許多相同的熱力學特性,比如它們的磁特性。但一個物質的鐵磁態和順磁態之間最大的區別就是它們的磁特性了。
亞穩定的相態
亞穩定的狀態有時也被看作是相態,但精確地說它們並非相態,因為它們不穩定。比如一些同素異形體只有在一定的條件下才穩定。取以上提及的碳為例,鑽石只有在高壓下才真正穩定。在一般的大氣壓和溫度下鑽石會緩慢地轉變為石墨。但這個過程非常緩慢,因此在常溫和常壓下鑽石是一種亞穩定的狀態。假如溫度加高的話,這個轉化的過程就會加快。
相圖
相圖上的線被稱為“相界”,這是自由能不解析的地方,或者說相變發生的地方。而沒有線的地方則是自由能解析的地方。這些地區屬於同一個相態。有些相態的相界不是在一切情況下都存在的。比如在647K和22.064兆帕斯卡以上水的液態和氣態無法區分,液態和氣態的相界在這個點就中斷了。
相態的分離
在同一個系統中不同的相態可以同時存在。一般來說它們之間有分明的邊界。 相態
相態
 相態
相態 相態
相態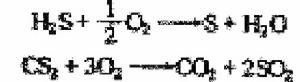 相態
相態 相態
相態 相態
相態