疾病分類 朗格漢斯細胞組織細胞增多症(Langerhans’cell histiocytosis,LCH)是以大量朗格漢斯細胞增生、浸潤和肉芽腫形成,導致器官功能障礙為特徵的一組疾病。。LCH通常累及的器官包括骨骼(特別是顱骨和中軸骨)、肺臟、中樞神經系統(特別是下丘腦區域)以及皮膚,以受累器官的數量進行分類(表4-28-1)。根據受累器官數目的多少,LCH可以分為兩大類:單器官受累和多系統受累(表1)。前者通常僅伴有單個器官的受累(如肺、骨、皮膚),多見於成人,預後較好;後者大多累及多個系統如累-賽病(Letterer-Siwe disease)、漢-許-克綜合徵(Hand-Schüller- Christian disease),好發於兒童,預後較差。PLCH是指朗格漢斯細胞僅累及肺臟或者是肺臟作為多系統受累的其中一個器官的疾病,其發展經過和預後不同於多個系統受累的LCH。
表1 成人朗格漢斯細胞組織細胞增多症的簡要分類
單器官受累
多系統受累
- 肺臟(占肺臟受累病例的85%以上)
- 多器官疾病伴肺臟受累(占肺臟受累病例的5%~15%)
發病原因 PLCH的發病與菸草暴露密切相關,絕大多數(90%-100%)的PLCH患者都有吸菸史,特別是吸菸大於20包年者。過去認為男性發病率高於女性,近年的研究發現,PLCH在男女之間的發病率並沒有明顯的差異,這種差異可能與女性吸菸者人數上升有關。多數PLCH患者是重度吸菸者,但吸菸史較短的患者也可以發生PLCH。戒菸後PLCH患者的胸部影像可以好轉,終末期PLCH接受肺移植的患者,如果繼續吸菸,PLCH可能再發。儘管PLCH發病與菸草暴露有關,吸菸量與PLCH疾病的嚴重程度沒有相關性。個案報導,PLCH在淋巴瘤放療和(或)化療後也可以發病。絕大多數PLCH是散發病例,也有個別LCH家族病例的報導,其發病與基因的相關性,尚不清楚。目前沒有證據表明職業或地理因素與PLCH發病有關。除菸草外,病毒等外源性物質在PLCH的發病中有無作用,目前尚不明確。
PLCH相關圖片 發病機制 蛙皮素假說(bombesin hypothesis)認為蛙皮素樣肽類生成的增加對PLCH發病起作用。蛙皮素是一種神經內分泌細胞產生的神經肽,在吸菸者的肺臟中生成增加。蛙皮素樣肽類對單核細胞有化學趨化作用,促使上皮細胞和成纖維細胞有絲分裂,刺激細胞因子分泌。菸草吸入能夠使氣道神經內皮細胞釋放蛙皮素樣多肽(bombesin-like peptides,BLP)蛙皮素多肽進一步激活肺泡巨噬細胞,釋放細胞因子,如腫瘤壞死因子(TNF-α)、粒細胞-巨噬細胞集落刺激因子(GM-CSF)或其它介質,可能會增強朗格漢斯細胞的募集和活化。同時蛙皮素多肽還能刺激成纖維細胞的增殖,促進肺纖維化的形成。煙霧中的其它抗原,如菸草糖蛋白(tobacco glycoprotein,TGP),是一種免疫刺激劑,能夠誘導淋巴細胞的增值和淋巴因子的產生。菸草中的尼古丁可以使樹突狀細胞的吞噬活動明顯降低,抑制樹突狀細胞產生前炎症因子(特別是IL-12),降低樹突細胞誘導T細胞分化為T輔助細胞1型的能力。
PLCH肺組織中調節白細胞和內皮細胞相互作用的粘附分子的表達發生了改變。PLCH患者的肺組織中可見LCs的細胞間粘附分子-1表達,以及其它白細胞粘附分子,如β1和β2整聯蛋白的表達。這些發現的重要性及其與PLCH的相關性仍有待闡明。
此外,PLCH可能與惡性腫瘤有關。淋巴瘤,包括霍奇金淋巴瘤和非霍奇金淋巴瘤,均報導與PLCH有關。
病理表現 PLCH的病理學特徵是朗格漢斯細胞呈特徵性的成簇出現,數目明顯增多,主要分布在小氣道周圍,其形態與正常組織所見相似,細胞漿呈弱嗜伊紅染色,有明顯的溝狀核膜(圖1)。在福馬林固定石蠟包埋的組織切片中,朗格漢斯細胞漿S-100(圖2a)和細胞表面CD1a(圖2b)呈陽性。電子顯微鏡下,朗格漢斯細胞內可見五層棒狀的特殊結構,稱為Birbeck顆粒。
PLCH肺臟大體標本表現為雙肺散在的結節伴不同程度的囊腔樣改變。也可見支氣管內的腫塊,單結節病變罕見。雙上中肺葉受累顯著,肺底部通常不受累。結節的形狀不規則,邊緣呈星狀。終末期表現為緻密的纖維化和囊腔改變,呈蜂窩肺。在疾病進展過程中,病理表現依次為:結節、囊性結節、厚壁囊腔、薄壁囊腔。
低倍鏡下,相對正常的肺組織中散在以細支氣管為中心的星狀間質性結節是PLCH的主要組織病理學特徵,病變時相不均一,結節、囊腔和纖維斑痕同時存在(圖3)。結節和囊腔也可以沿著胸膜和小葉間隔分布。多數病例可見直徑為1mm~5mm結節。結節包含著混合的細胞群,有不同數量的朗格漢斯細胞、嗜酸粒細胞、淋巴細胞、漿細胞、成纖維細胞和胞漿含有煙塵顆粒的巨噬細胞。隨著疾病進展,結節逐漸減少,囊腔逐漸增多,終末期朗格漢斯減少或消失,可見間質纖維化和小囊腔形成,病變廣泛地擴展至肺臟實質,包繞支氣管血管結構,形成所謂星形損害的疾病特徵性病變。結節和囊腔周圍的肺臟可見吸菸所致的呼吸性細支氣管炎伴間質性肺疾病(RB-ILD)和脫屑性間質性肺炎(DIP)樣反應,即肺泡腔內吸菸者肺泡巨噬細胞的聚集。肺氣腫也比較常見。胸部影像中的結節影對應的組織病理改變為星狀間質性結節,囊腔影為擴張的細支氣管。
發生氣胸時,可以出現反應性嗜酸粒細胞胸膜炎,可見間皮細胞增生、慢性炎症和嗜酸粒細胞浸潤,為非特異性。終末期PLCH患者伴有肺動脈高壓,主要與肺小動脈和肺小靜脈受累有關,血管壁可見中膜增厚和內膜增生,肺朗格漢斯細胞可能通過產生細胞因子和生長因子參與肺血管的重建。
臨床表現 PLCH的臨床表現存在很大的差異,1/4的患者沒有呼吸道症狀,因而容易漏診,如果出現症狀,最常見的是乾咳和活動後呼吸困難。約1/3的患者伴有全身症狀,如消瘦、乏力、發熱、盜汗和食慾減退。當患者出現全身症狀時,應注意檢查是否合併潛在的腫瘤。約10%的患者由於胸膜下囊腔破裂導致自發性氣胸,可以是本病的首發症狀。胸痛並不常見,在疾病發展過程中,約1/5的患者出現胸痛,雖然疾病累及肋骨可以出現胸痛。咯血少見,僅見於5%的PLCH患者,大多數並非由PLCH引起,提示可能合併肺真菌球或肺癌。5%-15%的患者因為朗格漢斯細胞累及其他器官或系統,從而出現相應的症狀,如累及肝或脾,可能出現腹部不適;累及表淺淋巴結,相應淋巴結腫大;累及下丘腦,可能出現煩渴、尿崩。體格檢查肺臟多無異常發現,杵狀指少見。終末期患者可見肺動脈高壓和肺心病的體徵。
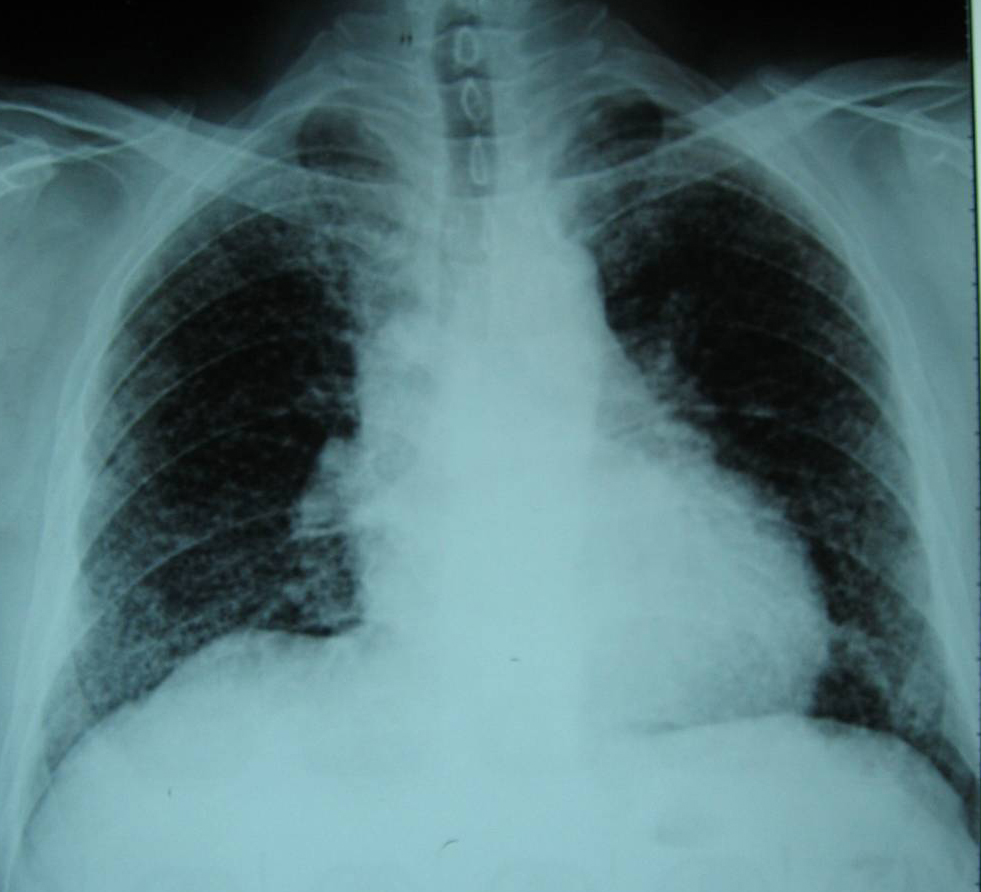
輔助檢查 1、胸片 PLCH早期,胸片表現為雙肺邊界不清的微結節或網結節浸潤,以中上肺為著,肋膈角通常不受累(圖4a)。囊狀改變是疾病特徵性的改變,可以與結節同時存在。PLCH終末期,可見多個直徑在2cm以上相鄰的囊腔,不易與肺氣腫或淋巴管平滑肌瘤病(LAM)相鑑別。PLCH胸片可見氣胸,極少數病例可見肋骨的溶骨性損害。胸腔積液和肺門淋巴結腫大罕見。合併肺動脈高壓時,胸片示右下肺動脈乾增寬,肺動脈段膨隆,以及右心室擴大(圖4b)。少數早期患者(<10%)胸片正常。
2、胸部HRCT 胸部HRCT具有特徵性表現和分布特點,是PLCH臨床診斷的重要依據。早期病變以小葉中心性結節為主,伴少量囊腔改變(圖5)。隨著疾病進展,出現囊腔、纖維化和蜂窩肺。囊腔改變是相對較晚的病變,囊壁厚薄不規則、直徑大小不一,呈瀰漫性分布,以中上肺野為著(圖6)。晚期可以出現遍布全肺的囊腔影。PLCH患者肺部病變呈現從結節到囊性結節、厚壁囊腔、再到薄壁囊腔的變化規律。
3、肺功能 一氧化碳彌散量(DLCO)下降見於60%~90%的患者。常見肺活量(VC)和肺總量(TLC)降低,殘氣量(RV)與TLC比值增高。20%~30%的患者有氣流受限,第1秒用力呼氣容積(FEV1)與肺活量(VC)的比值降低。疾病終末期,少數患者表現為限制性通氣功能障礙和彌散障礙。10%~15%的患者靜息肺功能正常。動脈血氣分析與肺臟受累的程度有關。
4、支氣管鏡和支氣管肺泡灌洗 支氣管鏡下氣管、支氣管無異常表現,或氣管-支氣管黏膜呈現與吸菸相關的非特異性炎症改變。支氣管黏膜活檢對診斷沒有幫助,但有益於排除其他診斷。由於肺臟病變呈灶狀分布,經支氣管透壁肺活檢(TBLB)診斷率較低(10%~40%),而且PLCH肺臟呈囊腔病變,增加了並發氣胸的風險。支氣管肺泡灌洗液(BALF)細胞分析有助於診斷和鑑別診斷,BALF中CD1a(OKT6)陽性的朗格漢斯細胞大於5%(正常小於1%),結合胸部影像可以提示PLCH的診斷,但敏感性較低(25%~50%),因為在很多疾病中,BALF中CD1a陽性細胞呈不同程度的增高(2%-5%)。值得注意的是,胸部影像正常的吸菸者,BALF中CD1a陽性的細胞可以達到3%。BALF分析有助於鑑別結節病、過敏性肺炎、肺結核、肺癌和肺泡出血等瀰漫性肺疾病。
5、外科肺活檢 外科肺活檢取得的肺組織確切,具有較高的診斷價值。雖然外科肺活檢是疾病診斷的金標準,但是有一定的創傷性,如果掌握臨床表現和典型的影像學資料,可以做出臨床診斷,避免外科肺活檢。
6、實驗室檢查 不具有特異性,外周血嗜酸粒細胞、免疫球蛋白、自身抗體,以及血清血管緊張素轉換酶通常在正常範圍。
疾病診斷 中青年吸菸者,胸部HRCT表現為雙肺瀰漫的結節和囊腔影,以上中肺野為著,不累及肋膈角,結合BALF中CD1a陽性的朗格漢斯細胞大於5%,可以臨床診斷為PLCH。由於TBLB取得的組織塊小,診斷陽性率低,對於臨床不能明確診斷的病例,通常需要採取外科肺活檢。肺臟組織病理顯示典型的以細支氣管為中心的星狀間質性結節和囊腔,肺朗格漢斯細胞CD1a和S-100染色陽性,可以診斷。診斷PLCH的患者,還需要檢查肺外器官受累情況,如髖骨(圖7)、皮膚、垂體、淋巴結、甲狀腺、肝臟和脾臟等。如果患者沒有菸草暴露史,通常不能診斷PLCH。
疾病治療 1、戒菸 戒菸是首要的治療措施,50%~75%的患者在戒菸後6~24個月病情穩定或好轉,症狀緩解,影像學病變部分或完全消失(圖8a,b)。同時,戒菸也可以減少罹患肺癌、慢性阻塞性肺疾病、心腦血管疾病的風險。
2、糖皮質激素 有全身症狀,影像學或肺功能惡化者,可以經驗性套用糖皮質激素。強的松的初始劑量為每天0.5 mg/kg~1 mg/kg,之後逐漸減量,連續服用6~12個月。但激素的療效,尚未得到證實。
3、細胞毒藥物 細胞毒藥物如長春新鹼、甲氨蝶呤、環磷醯胺、依託泊甙和克拉屈濱可以用於戒菸後無緩解或對激素治療沒有反應的多器官受累患者。細胞毒藥物的療效尚不清楚。
4、肺移植 終末期PLCH患者伴嚴重呼吸衰竭或肺動脈高壓者,應該考慮肺移植。肺移植前,患者必須戒菸;肺移植後,如果患者再次吸菸,移植肺仍有可能再發PLCH。
疾病預後 疾病的自然病程和預後個體差異較大,約50%的患者預後好,症狀及影像學呈現部分或完全緩解,30%~40%的PLCH患者病情逐漸持續進展,10%~20%的患者症狀漸進性嚴重,如反覆發生氣胸,合併呼吸衰竭和肺動脈高壓。PLCH預後不良的因素包括發病年齡高、全身症狀持續存在、反覆發生氣胸、肺外受累、肺臟瀰漫性囊腔改變,以及合併肺動脈高壓。1年、2年和5年的生存率分別為63.6%、57.2%和53.7%,移植肺臟後20%(8/29例)再發PLCH,吸菸和肺外受累可能是復發的危險因素。
疾病預防 PLCH是一種吸菸相關的間質性肺疾病,不吸菸或者戒菸,可以預防PLCH的發生。
 PLCH相關圖片
PLCH相關圖片