介紹
體外定點突變技術是當前生物、醫學各領域研究中的一種重要實驗手段,是改造、最佳化基因的便捷方案,是探索啟動子調節位點的有效手段,也是研究
蛋白質結構和功能之間的複雜關係的有力工具。
蛋白質的結構決定其功能,二者之間的關係是
蛋白質組研究的重點之一。對某個已知
基因的特定
鹼基進行定點改變、缺失或者插入,可以改變對應的
胺基酸序列和蛋白質結構,對突變基因的表達產物進行研究有助於人類了解蛋白質結構和功能的關係,探討蛋白質的結構/
結構域。而利用定點突變技術改造基因:比如
野生型的
綠色螢光蛋白(wtGFP)是在
紫外光激發下能夠發出微弱的綠色
螢光,經過對其發光結構域的特定胺基酸定點改造,GFP能在
可見光的
波長範圍被激發(吸收區紅移),而且發光強度比原來強上百倍,甚至還出現了黃色螢光蛋白,藍色螢光蛋白等等。定點突變技術的潛在套用領域很廣,比如研究蛋白質相互作用位點的結構、改造酶的不同活性或者動力學特性,改造啟動子或者DNA作用元件,引入新的酶切位點,提高蛋白的抗原性或者是穩定性、活性、研究蛋白的晶體結構,以及藥物研發、基因治療等等方面。
 定點突變
定點突變單點突變
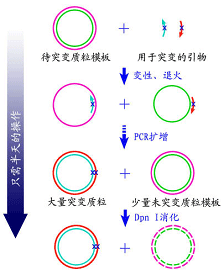
對於單點突變,Stratagene公司的QuikChange Site-directed Mutagenesis kit是不錯的選擇,通過巧妙設計,將
質粒定點突變技術變得簡單有效。準備突變的
質粒必須是從常規E.coli中經純化
試劑盒(Miniprep)或者
氯化銫純化抽提的
質粒。設計一對包含突變位點的
引物(正、反向),和模版
質粒退火後用PfuTurbo
聚合酶“循環延伸”,(所謂的循環延伸是指聚合酶按照模版延伸引物,一圈後回到引物5’端終止,再經過反覆加熱褪火延伸的循環,這個反應區別於
滾環擴增,不會形成多個串聯拷貝。)正反向
引物的延伸產物退火後配對成為帶缺刻的開環
質粒。DpnI酶切延伸產物,由於原來的模版
質粒來源於常規大腸桿菌,是經dam
甲基化修飾的,對DpnI敏感而被切碎(DpnI
識別序列為甲基化的GATC,GATC在幾乎各種
質粒中都會出現,而且不止一次),而體外合成的帶突變序列的質粒由於沒有甲基化而不被切開,因此在隨後的轉化中得以成功轉化,即可得到突變質粒的克隆。這個試劑盒非常巧妙的利用
甲基化的模版質粒對DpnI敏感而合成的突變質粒對DpnI酶切不敏感,利用酶切除去模版質粒,得到突變質粒,使得操作簡單有效。另外由於Pfu
聚合酶是公認的最好的高保真聚合酶之一,堪稱高保真聚合酶的“黃金標準”,是Stratagene的看家之寶,能夠有效避免延伸過程中不需要的
錯配。試劑盒採用的是低次數的循環延伸而非PCR,有助於減少無意
錯配。只需要一次酶切和轉化,實驗可以在一天完成。這個試劑盒適用於
質粒大小不超過8Kb的質粒。後來推出的QuikChange XL site-directed mutagenesis kit則是針對大於8Kb的
質粒的定點突變的,通過最佳化試劑特別是其
感受態細胞(XL10-Gold),使得較大的質粒的定點突變也一樣簡單。QuikChange由於操作簡單快速,效率高( >80%)而受到普遍歡迎,光是2012年的前9個月就有超過400篇發表的論文中用到這個產品。
定點突變的比較有特色的產品還有Clontech公司的Transformer Site-Directed Mutagenesis Kit,需要根據準備突變的
質粒自行設計兩條
引物(同一方向,對同一單鏈模版),一條包含計畫定點突變的序列,另一條引物包含質粒上某一個單
酶切位點,不過在單酶切位點中引入突變,這樣兩條引物除了所包含的突變位點,其他序列和質粒上對應位置的序列完全一致,退火後和質粒模版結合,通過T4 DNA聚合酶延伸,延伸反應持續直到碰到另一條引物停止,兩段包含突變位點的延伸產物經T4連線成環,和模版鏈組成雜和環,帶有兩處
錯配。單酶切反應產物,直接轉化Ecoli BMH 71-18 mutS(
錯配修復缺陷株)。原來的
雙鏈質粒模版被切開而不能轉化,而雜和質粒由於一條鏈上單酶切位點引入突變而不被切開,保持環狀質粒得以轉化。
轉化子的雜和雙鏈在E.coli的複製過程中分開,再經過一輪提質粒、單酶切、轉化,最後得到純和的突變質粒。這個試劑盒則是利用改造單酶切位點使得新合成的突變質粒不被切開從而除去原來的模版質粒。雖然這個試劑盒比上一個麻煩,但實際上是引入了兩個定點突變。只不過一個用於酶切除掉模版的反應。
多點突變
原理
有的時候研究可能需要多個位點的定點突變,比如改造酶的活性或者動力學特性,研究蛋白之間的相互作用位點等,單點突變不能滿足實驗的需要,重複進行單點突變也非常浪費時間。因而Stratagene公司又推出了QuikChange Multi Site-Directed Mutagenesis kit。最多一次實驗可以引入5個定點突變。這個試劑盒的原理和Clontech的相似,就是準備多個帶突變的引物(同方向,對同一單鏈模版),退火後全部突變引物(不超過5個)都結合在同一環狀單鏈模版,PfuTurbo
聚合酶延伸,碰到下一個引物就停止,各片斷經連線成環,和單鏈模版組成雜和環,DpnI消化
雙鏈模版,也消化雜和環中的模版,只留下新合成的帶多個突變的單鏈環(mutant ssDNA),得以轉化E.coli,形成雙鏈
質粒。資料表明,引入3個定點突變的效率為60%,5個定點突變的效率為30%。得到的其他質粒是帶有較少定點突變的質粒,以引入3個定點突變為例,就是有40% 左右的轉化質粒是帶有1—2個不同定點突變的質粒(因為存在1—2個引物結合模版延伸形成單鏈環的可能)。這樣,一次實驗可以得到不同數目突變的質粒,對於研究蛋白質結構和功能的關係也是有用的。
前景
不同於定點突變的是基於PCR的隨機突變,通過改變PCR條件提高PCR過程中的隨機出錯,這種方法適用於未知的蛋白質,作全局性分析,所以有人稱為飽和突變(saturation mutagenesis)。不過這種方法由於沒有目的性,分析操作相當繁瑣,並且不會出現一個位點2個以上鹼基突變,因而套用上有局限性。定點突變適用於蛋白結構已有初步了解的
基因,比PCR隨機突變更有目的性,也更為精確,簡單,同時改造基因更加“隨心所欲”。由於定點突變技術在
蛋白質組學中有這非常廣泛的套用前景,相信這個技術在不遠的將來還會有更大的改進和發展,也必將為更多人熟悉套用。
流程
定點突變一般須有含有待突變
基因的高純度質粒,不少於10μg,電泳圖清晰,達酶切及測序要求;
2.根據突變方案設計合成覆蓋突變位點的雙向引物,合成目的DNA兩端引物,進行高保真PCR反應;
3.默認情況下,將PCR產物克隆至T載,或者根據要求
亞克隆至目的載體;DNA測序驗證突變序列的正確性。
意義
根據生物學理論知識,基因會發生突變,突變可以自發,也可以誘發。但在加拿大生物化學家M·
史密斯(1932-2000年)發明定點突變法之前,
突變株的產生必須經由
自然界或用化學等方法誘使基因體突變。這類方法屬於隨機突變,
突變株必須在生物形狀上有所改變,才能確定有突變發生,但除非用分子生物方法或遺傳方法找到此突變處,否則無法確定突變位置。也就是說,這種突變是盲目的。而史密斯發明的定點突變法卻是有目的的,該法可經由設計好的寡核苷酸,在任何一個基因片段上進行隨意或設計好的突變,也就是說,這種突變是預先設定好的,所以也有人將該法稱為“反遺傳法”。
用途
有意思的是這一給生命科學研究及套用領域帶來革命性突破的方法竟然是史密斯和其同事在喝咖啡時閒聊出來的。幾乎每個生物實驗室都會用定點突變法來研究基因或蛋白質的功能。定點突變法的套用不僅廣泛用於基因工程技術領域,還可用於農業培育抗蟲、抗病的良種,用於醫學矯正遺傳病、治療癌症等病。
 定點突變
定點突變
 定點突變
定點突變