離域現象
H
2C=CH
2,
π鍵的兩個
π電子的運動範圍局限在兩個
碳原子之間,這叫做定域運動。CH
2=CH-CH=CH
2中,可以看作兩個孤立的雙鍵重合在一起,π電子的運動範圍不再局限在兩個碳原子之間,而是擴充到四個碳原子之間,這叫做離域現象。
 共軛效應
共軛效應如圖,這種分子叫
共軛分子。共軛分子中任何一個原子受到外界試劑的作用,其它部分可以馬上受到影響。
特點
沿共軛體系傳遞不受距離的限制。
共軛效應,由於形成共軛π鍵而引起的分子性質的改變叫做共軛效應。共軛效應主要表現在兩個方面。
①共軛能:形成共軛π鍵的結果使體系的能量降低,分子穩定。例如CH2=CH—CH=CH2共軛分子,由於π鍵與π鍵的相互作用,使分子的總能量降低了,也就是說, CH2=CH—CH=CH2分子的能量比兩個不共軛的CH2=CH2分子的能量總和要低。所低的數值叫做共軛能。
②鍵長:從電子云的觀點來看,在給定的原子間,電子云重疊得越多,電子云密度越大,兩個原子結合得就越牢固,鍵長也就越短,共軛π鍵的生成使得電子云的分布趨向平均化,導致共軛分子中單鍵的鍵長縮短,雙鍵的鍵長加長。
共軛效應是
電子效應的一種。組成共軛體系的
原子處於同一平面,共軛體系的p電子,不只局限於兩個原子之間運動,而是發生離域作用,使共軛體系的分子產生一系列特徵,如分子內能低、穩定性高、
鍵長趨於平均化,以及在外
電場影響下
共軛分子鏈發生極性交替現象和引起分子其他某些性質的變化,這些變化通常稱為共軛效應。共軛效應是指在共軛體系中電子離域的一種效應是有機化學中一種重要的電子效應.它能使分子中電子云密度的分布發生改變(共平面化、趨於平均),內能減少,鍵長趨於平均化,折射率升高,整個分子更趨穩定。
 共軛效應
共軛效應共軛效應介紹
“共軛效應是穩定的”是有機化學的最最基本原理之一。但是,自30年代起,
鍵長平均化,4N+2
芳香性理論,苯環D6h構架的起因,分子的構象和共軛效應的因果關係,π-
電子離域的結構效應等已經受到了廣泛的質疑。其中,最引人注目的是Vollhardt等合成了中心苯環具有環己三烯幾何特徵的亞苯類化合物,Stanger等合成了鍵長平均化,但長度在0.143~0.148nm的
苯並類衍生物。(1999年),Stanger又獲得了在苯環中具有單鍵鍵長的苯並類化合物。在理論計算領域,爭論主要表現在計算方法上,集中在如何將作用能分解成π和σ兩部分.隨著論戰的發展,作用能分解法在有機化學中的套用不斷地發展和完善,Hückel理論在有機化學中的絕對權威也受到了挑戰.為此,簡要地介紹了能量分解法的發展史,對Kollma法的合理性提出了質疑.此外特別介紹了我們新的能量分解法,及在共軛效應和
芳香性的研究中的新觀點和新的思維模式。
 共軛效應
共軛效應原理介紹
正常共軛效應
又稱π-π共軛。是指兩個以上
雙鍵(或叄鍵)以
單鍵相聯結時所發生的 π電子的離位作用。C.K.英戈爾德稱這種效應為
中介效應,並且認為,共軛體系中這種電子的
位移是由有關各
原子的
電負性和 p軌道的大小(或
主量子數)決定的。Y原子的電負性和它的p軌道半徑愈大,則它吸引π電子的能力也愈大,愈有利於
基團-X=Y從基準
雙鍵 A=B-吸引π電子的共軛效應(如同右邊的箭頭所示)。與此相反,如果A原子的電負性和它的p軌道半徑愈大,則它釋放π電子使其向Y原子移動的能力愈小,愈不利於向-X=Y基團方向給電子的共軛效應。中間原子B和X的特性也與共軛效應直接相關。
多電子共軛效應 又稱 p-π共軛。在簡單的多電子
共軛體系中,Z為一個帶有p電子對(或稱n電子)的
原子或基團。這樣的共軛體系中,除Z能形成d-π共軛情況外,都有向基準雙鍵A=B-方向給電子的共軛效應。Z原子的一對p電子的作用,類似正常共軛體系中的-X=Y基團。
 共軛效應
共軛效應超共軛效應
又稱σ-π共軛。它是由一個烷基的C-H鍵的
σ鍵電子與相鄰的半滿或全空的p軌道互相重疊而產生的一種共軛現象。依照多電子共軛的理論,一個C-H鍵或整個CH
3基團可作為一個假
原子來看待。超共軛效應存在於
烷基連線在不飽和鍵上的化合物中,超共軛效應的大小由烷基中
α-H原子的數目多少而定,甲基最強,第三
丁基最弱。超共軛效應比一般
正常共軛效應和多電子共軛效應弱得多。
 共軛效應
共軛效應同共軛效應
又稱p軌道與p軌道的σ 型重疊。甲基以上的烷基,除有
超共軛效應外,還可能產生同共軛效應。所有同共軛效應,原是指
β碳原子上的C-H 鍵與鄰近的π 鍵間的相互作用。大量的化學活性和
電子光譜的數據表明,在
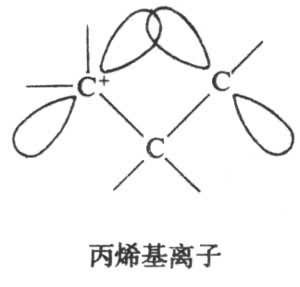
丙烯基離子和類似的烯羰基中,存在一種特殊的p-π或π-π共軛現象,即所謂同共軛效應:
 共軛效應
共軛效應在
丙烯基離子中是烯碳
原子上的p軌道,與正碳離子(
β)上的空p軌道,作σ型的部分重疊;而在類似的烯
羰基中,則是
羰基碳原子的 p軌道與烯碳原子(
β)的p軌道作σ 型的部分重疊: 這種共軛效應的影響比
超共軛效應還小。
烷基與烯鏈間的整個共軛效應,應包括超共軛效應和
同共軛效應。
d-p共軛
又稱d軌道接受共軛。是指一個
原子的p軌道與另一個原子的 d軌道重疊而產生的一種共軛現象,例如有機矽化合物結構中的d-p共軛;在這裡,苯環上的一部分 π
電子云進入矽的3d軌道,形成d-p共軛,使矽原子與苯環結合得更牢。 此外,共軛效應還分靜態和動態兩類。靜態共軛效應存在於未反應的
共軛分子中,它是共軛分子中 π電子的高度活動性和 π電子發生位移的結果。動態共軛效應指在起
化學反應的一瞬間,由於進攻試劑的作用,使共軛體系中π
電子密度重新分布所引起的一種共軛現象。
相關擴展
誘導效應
誘導效應是指在
有機分子中引入一
原子或基團後,使分子中成鍵電子云密度分布發生變化,從而使
化學鍵發生極化的現象,稱為誘導效應。誘導效應在
有機化合物分子中,由於
電負性不同的
取代基(原子或
原子團)的影響,使整個分子中的成鍵電子云密度向某一方向偏移,這種效應叫誘導效應。誘導效應的特徵是
電子云偏移沿著
σ鍵傳遞,並隨著
碳鏈的增長而減弱或消失。例如,
醋酸是
弱酸(pKi=4.76),醋酸分子中的
α-碳原子上引入一個電負性比氫強的氯原子後,能使整個分子的電子云向氯原子偏移,結果增強了
羥基中氫原子的
質子化,使一氯醋酸成為
強酸(pKi=2.86,酸性比醋酸強)。比較各種原子或原子團的誘導效應時,常以
氫原子為標準。吸引電子能力(電負性較大)比氫原子強的原子或原子團(如—X (x表示
鹵素)、—OH、—NO
2、—CN等)有吸電子的誘導效應(負的誘導效應),用-I表示,整個分子的電子云偏向
取代基。吸引電子的能力比氫原子弱的原子或原子團(如
烷基)具有給電子的誘導效應(正的誘導效應),用I表示,整個分子的電子云偏離取代基。在誘導效應中,一般用箭頭“→”表示電子移動的方向,表示電子云的分布發生了變化。誘導效應是一種短程的
電子效應,一般隔三個化學鍵影響就很小了。
 誘導效應
誘導效應 誘導效應與共軛效應的異同
(1)不同之處
誘導效應:存在σ鍵中;通過原子間電負性的差異而導致鍵的極性改變使整個分子電子云發生移動;是短距離效應,一般有3個碳原子後基本消失;極化變化是單一方向。
共軛效應:存在於共軛體系中;通過π電子的運動,沿著共軛鏈傳遞;強度一般不因共軛鏈的長度而受影響,屬長距離電子效應;極性交替出現。
(2)相同之處
兩者都存在吸電子效應和斥電子效應。
通常在討論誘導效應和共軛效應時,一般是分別討論,但有時在一個分子中既有誘導效應,還存在共軛效應,它們相互影響,相互制約。
 共軛效應
共軛效應 共軛效應
共軛效應 共軛效應
共軛效應 共軛效應
共軛效應 共軛效應
共軛效應 共軛效應
共軛效應 誘導效應
誘導效應
