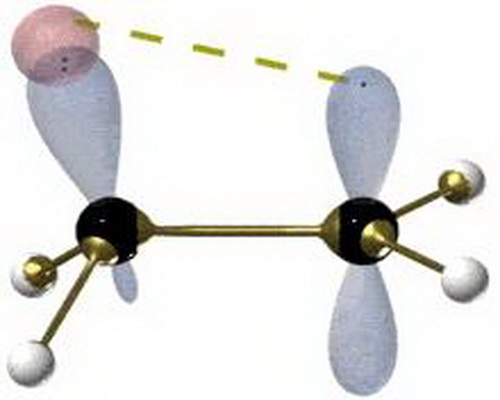
同共軛效應又稱 p 軌道與 p 軌道的 型重疊。甲基以上的烷基,除有超共軛效應外,還可能產生同共軛效應。 所有同共軛效應,原是指 碳原子上的 C—H 鍵與鄰近的 鍵間的相互作用。大量的化學活性和電子光譜的數據表明,在丙烯基離子和類似的烯羰基中,存在一種特殊的 p- 或 - 共軛現象,即所謂同共軛效應。
基本介紹
- 中文名:同共軛效應
- 別稱:p軌道與p軌道的型重疊
- 效應:產生同共軛效應
- 作用鍵:C—H 鍵與鄰近的 鍵間
簡介,正常共軛效應,多電子共軛效應,超共軛效應,
簡介
所有同共軛效應,原是指碳原子上的 C—H 鍵與鄰近的 鍵間的相互作用。大量的化學活性和電子光譜的數據表明,在丙烯基離子和類似的烯羰基中,存在一種特殊的 p- 或 - 共軛現象,即所謂同共軛效應:
在丙烯基離子中是烯碳原子上的 p 軌道,與正碳離子( )上的空p軌道,作型的部分重疊;而在類似的烯羰基中,則是羰基碳原子的 p軌道與烯碳原子( )的p軌道作 型的部分重疊。
正常共軛效應
又稱 π-π 共軛。是指兩個以上雙鍵(或三鍵)以單鍵相聯結時所發生的 電子的離位作用。英戈爾德,C.K.稱這種效應為仲介效應,並且認為,共軛體系中這種電子的位移是由有關各原子的電負性和 p 軌道的大小(或主量子數)決定的。據此若在簡單的正常共軛體系中發生以下的電子離位作用: (例如:CH2 CH—CH CH2、CH2 CH—CH O)。Y 原子的電負性和它的 p 軌道半徑愈大,則它吸引 電子的能力也愈大,愈有利於基團—X Y從基準雙鍵 A B—吸引 電子的共軛效應(如同右邊的箭頭所示)。與此相反,如果A原子的電負性和它的 p 軌道半徑愈大,則它釋放電子使其向 Y 原子移動的能力愈小,愈不利於向—X Y基團方向給電子的共軛效應。中間原子 B 和 X 的特性也與共軛效應直接相關。
多電子共軛效應
又稱 p- 共軛。在簡單的多電子共軛體系中,Z 為一個帶有 p 電子對 (或稱 n電子)的原子或基團。這樣的共軛體系中,除 Z 能形成 d- 共軛情況外,都有向基準雙鍵 A B—方向給電子的共軛效應: (例如 等)。Z 原子的一對 p 電子的作用,類似正常共軛體系中的—X Y基團。
超共軛效應
又稱 - 共軛,它是由一個烷基的 C—H 鍵的 鍵電子與相鄰的 鍵電子互相重疊而產生的一種共軛現象(烷基的碳原子與極小的氫原子結合,對於電子云的禁止效應小,烷基上C-H鍵的一對電子,受核的作用相互吸引,到一定距離時,烷基上的幾個C-H鍵電子之間又相互排斥,如果鄰近有π軌道或者p軌道可以容納電子,這時σ電子就偏離原來的軌道而偏向於π軌道或p軌道)。依照多電子共軛的理論,一個C—H鍵或整個CH基團可作為一個假原子來看待,有如結構式 中的 Z 原子: (例如 CH2 CH—CH3、O CH—CH3等) 。超共軛效應存在於烷基連線在不飽和鍵上的化合物中,超共軛效應的大小由烷基中 -H 原子的數目多少而定,甲基最強,第三丁基最弱。超共軛效應比一般正常共軛效應和多電子共軛效應弱得多。 (分為σ-π和σ-p兩種,以σ-π最為常見)