簡介
乙醇脫氫酶(Alcohol dehydrogenase,簡稱ADH)的系統名為:乙醇:輔酶I氧化還原酶(alcohol:NAD+ oxidoreductase),大量存在於人和動物肝臟、植物及微生物細胞之中,是一種含鋅
金屬酶,具有廣泛的底物特異性。乙醇脫氫酶夠以
煙醯胺腺嘌呤二核苷酸(NAD)為輔酶,催化伯醇和醛之間的可逆反應:CH3CH2OH+ NAD+→ CH3CHO +NADH+ H+。在人和哺乳動物體內,乙醇脫氫酶與
乙醛脫氫酶(ALDH)構成了乙醇脫氫酶系,參與體內乙醇代謝,是人和動物體內重要的代謝酶。作為生物體內主要短鏈醇代謝的關鍵酶,它在很多生理過程中起著重要作用。它是一種廣泛專一性的含鋅金屬酶。乙醇脫氫酶乙醇氧化體系是在肝臟中代謝酒精的一條主要途徑。乙醇脫氫酶氧化體系包括醇脫氫酶(ADH)和醛脫氫酶(ALDH)。
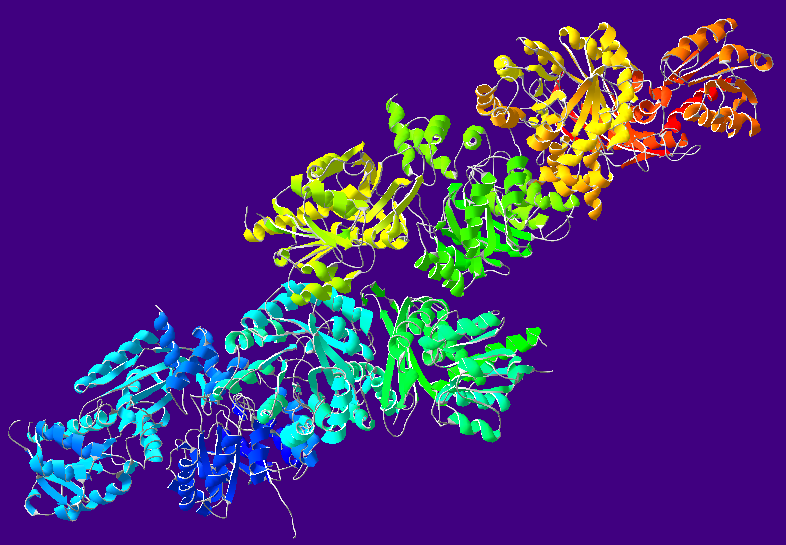 乙醇脫氫酶
乙醇脫氫酶演化發現
2.1演化
生物遺傳的許多證據表明,谷胱甘肽甲醛脫氫酶與ADH3一樣,可能是整個乙醇脫氫酶家族的祖先。早在進化時,有效消除內源性和外源性甲醛的方法就很重要,並且這種能力已經通過時間保留在了ADH3中。由於基因的一系列突變,ADH3的重複
基因演變為其他的乙醇脫氫酶。據認為,在酵母中發現了將糖類轉化為
酒精的的能力,酵母細胞可以通過產生高濃度的酒精,使其他生物體中毒,以有效地消除它們的競爭。由於腐爛的水果可以包含超過4%的乙醇,動物吃水果需要一個系統來代謝外源乙醇。 這可以解釋為什麼其他物種比酵母更需要乙醇脫氫酶ADH。
2.2發現
首次分離出乙醇脫氫酶(ADH)是在1937年,是從釀酒酵母(麵包酵母)中純化得到的。Hugo Theorell和他的同事研究了馬肝臟中乙醇脫氫酶催化機理的很多方面。乙醇脫氫酶還是首先測定了胺基酸序列以及蛋白質三維結構的寡聚酶之一。在1960年初,在果蠅屬
果蠅中也發現了乙醇脫氫酶。
性質
乙醇脫氫酶是一個質量為80kDa的二聚體,包括一組同工酶,這些同工酶都能夠將乙醇轉化為乙醛。在哺乳動物中,這是一個涉及輔酶煙醯胺腺嘌呤二核苷酸(NAD+)的
氧化還原反應。乙醇脫氫酶負責催化氧化伯醇和二級醇成為醛和酮,另外也可以影響它們的逆反應。但是對於伯醇,這種催化作用並不強,而在二級醇和環醇中催化作用較強。乙醇脫氫酶的最適作用pH值在7.0-10.0,pH值為8.0時酶活力達到最大,pH值為7.0時酶活力較為穩定;ADH的最適作用溫度為37℃,溫度為30-40℃時酶活力較穩定,溫度超過45℃後酶活力急劇下降。
乙醇氧化
作用機制
結合輔酶NAD+→通過鋅結合乙醇底物→His-51的去質子化→煙醯胺核糖的去質子化→Ser-48的去質子化→乙醇的去質子化→氫化物從醇鹽離子轉移至NAD+,使NADH和鋅結合醛或酮→釋放產物醛。這些步驟是基於動力學的研究得出,在酵母和細菌中,以上步驟剛好相反。
亞基
底物與鋅和乙醇脫氫酶配位,每個亞基有兩個鋅原子。其中一個是參與催化的活性位點,配體是Cys-46, Cys-174,His-67和一個水分子。 另一亞基則涉及結構。在這種機制下,氫化物從乙醇到達NAD +。晶體結構表明,His-51去掉了煙醯胺核糖的質子,而正是煙醯胺核糖去掉了Ser-48的質子。最後,Ser- 48使乙醇去質子化,使之成為乙醛。從機械的角度來看,如果酶結合了氫化物到達NAD +的Re面時,產生的氫氣將被納入pro-R位置。當氫化酶添加在Re面時,被視為A類脫氫酶。
活性部位
活性中心由一個鋅原子,His-67, Cys-174,Cys-46,Ser-48,His-51,Ile-269,Val-292,Ala-317和Phe-319構成。鋅負責結合底物酒精。Cys-146,Cys-174和His-67結合鋅,Phe-319,Ala-317,His-51,Ile-269和Val-292通過氫鍵與NAD+穩定結合。His-51和Ile-269與煙醯胺與核糖醇形成氫鍵結合。Phe-319,Ala-317和Val-292與NAD+上的氨基形成氫鍵。關於結構鋅的位點,哺乳動物的乙醇脫氫酶也有結構鋅位點。在這裡鋅離子對蛋白質結構穩定起到至關重要的作用。用量子化學計算和分子動力學的經典方法研究的馬肝醇脫氫酶(HLADH)催化和結構鋅已經提示了我們它的空間結構,結構鋅是由四個關係緊密的半胱氨酸配體(Cys97,Cys100,Cys103和Cys111)定位於鋅離子周圍近似對稱的四面體上。最近的一項研究表明,鋅和半胱氨酸之間的相互作用主要是通過一價的共價鍵結合。
類型
人體內
在人類中,乙醇脫氫酶以多種二聚體的形式存在,由至少7種不同的基因編碼。乙醇脫氫酶一共具有五個類別(Class I-V),但在人的胃肝臟中存在的主要是Class I。它催化乙醇乙醛氧化作用為:CH3CH2OH+ NAD+ → CH3CHO + NADH + H+。這使得人類可以飲用含酒精的飲品,但最初其進化的目的可能是為了分解食物或者細菌在消化道中產生的醇類。還有一些人認為,其進化的目的是參與維生素的新陳代謝過程,由於乙醇的卡路里幾乎為零,也許能夠提供少量的純淨的能量。乙醇脫氫酶也參與了其他類型醇的反應:例如,它氧化甲醇生產甲醛和乙二醇 ,最終生成乙醇酸和草酸。人類至少有六種略有不同的乙醇脫氫酶。 每個都是一個二聚體,每兩個二聚體含有兩個二價鋅離子。其中一個離子是酶與底物結合必不可少的。
乙醇脫氫酶的活性因人而異。比如年輕女性就不能夠像青年男子那樣快速地分解酒精,因為她們體內的乙醇脫氫酶活性不如他們體內的活性高。不過,這種情況在中年之後會出現逆轉。當然,並不只有表達水平能影響乙醇脫氫酶的活性,同樣取決於不同人的
等位基因多樣性。這些等位基因的差異性與地域有關,比如,已有的研究表明,在歐洲具有高表達活性乙醇脫氫酶基因的人數遠多餘亞洲以及美洲。這可能與關聯進化有關,簡單地說由於歐洲人大多大量飲用酒精度較高的烈酒,就會自然選擇那些具有高表達活性乙醇脫氫酶基因的人。
酵母細菌
與人類不同,酵母和細菌(乳酸菌,以及某些條件下的大腸桿菌除外)不將葡萄糖發酵為乳酸,他們將葡萄糖發酵為乙醇和二氧化碳。總反應式為:Glucose + 2 ADP + 2 Pi → 2 ethanol +2 CO2+ 2ATP+ 2H2O。在酵母和許多細菌中 ,乙醇脫氫酶在發酵起著重要作用:從
糖酵解產生的
丙酮酸轉化為
乙醛和二氧化碳,隨後乙醛在ADHI的作用下轉化為乙醇。後一步的目的是重新產生NAD+,於是糖酵解的能量生成得以繼續。人類利用這一過程發明了酵母發酵工藝,使水果和穀物發酵成酒,但有趣的是,有時候酵母也會“飲用”自己產生的酒精。
存在於酵母中的主要乙醇脫氫酶略大於人類的乙醇脫氫酶,它具有四個
亞基而不是兩個,同時,它同樣具有鋅
活性位點。不同於人和哺乳動物之處是酵母和細菌中的乙醇脫氫酶常常會組成一個“長鏈家族”。另外,在啤酒酵母中也存在由ADHI基因發展而來的ADHII,它的作用是將乙醇轉化回乙醛,只有當周圍糖濃度較低時這種酶才會發揮作用,乙醛可以毒殺環境中的糖分競爭者,當糖濃度恢復至正常水平,這種酶就不再發揮作用。
含鐵酶
與上述兩類乙醇脫氫酶無關,還有第三類乙醇脫氫酶是含有鐵離子的,它們作用不十分明顯,主要存在於某些細菌和酵母中。相對於上述兩種酶,這類酶大多對氧敏感。
其他類型
進一步的醇脫氫酶類屬於五重酶(quinoenzymes),並且需要醌型輔因子結合電子,這種酶的典型例子是甲醇的甲醇細菌脫氫酶。
套用
疾病診斷
人體內ADH主要在肝臟生成,所以肝臟疾患可能與血清ADH活性相關。用
分光光度法測定血清中ADH的活性並結合臨床探討該項指標在肝臟疾病的診斷上有重要意義。通過實驗測定血清ADH活性,從而反應出肝臟功能正常與否。通過對肝臟病人血清中ADH的測定表明,結果均顯著高於健康人參考值。
酒精濃度
日常交際生活中,人們不可避免地要接觸酒精。酒後駕車造成的交通事故已是屢見不鮮。另外,飲酒過量可引起酒精中毒。鑒於酒後事故及酒精中毒的嚴重後果,所以迅速測定血漿中乙醇濃度,對預防事故的發生及早期診斷和處理
急性酒精中毒具有非常重要的臨床價值。報導了一種新的酶
終點法測定血漿中乙醇濃度的方法,無需去除蛋白,整個檢測過程僅需90 s,可用於
自動生化分析儀及手工操作,適於臨床常規運用。實驗中他們選用三(羥甲基)
氨基甲烷—鹽酸(Tris-HCL)作為緩衝體系,在鹼性條件下,乙醇脫氫酶(ADH)催化乙醇轉化成乙醛,同時生成還原型輔酶(NADH)。在340 nm波長處檢測吸光度的變化,對照標準計算乙醇的濃度。
催化劑
在化學工業中,利用ADH的催化特性生產許多原材料及中間
反應物。在二氧化碳轉化合成甲醇的過程中,ADH就發揮了酶的
催化作用。為實現CO2向甲醇的轉化,研究者曾嘗試了多種方法,其中酶催化法以其高效、專一及反應條件溫和等優點,近些年來備受關注,在CO2的固定和還原反應中已有套用。許松偉等採用甲酸脫氫酶、甲醛脫氫酶和ADH為催化劑,以NADH作為
電子供體,通過三步串連反應將CO2轉化為甲醇,探索出了CO2利用的新途徑。
臨床意義
酒精中毒
曾有研究顯示,乙醇脫氫酶可能導致患者對乙醇代謝依賴性的酗酒。研究人員初步檢測到一個可能與酗酒有關的幾個基因。如果這些基因變體編碼的ADH2和ADH3進入慢代謝形式,可能會增加酗酒的風險。該研究發現,突變的ADH2和ADH3與亞洲人群酗酒有關。然而,事實是否真是如此,還需要繼續深入研究。
藥物依賴
藥物依賴是關於乙醇脫氫酶的另一個問題,研究人員認為這可能與酗酒有關。一個特別的研究表明,藥物依賴與7個乙醇脫氫酶的相關基因有關。這些結果可能有助於有針對性的治療這些特定的基因。然而,這還有待於更多的深入研究。
 乙醇脫氫酶
乙醇脫氫酶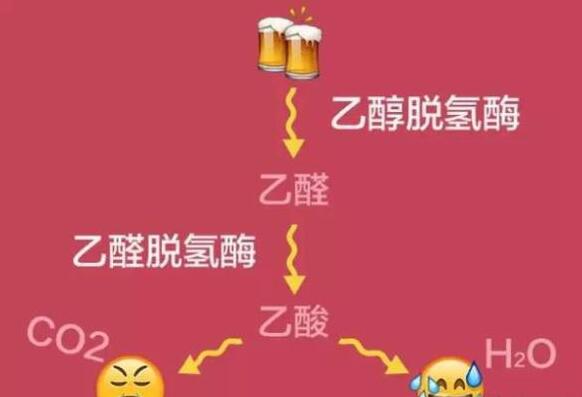
 乙醇脫氫酶
乙醇脫氫酶