發現簡史
1836年,英國著名化學家戴維·漢弗萊(Davy,HumPhry1778-1829)的堂弟,
愛爾蘭港口城市科克(Cork)皇家學院化學教授戴維·愛德蒙德(Davy,Edmund1785-1857)在加熱木炭和
碳酸鉀以製取
金屬鉀過程中,將
殘渣(碳化鉀)投進水中,產生一種氣體,發生爆炸,分析確定這一氣體的化學組成是C、H(當時採用碳的
原子量等於6計算),稱它為“一種新的氫的二碳化物”。這是因為早在1825年他的同國化學家
法拉第(Faraday,MIChael1791-1867)從加壓的
蒸餾鯨魚油獲得的氣體(供當時
歐洲人照明用)中也獲得一種碳和氫的化合物,分析測定它的化學組成是C、H,命名它為“氫的二碳化物”。實際上法拉第發現的是
苯,戴維·愛德蒙德發現的是乙炔。
物理性質
純乙炔為無色芳香氣味的易燃氣體。而電石制的乙炔因混有
硫化氫H2S、
磷化氫PH3、
砷化氫而有毒,並且帶有特殊的臭味。熔點(118.656kPa)-80.8℃,沸點-84℃,
相對密度0.6208(-82/4℃),
折射率1.00051,
折光率1.0005(0℃),
閃點(開杯)-17.78℃,
自燃點305℃。在空氣中
爆炸極限2.3%-72.3%(vol)。在
液態和固態下或在
氣態和一定壓力下有猛烈爆炸的危險,受熱、震動、電火花等因素都可以引發
爆炸,因此不能在加壓液化後貯存或運輸。微溶於水,溶於
乙醇、
苯、
丙酮。在15℃和1.5MPa時,乙炔在丙酮中的溶解度為237g/L,溶液是穩定的。
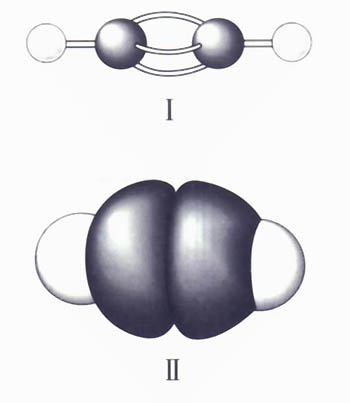
 乙炔的結構簡式
乙炔的結構簡式因此,工業上是在裝滿石棉等多孔物質的鋼瓶中,使多孔物質吸收丙酮後將乙炔壓入,以便貯存和運輸。為了與其它氣體區別,乙炔鋼瓶的顏色一般為乳白色,橡膠氣管一般為黑色,乙炔管道的螺紋一般為
左旋螺紋(螺母上有徑向的間斷溝)。
 乙炔分子模型
乙炔分子模型分子構型:直線型
雜化類型:sp雜化中心原子孤電子對數:0通常計量單位:m3;mm3;cm3;
密度:標準氣壓下1.17Kg/m3;在25攝氏度狀況下,密度1.12Kg/m3。
包裝方法:鋼質氣瓶
在乙炔氣體分壓等於101.325 kPa時,被一體積水所吸收的該氣體體積(已折合成標準狀況)
溫度(℃)
| 溶解度
| 溫度(℃)
| 溶解度
| 溫度(℃)
| 溶解度
|
0
| 1.73
| 25
| 0.93
| 70
| 0.25
|
5
| 1.49
| 30
| 0.84
| 80
| 0.15
|
10
| 1.31
| 40
| 0.65
| 90
| 0.05
|
15
| 1.15
| 50
| 0.50
| | |
20
| 1.03
| 60
| 0.37
| | |
化學性質
乙炔(acetylene)最簡單的
炔烴,又稱電石氣。
結構式H-C≡C-H,
結構簡式CH≡CH,最簡式(又稱
實驗式)CH,分子式 C2H2,乙炔中心C原子採用sp雜化。電子式 H:C┇┇C:H乙炔分子量 26.4 ,氣體比重 0.91(Kg/m3),火焰溫度3150 ℃,
熱值12800 (千卡/m3) 在氧氣中燃燒速度 7.5 ,純乙炔在空氣中燃燒2100度左右,在氧氣中燃燒可達3600度。化學性質很活潑,能起
加成、
氧化、
聚合及金屬取代等反應。
氧化反應
a.可燃性:
 乙炔的燃燒
乙炔的燃燒2C2H2+5O2→4CO2+2H2O(條件:點燃)
現象:火焰明亮、帶濃煙,燃燒時火焰溫度很高(>3000℃),用於氣焊和氣割。其火焰稱為
氧炔焰。
b.被KMnO4氧化:能使紫色酸性
高錳酸鉀溶液褪色。
C2H2 + 2KMnO4 + 3H2SO4=2CO2+ K2SO4 + 2MnSO4+4H2O
加成反應
如:
與Br2的加成
現象:溴水褪色或Br2的CCl4溶液褪色
所以可用酸性KMnO4溶液或溴水區別炔烴與烷烴。
與H2的加成
CH≡CH+H2 → CH2=CH2
與HX的加成
如:CH≡CH+HCl →CH2=CHCl氯乙烯用於制聚氯乙烯
“聚合”反應
三個乙炔分子結合成一個苯分子:
由於乙炔與乙烯都是不飽和烴,所以化學性質基本相似。在適宜條件下,三分子乙炔能聚合成一分子苯。但苯的產量不高,副產物又多。如果利用鈀等過渡金屬的化合物作催化劑,乙炔和其他炔烴可以順利地生成苯及其衍生物。
在一定條件下,乙炔也能與烯烴一樣,聚合成高聚物——聚乙炔。
在Ni(CN)2,80~120℃,1.5MPa條件下,4分子乙炔聚合主要生成環辛四烯。
金屬取代反應(可用於乙炔的定性鑑定)
將乙炔通入溶有金屬鈉的液氨里有氫氣放出。乙炔與銀氨溶液反應,產生白色
乙炔銀沉澱。
乙炔具有弱酸性,因為乙炔分子裡碳氫鍵是以SP-S重疊而成的。碳氫里
碳原子對電子的吸引力比較大些,使得碳氫之間的電子云密度近碳的一邊大得多,而使碳氫鍵產生
極性,給出H+而表現出一定的酸性。(pKa=25)
將其通入硝酸銀或氯化亞銅氨水溶液,立即生成白色乙炔銀(AgC≡CAg)和棕紅色乙炔亞銅(CuC≡CCu)沉澱,可用於乙炔的定性鑑定。這兩種金屬炔化物乾燥時,受熱或受到撞擊容易發生爆炸,如反應完套用鹽酸或硝酸處理,使之分解,以免發生危險。注意:乙炔在使用貯運中要避免與銅接觸。
酸鹼反應
炔烴中C≡C的C是sp雜化,使得Csp-H的σ鍵的電子云更靠近碳原子,增強了C-H鍵極性使氫原子容易解離,顯示“酸性”。連線在C≡C碳原子上的氫原子相當活潑,易被金屬取代,生成炔烴金屬衍生物叫做
炔化物。
CH≡CH + Na → CH≡CNa + 1/2H2(條件液氨)
CH≡CH + 2Na → CNa≡CNa + H2 (條件液氨,190℃~220℃)
CH≡CH + NaNH2 → CH≡CNa + NH3
CH≡CH + Cu2Cl2 (2AgCl)+2NH4OH → CCu≡CCu(CAg≡CAg)↓ + 2NH4Cl +2H2O(注意:只有在三鍵上含有氫原子時才會發生,用於鑑定端基炔RH≡CH)。
其他化學特性
乙炔與銅、銀、水銀等金屬或其鹽類長期接觸時,會生成乙炔銅(Cu2C2)和乙炔銀(Ag2C2)等爆炸性混合物,當受到摩擦、衝擊時會發生爆炸。因此,凡供乙炔使用的器材都不能用銀和含銅量70%以上的銅合金製造。
製備方法
電石法
由電石(碳化鈣)與水作用製得。
實驗室中常用電石跟水反應製取乙炔。與水的反應是相當激烈的,可用分液漏斗控制加水量以調節出氣速度。也可以用
飽和食鹽水。
原理:電石發生水解反應,生成乙炔。裝置:燒瓶和分液漏斗(不能使用啟普發生器)。燒瓶口要放棉花,以防止泡沫溢出。
 實驗室制乙炔示意圖
實驗室制乙炔示意圖反應方程式:CaC2+2H-OH→Ca(OH)2+CH≡CH↑
收集方法:
排水集氣法 或向下排空氣集氣法(不常用)
尾氣處理:點燃
製備裝置與氫氣等氣體類同。
天然氣法
預熱到600-650℃的原料天然氣和氧進入多管式燒嘴板乙炔爐,在1500℃下,甲烷裂解製得8%左右的稀乙炔,再用
N-甲基吡咯烷酮提濃製得99%的乙炔成品。
主要用途
乙炔可用以照明、焊接及切斷金屬(氧炔焰),也是製造乙醛、醋酸、苯、合成橡膠、合成纖維等的基本原料。
乙炔燃燒時能產生高溫,氧炔焰的溫度可以達到3200℃左右,用於切割和焊接金屬。供給適量空氣,可以完全燃燒發出亮白光,在電燈未普及或沒有電力的地方可以用做照明光源。乙炔化學性質活潑,能與許多試劑發生
加成反應。在20世紀60年代前,乙炔是有機合成的最重要原料,現仍為重要原料之一。如與
氯化氫、
氫氰酸、
乙酸加成,均可生成生產高聚物的原料。
乙炔在不同條件下,能發生不同的聚合作用,分別生成乙烯基乙炔或二乙烯基乙炔,前者與氯化氫加成可以得到制氯丁橡膠的原料2-氯-1,3-丁二烯。乙炔在400~500℃高溫下,可以發生環狀三聚合生成苯;以
氰化鎳Ni(CN)2為催化劑,在50℃和1.2~2MPa下,可以生成環辛四烯。
監測方法
1、現場應急監測方法
(1)氣體檢測管法。
(2)氣體速測管。
2、實驗室監測方法
監測方法
| 類 別
| 來 源
|
|
氣相色譜法
| 空氣
| 《工作場所有害物質監測方法》
| 徐伯洪,閆慧芳主編
|
氣相色譜法
| 空氣
| 《空氣中有害物質的測定方法》(第二版)
| 杭士平編
|
乙炔亞銅比色法
| 空氣
| 《化工企業空氣中有害物質測定方法》
| 化學工業出版社
|
3、現場監測方法
(1)2M004乙炔氣體感測器檢測微量感測器。
(2)K204乙炔模組檢測乙炔泄露。
安全與防護
應急處置
吸入:迅速脫離現場至空氣新鮮處。保持呼吸道通暢。如呼吸困難,給予輸氧。如呼吸停止,立即進行人工呼吸,就醫。
呼吸系統防護:一般不需要特殊防護,但建議特殊情況下佩帶合適的自吸過濾式防毒面具(氧氣含量與空氣中氧含量一致或接近時)。
眼睛防護:一般不需要特殊防護,高濃度接觸時可戴化學安全防護眼鏡。
身體防護:穿防靜電工作服。
手防護:戴一般作業防護手套。
其他防護:工作現場嚴禁吸菸。避免長期反覆接觸。進入罐、限制性空間或其他高濃度區作業,必須有人監護。
泄漏應急處理:迅速撤離泄漏污染區人員至上風處,並進行隔離,嚴格限制出入。切斷火源。建議應急處理人員戴自給正壓式呼吸器,穿防靜電工作服。儘可能切斷泄漏源。合理通風,加速擴散。噴霧狀水稀釋、溶解。構築圍堤或挖坑以收容產生的大量廢水。如有可能,將漏出氣用排風機送至空曠地方或裝設適當噴頭燒掉。漏氣容器要妥善處理,修復、檢驗後再用。
滅火方法:切斷氣源。若不能切斷氣源,則不允許熄滅泄漏處的火焰。噴水冷卻容器,可能的話將容器從火場移至空曠處。
應急醫療
診斷要點:
(1)吸入一定濃度後有輕度頭痛、頭昏。
(2)吸入高濃度時先興奮、多語、哭笑不安,繼而頭痛、眩暈、噁心、嘔吐、步態不穩、嗜睡。
(3)嚴重者昏迷。
(4)乙炔急性毒性主要是因為高濃度時置換了空氣中的氧,引起單純性窒息作用,缺氧是主要致死原因。
處理原則:
可參考“丙烯中毒”。
預防措施:
停止吸入,症狀迅速消失。實際上,乙炔中毒者的症狀部分由於混入的磷化氫、硫化氫和其他氣體所致。應注意有否
混合氣體中毒,尤其是磷化氫中毒的可能性,以便及時搶救。
毒理學資料
急性毒性:
純乙炔屬微毒類,具有弱麻醉和阻止細胞氧化的作用。高濃度時排擠空氣中的氧,引起單純性窒息作用。乙炔中常混有磷化氫、硫化氫等氣體,故常伴有此類毒物的毒作用。人接觸100 mg/m3能耐受30~60 min,20%引起明顯缺氧,30%時共濟失調,35%下5 min引起意識喪失,含10%乙炔的空氣中5 h,有輕度中毒反應。
亞急性和慢性毒性:
動物長期吸入非致死性濃度該品,出現血紅蛋白、網織細胞、淋巴細胞增加和中性粒細胞減少。屍檢有支氣管炎、肺炎、肺水腫、肝充血和脂肪浸潤。
國家標準
1、中國職業接觸限值(GBZ 2—2002)
2、環境標準
注意事項
操作
密閉操作,全面通風。操作人員必須經過專門培訓,嚴格遵守操作規程。建議操作人員穿防靜電工作服。遠離火種、熱源,工作場所嚴禁吸菸。使用防爆型的通風系統和設備。防止氣體泄漏到工作場所空氣中。避免與
氧化劑、酸類、
鹵素接觸。在傳送過程中,鋼瓶和容器必須接地和跨接,防止產生
靜電。搬運時輕裝輕卸,防止鋼瓶及附屬檔案破損。配備相應品種和數量的消防器材及泄漏應急處理設備。
儲存
乙炔的包裝法通常是溶解在
溶劑及多孔物中,裝入鋼瓶內。儲存於陰涼、通風的庫房。遠離火種、熱源。庫溫不宜超過30℃。應與氧化劑、酸類、鹵素分開存放,切忌混儲。採用防爆型照明、通風設施。禁止使用易產生火花的機械設備和工具。儲區應備有泄漏應急處理設備。
運輸 乙炔鋼瓶
乙炔鋼瓶 採用鋼瓶運輸時必須戴好鋼瓶上的安全帽。鋼瓶一般平放,並應將瓶口朝同一方向,不可交叉;高度不得超過車輛的防護欄板,並用三角木墊卡牢,防止滾動。運輸時運輸車輛應配備相應品種和數量的消防器材。裝運該物品的車輛排氣管必須配備阻火裝置,禁止使用易產生火花的機械設備和工具裝卸。嚴禁與氧化劑、酸類、鹵素等混裝、混運。夏季應早晚運輸,防止日光曝曬。中途停留時應遠離火種、熱源。公路運輸時要按規定路線行駛,勿在居民區和人口稠密區停留。鐵路運輸時要禁止溜放。
廢棄處理
處置前應參閱國家和地方有關法規。建議用焚燒法處置和填埋。
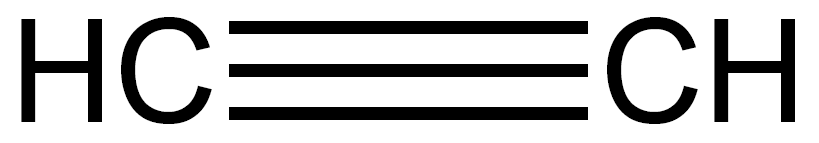 乙炔的結構簡式
乙炔的結構簡式 乙炔分子模型
乙炔分子模型 乙炔的燃燒
乙炔的燃燒 實驗室制乙炔示意圖
實驗室制乙炔示意圖 乙炔鋼瓶
乙炔鋼瓶