基本介紹
- 中文名:砷化氫
- 英文名:Arsine / arsenic hydride
- 別稱:砷化三氫、砷烷、胂、三氫化砷
- 化學式:AsH3
- 分子量:77.93
- CAS登錄號:7784-42-1
- 熔點:-117 °C (157 K)
- 沸點:-62.5 °C (210 K)
- 水溶性:可溶於水
- 密度:3.24kg/m(20℃)
- 外觀:無色氣體,高濃度有蒜味
- 閃點:(℃):-110
- 套用:用於有機合成、軍用毒氣,及套用於科研或某些特殊實驗中。
- 安全性描述:S9 S16 S28 S33 S45 S60 S61 S36/S37
- 危險性符號:很易燃極毒危害環境
- 危險性描述:R12 R26 R48/20 R50/53
- 危險品運輸編號:UN 2188
- 發現者:卡爾·舍勒
簡介,基本資料,化學性質,熱分解,氧化作用,金屬衍生物,古特蔡特測砷法,酸鹼反應,鹵化反應,生成聯胂,套用範圍,半導體,化學戰,探測砷中毒,環境影響,健康危害,環境行為,應急處理,泄漏處理,防護措施,急救措施,毒理學簡介,臨床表現,處理,標準,危害,來源,中毒臨床表現,
簡介
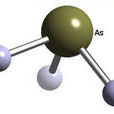
砷化氫(化學式:AsH3)又稱砷化三氫、砷烷、胂。是最簡單的砷化合物,無色、劇毒、可燃氣體。標準狀態下,AsH3是一種無色,密度高於空氣,可溶於水(200 mL/L)及多種有機溶劑的氣體。它本身無臭,但空氣中有大約0.5ppm的胂存在時,它便可被空氣氧化產生輕微類似大蒜的氣味。常溫下胂很穩定,分解成氫和砷的速度非常慢,但溫度高於230°C時,它便迅速分解。還有幾個因素也會影響胂分解的速度,其中包括:濕度、光的存在以及催化劑(鋁)的存在。它是砷和氫的高毒性分子衍生物。儘管它殺傷力很強,在半導體工業中仍廣泛使用,也可用於合成各種有機砷化合物。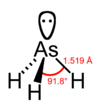 砷化氫 分子結構
砷化氫 分子結構
 砷化氫 分子結構
砷化氫 分子結構
基本資料
中文名稱:砷化氫
英文名稱:Arsine;Arsenic hydride
國標編號:23006
CAS號:7784-42-1
分子式:AsH3
分子量:77.93
分子構型:三角錐形
性狀:常溫常壓下為無色氣體。有大蒜氣味,且劇毒可燃
氣體密度:3.24kg/m3(20℃)
液體密度:1339kg/m3(20℃),1259kg/m3(40.6℃)
沸點:-62.5℃
熔點:-116.9℃
溶解度(水):0.07 g/100 ml (25 °C)
在空氣中可燃限:4.5%~64%(體積)
化學性質
AsH3的化學性質介於PH3及SbH3之間。
熱分解
與一些較重的氫化物一樣(例如SbH3、H2Te和SnH4),AsH3不穩定(動力學上較穩定,但熱力學上不穩定)。
2AsH3 —→ 3H2 + 2As
氧化作用
仍以SbH3作比較,AsH3易被O2或空氣氧化:
2AsH3 + 3O2 → As2O3 + 3H2O
金屬衍生物
砷化氫是製備純淨或接近純淨的砷的金屬複合物的原料。例如屬於二錳系列的[(C5H5)Mn(CO)2]2AsH,其中核心Mn2AsH是平面的。
古特蔡特測砷法
古特蔡特測砷法(Gutzeit test)是一個利用AsH3與Ag的化學反應來測試砷的特有方法。[5] 雖然此測試在分析化學中已不再使用,但我們仍以以下的反應作為一個例子來解釋AsH3在“軟”金屬陽離子中的吸引力。在古特蔡特測砷法中,含水的砷化合物(一般是亞砷酸鹽)被鋅和H2SO4還原便會生成AsH3。此氣體將逸出並通入AgNO3溶液或粉末狀的AgNO3中。固體AgNO3與AsH3反應生成黃色的Ag4AsNO3,而 AsH3與AgNO3溶液反應則生成黑色的Ag3As。
酸鹼反應
As-H鍵有酸性,可被去質子化。這個性質經常被利用:
AsH3 + NaNH2 → NaAsH2 + NH3
AsH3與三烷基鋁發生相應的反應時,會生成三聚物[R2AlAsH2]3,當中的R=(CH3)3C。[6] 此反應與利用AsH3製備GaAs的反應機理有關,見下。
一般認為AsH3是非鹼性的,但可被超酸質子化,生成四面體形離子[AsH4]。
鹵化反應
砷化氫與鹵素(氟及氯)或它們的化合物(例如:三氯化氮)的化學反應非常危險,可導致爆炸。
生成聯胂
套用範圍
半導體
AsH3可用於合成與微電子學及固態雷射有關的半導體材料。與磷相似,砷是矽及鍺的n-摻染物。[1] 更重要的用途是以AsH3為原料,在700-900°C通過化學氣相沉積來製造半導體材料砷化鎵(GaAs):
Ga(CH3)3 + AsH3 → GaAs + 3CH4
化學戰
早在第二次世界大戰前,AsH3就已計畫用於化學戰。由於該氣體無色,幾乎無臭,且密度是空氣的2.5倍,因此非常適合在化學戰中用作覆蓋效應搜尋。其致命濃度遠低於能聞到蒜頭氣味的濃度。儘管如此,與光氣相比它非常易燃且效果較低,因此從未正式用作武器。另一方面,有幾種基於砷化氫的有機化合物,例如:路易斯毒氣(氯乙烯氯胂)、亞當毒氣(二苯胺氯胂)、克拉克一號毒氣(二苯胺氯胂)、克拉克二號毒氣(二苯氰化胂)等則曾用於化學戰中。
探測砷中毒
AsH3在司法科學中亦非常著名,因為它可用於砷中毒的探測。舊的(但特別敏感的)馬氏試砷法樣品中含砷時便會釋放出砷化氫。[3] 此方法大約在1836年由詹姆士·馬西發明。它是基於受害者身體(通常在胃部)的含砷樣本與無砷鋅及稀硫酸的反應:如樣本含砷,氣態砷化氫便會生成。其後氣體通過玻璃管,在250-300°C的溫度下分解。若裝置中加熱部份有砷鏡生成,便表明砷的存在。而若裝置的清涼部分有黑鏡沉澱物生成,則表明銻的存在。
十九世紀末至二十世初,馬氏試砷法曾廣泛使用,但被更多經過改善的、更複雜的技術取代,例如:用於司法領域的中子活化分析。
環境影響
健康危害
侵入途徑:吸入。
慢性影響:長期在低濃度環境中作業主要表現為頭痛、乏力、噁心、嘔吐,較重者可有多發性神經炎,常伴有貧血。
環境行為
燃燒(分解)產物:氧化砷。
應急處理
泄漏處理
迅速撤離泄漏污染區人員至上風處,並立即隔離450米,嚴格限制出入。切斷火源。建議應急處理人員戴自給正壓式呼吸器,穿防毒服。儘可能切斷泄漏源。合理通風,加速擴散。噴霧狀水稀釋、溶解。構築圍堤或挖坑收容產生的大量廢水。如有可能,將漏出氣用排風機送至空曠的地方或裝設適當噴頭燒掉。漏氣容器要妥善處理,修復、檢驗後再用。
防護措施
眼睛防護:呼吸系統防護中已作防護。
身體防護:穿面罩式膠布防毒衣。
手防護:戴橡膠手套。
其它:工作現場嚴禁吸菸、進食和飲水。工作畢,淋浴更衣。保持良好的衛生習慣。進入罐、限制性空間或其它高濃度區作業,須有人監護。
急救措施
吸入:迅速脫離現場至空氣新鮮處。保持呼吸道通暢。如呼吸困難,給輸氧。如呼吸停止,立即進行人工呼吸。就醫。
滅火方法:消防人員必須佩戴過濾式防毒面具(全面罩)或隔離式呼吸器、穿全身防火防毒服,在上風處滅火。切斷氣源。若不能立即切斷氣源,則不允許熄滅正在燃燒的氣體。噴水冷卻容器,可能的話將容器從火場移至空曠處。滅火劑:霧狀水、泡沫、乾粉。
毒理學簡介
人吸入TCL0: 3 ppm; LCL0: 25 ppm/30M,300 ppm/5M。人(男性)吸入TCL0: 325 ug/m3。
急性毒性:LC50390mg/m,10分鐘(大鼠吸入):250mg/m,10分鐘(小鼠吸入)。
致癌性:IARC致癌性評論:人為陽性反應。
砷化氫經呼吸道吸入後,隨血循環分布至全身各臟器。其中以肝、肺、腦含量較高。人脫離接觸後,砷化氫部分以原形自呼氣中排出; 如腎功能未受損,砷-血紅蛋白複合物及砷的氧化物可自尿排出。
臨床表現
重度中毒發病急劇,有寒顫、高熱、昏迷、譫妄、抽搐、紫紺、鞏膜及全身重度黃染。少尿或無尿。貧血加重,網織紅細胞明顯增多。尿呈深醬色,尿隱血強陽性。血尿素氮明顯增高,出現急性腎功能衰竭,並伴有肝臟損害。根據職業接觸史,現場調查,典型病例診斷並不困難。早期症狀需與急性胃腸炎和急性感染相鑑別。發生溶血後,須與其他原因引起的溶血相鑑別。在急性中毒尤其在早期,尿砷可正常,早期檢查尿常規、尿膽原、黃疸指數,以及網織紅細胞等,有助於診斷。
處理
立即脫離接觸,安靜、給氧、保護肝、腎和支持、對症治療。為減輕溶血反應及其對機體的危害,應早期使用大劑量腎上腺糖皮質激素,並用鹼性藥物使尿液鹼化,以減少血紅蛋白在腎小管的沉積。也可早期使用甘露醇以防止腎功能衰竭。重度中毒腎功能損害明顯者需用透析療法,應及早使用; 根據溶血程度和速度,必要時可採用換血療法。
巰基類解毒藥物並不能抑制溶血,反而會加重腎臟負擔,所以。驅砷藥物應在中毒後數日溶血反應基本停止後才使用。
標準
車間空氣衛生標準:中國MAC 0.3 mg/m3; 美國OSHA PEL-TWA 0.2 mg/m3
*本頁內容摘錄自《化學事故技術援助數據系統》(上海市化工職業病防治院出版,v1.0),僅供學術參考和普及勞動衛生知識之用。
危害
來源
砷化氫屬高毒類,為某些工業在生產過程中所產生的廢氣。在職業接觸多種金屬(如鋅、錫、銻、鉛、銅等)礦石中常含有硫化砷。含砷礦石在冶煉、加工、儲存過程中遇酸(硫酸、鹽酸)、濕均可產生砷化氫。另外生產和使用乙炔生產合成染料,氰化法提鍊金銀等也可產生砷化氫。故中毒可見於多種行業,而以冶金工業最多見。
中毒臨床表現
急性砷化氫中毒臨床表現:中毒的嚴重程度與吸入量有明顯的關係;潛伏期一般為半小時至數小時,起病急,依次出現急性溶血及急性腎功能損害為主的各種表現。常有頭疼、頭暈、乏力、四肢酸疼等,伴噁心、嘔吐、腹疼、呼氣中有大蒜臭味,溶血多在3小時內發生。有畏寒、發熱、黃疸、尿呈暗紅色(血尿)。重症患者多由於短時間內吸入高濃度砷化氫所致,半小時內發病,常以寒戰、高燒、意識模糊、黃疸、尿呈醬油色、少尿或無尿、腎功能明顯異常,血清尿素氮、肌肝增高,此外由於紅細胞大量破壞,細胞內的鉀釋入血漿內,血鉀迅速升高,而引起心肌損害,如心肌興奮性降低,傳導阻滯、心博驟停、此為少尿期的主要死因。另外還可有肝臟病變、肺水腫、心力衰竭、酸中毒。