Varubi
2015年9月1日,Tesaro製藥公司研發的一款止吐藥Varubi(rolapitant)獲得FDA批准,聯合其他止吐劑用於預防與致吐性癌症化療(包括但不限於高度致吐性癌症化療HEC)初次或多次治療相關的遲發性噁心及嘔吐。
基本介紹
- 藥品名稱:Varubi
- 外文名:rolapitant
- 別名:rolapitant
- 主要適用症:預防延遲性噁心和嘔吐伴隨致吐癌化療
- 劑型:片劑
藥品信息,用途,給藥方法,劑型和規格,禁忌證,注意事項,不良反應,藥物相互作用,特殊人群使用,妊娠,哺乳,兒童使用,老年人使用,肝受損,藥物過量,一般描述,臨床藥理學,作用機制,藥效動力學,藥代動力學,非臨床毒理學,臨床研究,貯存和處置,包裝,藥房,貯存,患者諮詢資料,
藥品信息
商品名:Varubi
通用名:rolapitant
給藥途徑:片劑,口服
批准日期:2015年9月1日
NDC:69656-101-02
公司:美國Tesaro製藥公司
用藥指導(中國):好醫友(Haoeyou)
用途
Varubi是適用為在成年中預防延遲性
噁心和嘔吐伴隨致吐癌化療,包括,但不限於,高度致吐化療開始和重複療程與其它止吐藥聯用。
給藥方法
預防伴隨致吐癌化療的噁心和嘔吐
在表1中顯示成年中Varubi與一種5-HT3受體拮抗劑和
地塞米松聯用的推薦劑量。Rolapitant和地塞米松間沒有藥物相互作用,所以對地塞米松無需劑量調整。在第1天給予一次地塞米松劑量20mg[見臨床藥理學(12.3)]。
每個化療周期開始前給予Varubi,但間隔不低於2周。
表1
 表1
表1給予Varubi不不考慮進餐。
劑型和規格
片:90mgrolapitant;薄膜包衣膠囊形狀,藍色片,在一側凹陷有T0101和另一側100。
禁忌證
接受硫利達嗪,一種CYP2D6底物患者禁忌Varubi。硫利達嗪血漿濃度顯著增加可能導致QT延長和尖端扭轉型室速[TorsadesdePointes]。
注意事項
5.1與有一個狹窄治療指數CYP2D6底物相互作用
一次單劑量Varubi給藥後Varubi對CYP2D6的抑制性影響至少持續共7天和可能持續更長[見禁忌證(4),藥物相互作用(7),臨床藥理學(12.3)]。正在接受
匹莫齊特,一種CYP2D6底物患者避免使用Varubi。匹莫齊特血漿濃度的增加可能導致QT延長。如Varubi和有一個狹窄治療指數其它CYP2D6底物的同時使用不能避免監視不良反應。
不良反應
6.1臨床試驗經驗
因為臨床試驗是在廣泛不同情況下進行的,臨床試驗觀察到不良反應率不能與另一種藥臨床試驗發生率直接比較而且可能不反映實踐中觀察到的發生率。
在4項對照臨床試驗在約2800例患者接受致吐癌化療患者中評價Varubi的安全性。Varubi是與一個5-HT3受體拮抗劑和地塞米松給予聯用。在化療的第1療程的第1天,1567例患者被用Varubi治療和這些患者的1198例繼續進入選定的多療程延伸至6療程的化療。給予180mg的Varubi療程中位數是四個。Varubi180mg是給予至1294例患者。
在療程1用Varubi治療約7%患者被報導不良反應與之比較用對照治療患者約6%。在表2和表3列舉發生率≥3%和大於對照最常見不良反應。
表2表3
 表2
表2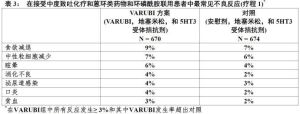 表3
表3 在多-療程高度和中度致吐化療延伸研究直至6個療程化療不良反應一般地是與療程1中觀察到相似。
藥物相互作用
7.1Varubi對其他藥物的影響
Rolapitant不是CYP3A4的一種抑制劑或誘導劑。因此,對地塞米松(CYP3A4底物)當與Varubi共同給藥時無需劑量調整[見劑量和給藥方法(2)]。
Rolapitant是一個中度CYP2D6抑制劑,一個乳腺癌耐藥蛋白(BCRP)的抑制劑和一個
P-糖蛋白(P-gp)的抑制劑[臨床藥理學(12.3)]。
有狹窄治療指數CYP2D6底物:增加CYP2D6底物的血漿濃度可能導致潛在的不良反應。一次單劑量Varubi後7天觀察到
右美沙芬[dextromethorphan]的暴露,一種CYP2D6底物,增加三倍。沒有研究超過7天CYP2D6抑制作用的時間和可能持續更長[臨床藥理學(12.3)]。禁忌同時使用硫利達嗪[見禁忌證(4)]。避免Varubi與匹莫齊特使用[見警告和注意事項(5.1)]。如同時使用與匹莫齊特不能避免監視QT延長。如與有狹窄治療指數CYP2D6底物同時使用不能避免監視不良反應。
有狹窄治療指數BCRP底物(如,
甲氨蝶呤[Methotrexate],拓撲替康[topotecan],或
伊立替康[irinotecan]):增加BRCP底物的血漿濃度可能導致潛在不良反應。如Varubi的使用不能避免監視與同時藥物相關不良反應。使用
羅蘇伐他汀[rosuvastatin]的最低有效劑量(見資料對推薦給藥另外資料)。
有狹窄治療指數P-gp底物:增加地高辛[digoxin],或其它P-gp底物血漿濃度,可能導致潛在不良反應[見臨床藥理學(12.3)]。監視增加地高辛濃度。如不能避免Varubi與其它有狹窄治療指數P-gp底物同時使用監視不良反應。
7.2其他藥物對Varubi的影響
強CYP3A4誘導劑(如,利福平):顯著減低rolapitant的血漿濃度可能減低Varubi療效;在需要這類藥物慢性給藥患者中避免使用Varubi。
特殊人群使用
妊娠
風險總結
對Varubi在妊娠婦女中使用沒有可得到數據以告知任何藥物相關風險。在動物生殖研究,在大鼠和兔在器官形成期間用口服給予rolapitant鹽酸鹽在劑量至最大推薦人劑量(MRHD)分別1.2倍和2.9倍時沒有觀察到致畸胎或胚胎-胎兒影響[見數據]。在美國一般人群,重大
出生缺陷和在公認臨床妊娠流產的估算背景風險分別是2至4%和15至20%。
數據
動物數據
在妊娠大鼠器官形成期始終給予口服劑量等同於至22.5mg/kg每天rolapitant游離鹼評估rolapitant鹽酸鹽的胚胎-胎兒毒性潛能。大鼠給予劑量等同於13.5或22.5mg/kg每天rolapitant游離鹼表現出母體毒性的證據包括給藥頭一周期間體重增量減低和/或體重減輕和同時食耗量減低。在劑量等同於至22.5mg/kg每天rolapitant游離鹼(在體表面積基礎上推薦人劑量約1.2倍)未觀察到致畸胎或胚胎-胎兒效應。在兔中器官形成階段始終給予rolapitant鹽酸鹽,口服劑量等同於至27mg/kg每天rolapitant游離鹼(在體表面積基礎上推薦人劑量約2.9倍)對發育胎兒無影響。
在大鼠器官形成期和哺乳階段給予口服劑量等同於2.25,9或22.5mg/kg每天rolapitant游離鹼評估rolapitant鹽酸鹽的圍產期發育影響。在劑量等同於22.5mg/kg每天游離鹼(在體表面積基礎上推薦人劑量的約1.2倍)根據死亡/瀕死狀態,體重和食耗量減低,總幼崽丟失,分娩延長,妊娠長度縮短,和植入部位下落不明數增加母體毒性明顯。在這個劑量對子代影響包括產後活存數減低,和體重和體重增量減低,和可能與觀察到母體毒性相關。在母體劑量等同於9mg/kg每天rolapitant游離鹼(在體表面積基礎上約推薦人劑量0.5倍),在迷宮測試雌性幼崽記憶減低和幼崽體重減輕。
哺乳
風險總結
對在人乳汁中rolapitant的存在,在哺乳餵養嬰兒rolapitant的影響,或rolapitant對乳汁生成的影響沒有數據。Rolapitant鹽酸鹽口服給予哺乳雌性大鼠在乳汁中存在[見數據]。哺乳餵養的發育和健康獲益應與母親對Varubi的臨床需求和哺乳餵養嬰兒來自Varubi或來自母體所患情況或同時化療使用任何潛在不良影響一起考慮。
數據
放射性來自標記的[14C]rolapitant鹽酸鹽一次單次口服劑量等同於22.5mg/kgrolapitant游離鹼被轉移至哺乳大鼠乳汁,而在給藥後12小時觀察到乳汁中最大放射性。在母獸中在給藥後1至48小時均數乳汁/血漿放射性濃度比值範圍從1.24至3.25。根據平均每天乳汁耗量(2mL/day)和最大乳汁放射性測定,幼崽暴露預計是口服給予劑量的0.32%。
兒童使用
未曾確定在兒童患者中Varubi的安全性和療效。
老年人使用
在1294例用Varubi治療受試者中,25%是65歲和以上,而5%是75歲和以上。老年受試者和較年輕受試者間未報導安全性和療效總體差別,但不能除外有些老年個體更大靈敏度。
肝受損
在有輕度(Child-Pugh類別A)或中度(Child-Pugh類別B)肝受損患者無需劑量調整。在有嚴重肝受損(Child-Pugh類別C)患者中沒有臨床或
藥代動力學數據。在有嚴重肝受損患者中避免使用Varubi。如不能避免使用,監視患者與rolapitant相關不良反應[見不良反應(6.1)]。
藥物過量
對用Varubi過量沒有數據。
對Varubi過量沒有抗毒物。在過量事件中終止Varubi,和開始一般支持措施和密切觀察。
一般描述
Varubi片含90mgrolapitant(等同於100mgrolapitant鹽酸鹽),一種物質P/神經激肽1(NK1)
受體拮抗劑。鹽酸Rolapitant是化學上被描述為(5S,8S)-8-{[(1R)-1-[3,5-bis(trifluoromethyl)phenyl]ethoxy]methyl]}-8-phenyl1,7-diazaspiro[4.5]decan-2-one單鹽酸鹽一水合物。它經驗式為C25H26F6N2O2·HCl·H2O和其結構式為:
分子式
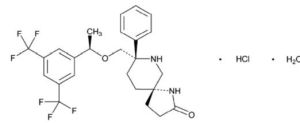 分子式
分子式rolapitant鹽酸鹽
Rolapitant鹽酸鹽是白色至淡白色粉,分子量554.95。Rolapitant鹽酸鹽在水性溶液中的溶解度是依賴pH和在較低pH更溶解。Rolapitant鹽酸鹽在常見藥學溶劑中溶解度好例如乙醇,丙二醇,和40%羥丙基
β-環糊精.
為口服給藥每片含90mgrolapitant和以下無活性成分:一水乳糖,
預膠化澱粉,
微晶纖維素,聚維酮,
羧甲基纖維素鈉,膠體
二氧化矽和
硬脂酸鎂。片被包裹在非-功能性藍和清漆。片包衣由以下無活性成分組成:聚乙烯醇,二氧化鈦,聚乙二醇,滑石,FD&CBlueNo.2靛藍胭脂紅湖和聚山梨醇80。
臨床藥理學
作用機制
Rolapitant是一個人物質P/NK1受體的選擇性和
競爭性拮抗劑。Rolapitant對NK2或NK3受體或對一組其它受體,轉運蛋白,酶和離子通道沒有顯著親和力。Rolapitant在動物化療誘發嘔吐的模型中也有活性。
藥效動力學
NK1受體占領
一項人類
正電子發射斷層掃描(PET)研究用rolapitant顯示rolapitant跨越血腦屏障和占領腦NK1受體。在從4.5mg至180mg的rolapitant觀察到均數NK1受體占領一個劑量-依賴增加。在健康受試者一次單劑量給藥後在180mg劑量rolapitant在120小時,紋狀體均數NK1受體占領為73%。未曾確定NK1受體占領和rolapitant的臨床療效間相互關係。
心臟電生理學
在一項徹底QT研究,rolapitant在劑量較高於推薦劑量四倍對QT間期無顯著影響。
藥代動力學
吸收
健康受試者在空腹條件下給予一次單劑量180mgVarubi後,在血漿中30分鐘間可測量到rolapitant和約4小時達到rolapitant峰血漿濃度(Cmax)而均數Cmax為968ng/mL(%CV:28%)。
每天1次多次口服劑量9至45mgrolapitant後,rolapitant的積蓄約5-倍。
當rolapitant的劑量從4.5mg增加至180mg,對rolapitant全身暴露(Cmax和AUC)以劑量正比例的方式增加。隨劑量從推薦臨床劑量180mg增加四倍,rolapitant的Cmax和AUC分別增加3.1倍和3.7倍。
高脂肪餐同時給藥不顯著影響180mgVarubi給藥後rolapitant的藥代動力學[見劑量和給藥方法(2)]。
分布
Rolapitant是高度蛋白結合至人血漿(99.8%)。在健康受試者中
表觀分布容積(Vd/F)為460L,表明rolapitant的廣泛組裝分布。在癌症患者中Rolapitant的
群體藥代動力學分析Vd/F為387L。
消除
單次口服rolapitant劑量(4.5至180mg)後,rolapitant的均數末端半衰期(t1/2)範圍從169至183小時(約7天)和與劑量無關。在癌症患者中一項群體藥代動力學分析rolapitant的表觀總清除率(CL/F)為0.96L/hour。
代謝
Rolapitant是主要地被CYP3A4代謝形成主要活性代謝物,M19(C4吡咯烷羥基化rolapitant)。在一項物料平衡研究中,代謝物M19是主要循環代謝物。M19的形成顯著延遲有中位Tmax為120小時(範圍:24-168小時)和M19的均數半衰期為158小時。
在血漿中M19與rolapitant的暴露比值為約50%。
排泄
Rolapitant是主要地通過肝/膽途徑消除。一個單次口服180-mg劑量的[14C]-rolapitant給藥後,跨越6周在尿和糞中分別回收平均14.2%(範圍9%至20%)和73%(範圍52%至89%)劑量。在跨越2周收集的合併樣本,在尿中主要地回收8.3%的劑量主要地為代謝物和在糞中主要回收37.8%劑量主要地為未變化rolapitant。在合併尿樣本中未發現未變化rolapitant或M19。
特殊人群
年齡,性別和種族/民族
群體藥代動力學分析表明年齡,性別和種族對rolapitant藥代動力學無顯著影響。
肝受損
一次單劑量180mgrolapitant給予有輕度肝受損(Child-Pugh類別A)患者後,rolapitant的藥代動力學與健康受試者有可比性。有中度肝受損(Child-Pugh類別B)患者中rolapitant的均數Cmax為25%較低而均數AUC與健康受試者比較相似。輕度或中度肝受損患者對M19中位Tmax被延遲至204小時與之比較健康受試者為168小時,沒有研究有嚴重肝受損(Child-Pugh類別C)患者的rolapitant藥代動力學[見特殊人群中使用(8.6)]。
腎受損
在群體藥代動力學分析,在有輕度(CLcr:60至90mL/min)或中度(CLcr:30至60mL/min)腎受損癌症患者與正常腎功能癌症患者比較,在基線時肌酐清除率(CLcr)對rolapitant藥代動力學未顯示顯著影響。對嚴重腎受損的影響資料不充分。沒有在有終末腎病需要血液透析患者中研究rolapitant的藥代動力學。
藥物相互作用研究
其他藥物對Varubi的影響
Rolapitant是對CYP3A4一個底物。
CYP3A4誘導劑
一個CYP3A4誘導劑的同時給藥對rolapitant全身暴露顯著減低。當給予一次單劑量180mgrolapitant前和7天后,給予每天1次600mg利福平共7天,與單獨給予rolapitant比較,rolapitant的均數Cmax被減低30%和均數AUC被減低85%。Rolapitant的均數半衰期從無利福平時176小時減低至有同時利福平的41小時[見藥物相互作用(7)]。
CYP3A4抑制劑
當酮康唑[ketoconazole],一種強CYP3A4抑制劑是與rolapitant給藥,未見對rolapitant的藥代動力學臨床上顯著影響。400mg酮康唑每天1次共21天接著一次單次90mg劑量rolapitant的同時給藥,沒有顯著影響rolapitant的Cmax而AUC增加21%。
Varubi對其他藥物的影響
下面總結Varubi對CYP450酶和轉運蛋白的影響。見表4對Varubi的臨床劑量對共同給藥藥物的藥代動力學影響的總結。.
CYP3A4底物
Rolapitant不是CYP3A4的一種抑制劑也不是一種誘導劑。
咪達唑侖[Midazolam]:一次單劑量180mgrolapitanthadnosignificanteffects對咪達唑侖的藥代動力學沒有顯著影響,當在第1天口服咪達唑侖3mg被共同給藥和在第6,和9天單獨給予。
昂丹司瓊[Ondansetron]:當在相同天與一次單次180mg劑量rolapitant同時給予時,Rolapitant對靜脈昂丹司瓊的藥代動力學無顯著影響。
地塞米松:當一次單次180mg劑量rolapitant被共同給藥後,在第1至3天口服地塞米松,Rolapitant對地塞米松的藥代動力學沒有顯著影響[見劑量和給藥方法(2]。.
CYP2D6底物
Rolapitant是CYP2D6一個中度抑制劑[見禁忌證(4),警告和注意事項(5.1),藥物相互作用(7)]。
BCRP轉運蛋白
Rolapitant是一個BCRP轉運蛋白的抑制劑[見藥物相互作用(7)]。
P-糖蛋白底物
Rolapitant是一個P-gp轉運蛋白抑制劑[見藥物相互作用(7)]。
對其它CYP酶底物
體外研究提示rolapitant不是一個CYP1A2和CYP2E1抑制劑。根據體外研究似乎不可能通過一個CYP2A6的抑制作用臨床上意義藥物相互作用。
在第1天給予一次單劑量180mgrolapitant和在第8天不用對下列藥物藥代動力學未見臨床意義相互作用:
瑞格列奈[repaglinide](CYP2C8底物;對第1天瑞格列奈0.25mg無影響;對第8天:Cmax和AUC分別增加29%和24%),依非韋倫[efavirenz](CYP2B6底物;依非韋倫600mg在第1天Cmax減低18%和對AUC無影響;在第8天:對Cmax無影響和AUC增加28%),
甲苯磺丁脲[tolbutamide](CYP2C9底物;在第1天和第8天用甲苯磺丁脲500mg無影響),或
奧美拉唑[omeprazole](CYP2C19底物;在第1天用奧美拉唑40mgCmax增加44%和AUC增加23%;第8天:Cmax和AUC分別增加37%和15%)。
表4
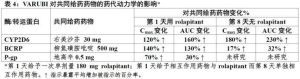 表4
表4非臨床毒理學
13.1癌發生,突變發生,生育力受損
在CD-1小鼠和Sprague-Dawley大鼠在2-年致癌性研究中評估rolapitant鹽酸鹽的致癌性潛能。在小鼠中,在劑量等同於至135mg/kg每天rolapitant游離鹼(在體表面積的基礎上約人推薦劑量的3.6倍)無藥物相關腫瘤發現。在大鼠中,在劑量等同於至90mg/kg每天rolapitant游離鹼(在體表面積基礎上約人推薦人劑量4.9倍)無藥物相關腫瘤發現。
Rolapitant鹽酸鹽在一個Ames試驗,一個人
外周血淋巴細胞染色體畸變試驗,和一個小鼠
微核試驗沒有遺傳毒性。
在雌性大鼠一項生育力和早期
胚胎髮育研究,rolapitant鹽酸鹽在口服劑量等同於9mg/kg每天游離鹼(在體表面積基礎上約推薦人劑量0.5倍)致母體體重暫時減低和植入植入前和後丟失發生率增加。在一個劑量等同於4.5mg/kg每天游離鹼(在體表面積基礎上約推薦人劑量0.2倍),黃體和植入部位數略微減低。Rolapitant鹽酸鹽在劑量等同於至90mg/kg每天rolapitant游離鹼(在體表面積基礎上約推薦人劑量4.9倍)不影響雄性大鼠生育力或一般生殖性能。
臨床研究
基於順鉑高度致吐化療(HEC)
在兩項多中心,隨機化,雙盲,平行組,對照臨床研究(研究1和研究2),Varubi方案(Varubi,格拉司瓊和地塞米松)與對照治療比較(安慰劑,格拉司瓊和地塞米松)在患者接受一個化療方案包括順鉑>60mg/m2。對治療方案見表5。
表5
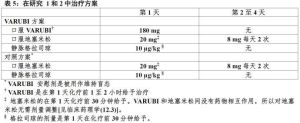 表5
表5研究1
總共532例患者被隨機化至或Varubi方案(N=266)或對照治療(N=266)。在療效評價中總共被包括526例患者。那些隨機化中42%是婦女,58%男性,67%白種人,23%亞裔,1%黑種人。和9%多種族/其它/未知。來自北美患者的比例是16%。在這項臨床研究患者範圍從20至90歲,有一個均數年齡57歲。在研究1中,26%患者是65歲或以上,有3%患者是75歲或以上。均數順鉑劑量為77mg/m2。
在本項研究期間,82%患者接受一個同時
化療藥物除了方案規定順鉑。在第1療程期間最常同時化療藥物是:
吉西他濱[gemcitabine](17%),紫杉醇[paclitaxel](12%),
氟尿嘧啶[fluorouracil](11%),
依託泊苷[etoposide](10%),長春瑞濱[vinorelbine](9%),多西他賽[docetaxel](9%),
培美曲塞[pemetrexed](7%),
多柔比星[doxorubicin](6%)和
環磷醯胺(5%)。
研究2
總共555例患者被隨機化至或Varubi方案(N=278)或對照治療(N=277)。在療效評價中總共包括544例患者。那些隨機化中,32%是婦女,68%男性,81%白種人,14%亞裔,1%黑種人,和5%多種族/其它/未知。來自北美患者的比例為7%。在這項臨床研究患者範圍從18至83歲,有均數年齡58歲。在這項研究中,27%患者為65歲或以上,有3%患者是75歲或以上。均數順鉑劑量為76mg/m2。
在這項研究期間,85%患者接受一個同時化療藥物除了方案規定順鉑。在療程1期間最常給予同時化療藥物是:長春瑞濱(16%),吉西他濱(15%),氟尿嘧啶(12%),依託泊苷(11%),培美曲塞(9%),多西他賽(7%),紫杉醇(7%),表柔比星[epirubicin](5%)和
卡培他濱[capecitabine](4%)。
在兩項研究中主要終點是在化療誘導噁心和嘔吐延遲期(25至120小時)完全緩解[completeresponse](被定義為無嘔吐發作和無搶救藥物)。
研究3
在研究3,一項多中心,隨機化,雙盲,平行組,對照臨床研究在中度致吐化療(MEC),Varubi方案(Varubi,格拉司瓊和地塞米松)是與對照治療(安慰劑,格拉司瓊和地塞米松)比較在患者接受一個中度致吐化療方案包括至少50%患者接受一個蒽環類藥物和環磷醯胺聯用。在療程1中接受卡鉑[carboplatin]患者的百分率是30%。在表6中總結對Varubi和對照臂治療方案。
表6
 表6
表6總共1369患者被隨機化至或Varubi方案(N=684)或對照治療(N=685)。總共1332例患者被包括在療效的評價。那些被隨機化中80%是婦女,20%男性,77%白種人,13%亞裔,4%黑種人,和6%多種族/其它/未知。來自北美患者比例是33%。在這項臨床研究患者範圍從22至88歲,均數年齡57歲。在這項研究,28%患者是65歲或以上,有7%患者是75歲或以上。
主要終點是在化療誘發噁心和嘔吐的延遲期(25至120小時)完全緩解(被定義為無嘔吐發作和無搶救藥物)。
在表7中顯示從HEC研究1和2,和對MEC研究3研究結果的總結。
表7
 表7
表7多療程延伸擴展:在研究1,2,和3,患者有選擇繼續進入一個多療程延伸擴展直至5個另外化療療程接受相同治療在療程1賦予。在化療開始後第6至8天,患者被詢問回憶他們是否有嘔吐任何發作或乾嘔或噁心干擾正常每天生活。在下圖1中按研究和治療組總結結果。
研究和治療組總結結果
 圖1
圖1貯存和處置
包裝
Varubi是可得到為膜包衣,膠囊形狀,藍片,在一側凹陷有T0101和其它側100。每片含90mgrolapitant。Varubi片被包裝在一個Aclar泡殼有鋁箔襯紙和供應如下:
NDC69656-101-02一個單劑量包裝(2片作為一組一對泡卡)
藥房
美國是醫藥分開的國家,藥房全部實行嚴格的處方藥與非處方藥分類管理。對處方藥的銷售,必須憑美國醫生(電子/紙質)處方。如今國內患者可以依託科技,通過好醫友國際醫療平台實現遠程的病歷互動,由美國醫生根據患者病情開具電子處方,以正規渠道在美國好醫友藥房購買到處方藥。
貯存
在20º至25ºC(68º至77ºF;外出允許在15°C至30°C間(59°F至86°F)[見USP控制室溫]
患者諮詢資料
忠告患者閱讀FDA-批准的患者說明書(患者資料)。
藥物相互作用
忠告患者告訴他們的衛生保健提供者當他們開始或停止服用任何同時藥物。Varubi是一個中度CYP2D6抑制劑和可能增加CYP2D6底物血漿濃度如它們被共同給藥。一次單劑量後Varubi對CYP2D6的抑制性影響持續至少7天和可能持續長於7天[見禁忌證(4),警告和注意事項(5.1),藥物相互作用(7)]。











