概念 RNA剪接是
真核細胞 基因表達 中非常重要的一個生物過程,通過RNA剪接,可以產生許多具有功能的,帶有編碼信息的mRNA,它對生物的發育及進化至關重要。所以RNA剪接識別是正確理解基因表達過程的重要一步,而剪接的識別的關鍵是依賴於剪接位點的判定,本文的工作即是針對剪接位點的正確識別進行研究。真核細胞pre-mRNA的剪接位點處存在一定的序列保守性,對於它所對應的
cDNA 序列而言,
內含子 5’端(供體位點)和3’端(受體位點)的
鹼基 幾乎都是GU和AG,因此稱為
GU-AG規則 。
剪接途徑 RNA剪接可以有多種的方式。剪接的型式以
內含子 的結構及剪接所需的剪接因子而定。此外,RNA剪接還分為分子內 (intramolecular) 剪接 (
cis splicing) 以及分子間 (intermolecular) 剪接 (
trans splicing)。但不論哪一種途徑,移除的內含子都會被拋棄。
剪接體 內含子 經常存在於
真核生物 的蛋白質編碼
基因 (coding gene)中。在內含子裡,需要有 5' 剪接位點(5' splice site)、3' 剪接位點(3' splice site)及剪接分枝位點(branch point)來進行剪接。剪接是由
剪接體 (
Spliceosome )來催化,它是以五個不同的小核核糖核酸(snRNAs) 以及不下於一百個蛋白質所組成的大型
核糖核酸 蛋白質複合物,稱為小核核糖核蛋白(snRNP)。snRNP 的 RNA 會與內含子行雜交反應(hybridization),並且參與剪接的
催化反應 。
自剪接 自剪接 出現在稀少的
內含子 組成
核酸酶 ,核酸酶在只有
RNA 的情況下代替了
剪接體 的功能。自剪接的內含子有兩種,稱為第I型及第Ⅱ型。第I型及第Ⅱ型內含子以與剪接體類似的方式進行剪接,但不需要任何蛋白質。這種相似性使人相信這些內含子與剪接體在演化過程上有著關連。自剪接亦可能是非常古老,且可能出現在一個還未有蛋白質的核糖核酸世界。雖然以下兩種剪接可以在沒有蛋白質的情況下進行,但依然會額外的使用5個RNA分子及超過50多個蛋白質,並
水解 多個
三磷酸腺苷 (
ATP )分子。使用 ATP 是要提高剪接
mRNA 的準確性,避免出現錯誤。
游離
鳥嘌呤 核苷酸 (被包在
內含子 中)的3'
羥基 ,或是核苷酸輔助因子(即鳥苷單磷酸(GMP)、
鳥苷二磷酸 (GDP)、
鳥苷三磷酸 (GTP))攻擊內含子的5'剪接位點。內含子並不形成套索結構,而該鳥糞苷則會從內含子中轉移位置到內含子的5'位,從而成為第
I型內含子 的第一個核苷酸。
內含子 5'剪接位點上游
外顯子 最後一個核苷酸的3'羥基變成親核基,而第二次交酯化/轉酯化會將兩個外顯子接合。
以下是第Ⅱ型內含子
自剪接 的特徵(與第I型相同是兩次交酯化):
內含子內特定
腺苷 的2'
羥基 攻擊5'剪接位點,從而形成一個套索。
5'
外顯子 的3'羥基新親核基於3'剪接位點引發第二次的交酯化/轉
酯化反應 ,從而將兩個外顯子接合。
轉運RNA剪接 轉運RNA (tRNA)剪接是另一種較罕見的剪接方法,但是卻經常在 tRNA 出現。它的剪接反應涉及與
剪接體 或
自剪接 不同的生物化學過程。
核糖核酸酶 切開
RNA ,而
連線酶 (RNA ligase) 則將
外顯子 接合。這種剪接方式同樣不需要任何RNA分子來催化,而是一種全由蛋白質催化和作用的反應。整個過程中並未有交酯化/轉酯化作用。
剪接機制 RNA的剪接 就是要把
斷裂基因 的
轉錄本 中的
內含子 除去。酵母細胞核中400個tRNA基因中約有40個是斷裂基因。這些基因均只有一個內含子,位於與
反密碼子 的3'側相隔一個核苷酸之處,長度為14至46bp。不同胺基酸的tRNA基因中的內含子不相同,因此,剪接酶類看來並不能識別任何共同順序。所有內含子中均有一段與tRNA的反密碼子互補的序列,因而使反密碼臂的構象發生了改變,即反密碼子被配對而使反密碼臂伸長了很多。在前體中僅反密碼臂受到影響,tRNA分子的其他部分仍保持其正常結構。
酵母tRNAphe中的內含子能與其反密碼子
鹼基配對 ,從而改變了反密碼臂的結構。此剪下過程可分為兩個階段。第一步是
磷酸二酯鍵 的斷裂,這不需要
ATP 。這一步由一種內切核酸酶所催化。第二步是
連線反應 ,需要ATP的存在,由
RNA連線酶 所催化。在無ATP時,產生的兩個tRNA半分子不能連線起來。這兩個半分子具有獨特的末端:其5'端有OH基,而3'有一個2',3'-環磷酸基。當加入ATP時,即發生第二步反應:兩個tRNA半分子先發生
鹼基配對 ,形成成熟tRNA分子的構象,然後由RNA連線酶形成磷酸二酯鍵而將兩個半分子共價連線起來。2',3'-環磷酸基的存在並不限於酵母,在植物和哺乳動物的tRNA剪接反應中也有環狀基團的產生。在人的
HeLa細胞 中,
RNA連線酶 能將帶有2',3'-環磷酸基的RNA和另一帶有5'-OH基的RNA直接連線起來。酵母tRNA前體也可以在爪蟾的
卵母細胞 核提取液中正確地被剪接。這表示剪接反應沒有
種屬特異性 。爪蟾具有能識別酵母tRNA的
內含子 的酶類。
自身剪接反應
以前一直認為只有蛋白質有酶活性。這個概念在生物化學界已根深蒂固。然而近期發現RNA也可有酶活性。這種有酶活性的RNA有人稱之為ribozyme。
一種
四膜蟲 Tetrahumenathermophila的兩個主要rRNAs的基因和其他真核生物相類似(見前文),被
轉錄 在同一個初級
轉錄本 中。此轉錄本稱為35S前體RNA,較小的rRNA的序列在5'側,較大的rRNA(26S)序列則在3'側。在編碼26SrRNA序列存在一個單一的,短的(約400bp)
內含子 。如將這個35S前體RNA在體外溫育,可以發生自動剪接作用:內含子從前體中被切出,先呈線性RNA片段,後來又環化為
環狀RNA 。這個反應僅需要加入一種一價陽離子,一種二價陽離子,和一種
鳥嘌呤核苷酸 (G)。其他
鹼基 均不能代替G.但並不一定需要GTP;GDP;GMP和
鳥苷 都可以套用。這表示此反應並不需要能量供應。此外,此鳥嘌呤核苷酸必須有一個游離的3'-OH基。這個G要連線到
內含子 的5'端上(通過通常的
磷酸二酯鍵 )。當線性的內含子成為環狀時,其3'端可連線在距離5'端15個核苷酸之處,從而將原來5'端和15個鹼基的節段(包括G在內)排除出去。這種反應基本上是一種磷酸酯轉移反應。外顯子A的3'-OH基可直接和外顯子B的5'端相連線。亦即一個
磷酸酯 可以直接被轉移到另一個上去,不需要經過中間步驟(如
水解作用 之類),因此磷酸酯鍵的能量被保存著。這解釋了為什麼此反應不需要
水解 ATP 或GTP來供應能量。同時,兩次磷酸酯轉移反應似乎是緊密相連的,因為始終沒有找到過游離的
外顯子 (A或B)。而線性內含子的
環化 則可以被看作是第三個磷酸酯轉移反應。在體外系統中進行剪接時,並不需要蛋白質的存在。RNA有能力自行剪接,故稱為
自身催化作用 (auto catalysis)。
T.Cech和S.Altman各自獨立地發現RNA具有催化作用。從而改變了生物催化劑的傳統概念。為此他們共同獲得了1989年Nobel化學獎。1978年Altman從純化的
RNA酶 P中分離出一種多肽和一種RNA(M1RNA)。最初的實驗結果表明,蛋白質和M1RNA單獨都沒有酶活性,但二者混合在一起又可恢復活性。其它
生物材料 的實驗結果表明M1RNA是RNA酶P活性所必須的。1983年Altoman證明,在較高濃度的Mg2+存在下,單獨的M1RNA就可以催化tRNA前體的成熟,而單獨的蛋白質則沒有這種能力。這樣,RNA即可看作是個酶。事實上,M1RNA的酶活性並不比RNA酶P的粗製品的活性低。原來認為蛋白質賦予酶的活性,RNA只起某種輔助作用(例如幫助蛋白質與其底物結合),但現在發現這兩種功能已經倒轉。Cech給具有
催化活性 的RNA定名為ribozyme。
很長時間以來,人們就試圖自己設計和生產酶分子,但因蛋白質分子結構上的複雜性,迄今為止,尚無成功的例子。近年來隨著ribozyme的發現,
人工酶 (新概念下的酶,它的構件分子是核苷酸)的設計又產生了新的希望。澳大利亞的科學家就設計了九個ribozyme分子,它們都具備
內切酶 的活性,且切割位點有高度特異性。同時,ribozyme的活性隨pH、溫度、及陽離子濃度的變化而變化,顯示出典型的酶特性。由於ribozyme的作用位點高度特異,故可以用來切割特定的
基因轉錄 產物(RNA)。有人將這種切割作用叫做抗基因活性。因為切割的結果破壞了RNA,也就是抑制了基因的表達。這種特性為我們進行基因和病毒的治療提供了一個可行的途徑。
某些
線粒體 中的
內含子 也是自身剪接的內含子。一些常見的真菌,如
粗糙脈孢菌 (Neurosporacrassa),酒酵母(Saccharomycescerevisiae)等的線粒體內含子都能進行自身剪接,像
四膜蟲 中進行的磷酸酯轉移反應一樣。
能編碼蛋白質的內含子
某些真菌
線粒體 中的
內含子 有很不尋常的結構,這些內含子有編碼順序,這些順序的翻譯對於該順序所在的內含子的剪接是必須的。編碼
細胞色素b 的box基因在僅剪去內含子1時,會產生RNA成熟酶的mRNA。當內含子2亦被剪去時,才是細胞色素b的編碼順序的開端。線粒體中的box基因是編碼細胞色素b(
cytb )的。box基因中的
外顯子 1有417bp,編碼cytb的N端139個
密碼子 。內含子1有765bp,不編碼。外顯子2非常短,僅有5個密碼子。其後是一個很長的內含子2。內含子2的特點是其開頭840bp是一個開放讀框(ORF),有280個密碼子,其最後一個密碼子為
終止密碼子 。當將
內含子 1剪去後,翻譯即從外顯子1起始,通讀過外顯子2而進入內含子2的ORF,產生一個有423個
胺基酸殘基 的蛋白質(其中144個是cytb的N端胺基酸,279個則由內含子2編碼,稱為RNA成熟酶(maturase)。RNA成熟酶是特異地用來剪去內含子2的。這樣,這個酶促反應便成為一個非常敏感的
負反饋 徑路。去除內含子2後,
外顯子 1和2即與外顯子3相連線,因而破壞了編碼成熟酶的順序。
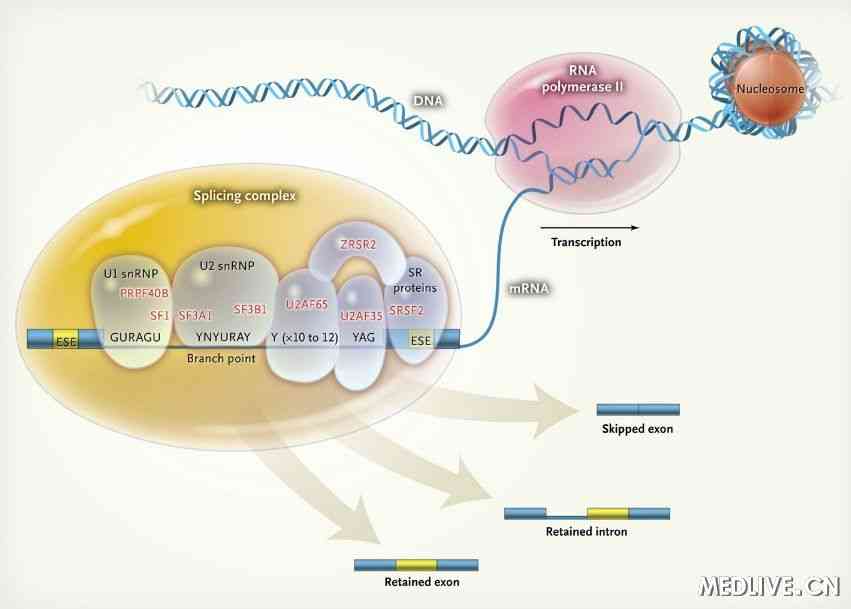
細胞核中的剪接連線點
剪接連線點(splicing junctions)是指在切斷和重接位點處的兩旁的順序。在
內含子 左側的連線點稱為供體(donor),在內含子右側的稱為受體(acceptor)。在細胞核的
結構基因 (即編碼多肽的基因)中的所有內含子在
外顯子 -內含子連線處均有GU...AG的共同順序。較詳細的共同順序如下,供體位點受體位點:
外顯子...AG↓GUAAGT...內含子...Py10CAG↓...外顯子
箭頭表示切斷的鍵。這些還是較短的共同順序,存在於幾乎所有的真核生物中。
從上述共同順序可見供體和受體位點之間並無互補現象,所以不可能想像這兩個位點會通過
鹼基配對 而結合一起,以便於
內含子 的切除。正確的剪接並依賴於天然前體RNA分子的完整性。一個外源基因如果存在於病毒順序中,仍能很好地被剪接。另外,前體RNA亦能在不同的組織,或甚至不同物種的細胞中被正確地剪接。這都表示剪接作用是很保守的。一個真正基因中一個
外顯子 可以和另一個基因的外顯子連線起來。例如,將
SV40 (
猴病毒40 )的早期
轉錄單位 的第一外顯子和小鼠β
珠蛋白 的第三外顯子相連,這樣形成的雜交內含子仍能正確地被剪接。即SV40的內含子的供體位點(1I)可以剪接到小鼠β珠蛋白的內含子的受體位點(r2)上。
套索的產生
HeLa細胞 的核提取液能夠剪接純化的RNA前體,這表示剪接作用並不與
轉錄 作用相關連。RNA的修飾也和剪接無關,例如
珠蛋白 RNAs即使缺少poly(A)尾鏈,也沒有
加帽 ,仍能正常地被剪接。剪接過程可分為兩個階段,與上文所述自身剪接不需能量不同,核內剪接需要用
ATP 。
在第一階段中,
內含子 左端(供體位點)處被切斷,形成兩個分離的RNA分子,即左
外顯子 和右內含子-外顯子。左外顯子此時為-線性分子,但右內含子-外顯子則不然:內含子左端(5'端)以5'-2'鍵與在內含子右端上游約30
鹼基 處的CUGAC序列(共同序列)中的A相連線,於是形成一個"套索"(lariat)"。在第二階段,在受體位點處被切斷而將此套索狀的內含子剪去;同時分離的右外顯子即與左外顯子相連線。套索然後被"脫支(debranch)"而形成一線性內含子。在這種剪接機構中,有三個很短的共同順序,即供體和受體位點處於一個和套索分支處的一個序列。用酵母做的實驗證明:分支處的共同順序如果發生突變或缺失將使剪接不能進行。這個共同順序常稱為UACUAAC盒。它和左側的供體位點共同順序互補,但研究證明兩者並不發生
鹼基配對 。在高等真核生物中此分支靶順序的保守性較小。
snRNAs的作用
真核細胞 有細胞核和細胞漿中都含有許多小RNA,它們約有100到300個
鹼基 ,每個細胞中可含有105-106個這種RNA分子。它們是由
RNA聚合酶 Ⅱ或Ⅲ所合成的,其中某些像mRNA一樣可被
加帽 。在細胞核中的小RNA稱為
snRNA ,而在細胞漿中的稱為
scRNA 。但在天然狀態下它們均與蛋白質相結合,故分別稱為snRNP和scRNP。某些snRNPs和剪接作用有密切關係。有些snRNPs分別和供體及受體剪接位點以及分支順序相互補。snRNAs中最受注意的一個是U1,它普遍存在於哺乳動物、鳥類和
昆蟲細胞 中。人U1snRNP中除RNA外還8個蛋白質分子。人U1snRNA的可能
二級結構 如圖。其5'端的11個核苷酸是單鏈的,並有一段和
內含子 左側的供體序列互補。在供體位點處的互補序列通常為4-6bp。在體外,完整的U1snRNP粒子能和左側共同順序結合,但純化的U1snRNA卻不能。U1snRNA參與剪接的證據是抗U1snRNP的抗體可以在體外抑制剪接作用;而且如果從系統中將U1snRNP除去,剪接即不能進行。事實上,除去U1sn RNA5'端的幾個核苷酸即可抑制體外剪接作用。
有可能U5snRNA能識別右側(受體位點)共同順序;而U2snRNA,則具有與分支位點互補的順序。抗U2snRNP的抗體可以和U2snRNA及包括分支位點在內的
內含子 所形成的複合體發生
免疫沉澱 。U1和U2可能參與剪接反應的起始階段,因為U1和U2的
滅活 將阻止左側連線點的切斷和套索的形成。另外兩個snRNAsns(U4和U6)可能亦參與剪接作用,但它們的功能尚不詳。一般認為,脊椎動物細胞有6種不同的snRNAs,稱為U1、U2、U3、U4、U5和U6。最小的是U6,有約100核苷酸長。最大的是U3,也不過215核苷酸長。它們和蛋白質結合成snRNPs。
系統性紅斑狼瘡 (SLE)患者和某些
風濕病 患者的血清中常可檢出對snRNPs中某些蛋白質的自身抗抗體。
核內不均一RNA
編碼蛋白質的
結構基因 是在
核漿 中被
轉錄 的。但是核漿中的RNA卻並不像mRNA。核漿RNA要大得多,很不穩定,並且其順序的複雜性也要大得多。由於它的大小很不一致,故稱
核內不均一RNA (
hnRNA )。已經證明mRNA確實是從hnRNA生成的。細胞漿內的mRNA平均只有1800-2000個
鹼基 。而哺乳動物的hnRNA平均有8000-10000個鹼基,其範圍很廣泛,從2000-14000鹼基均有,所以一般要比mRNA大4-5倍。如果以5倍計算,由於正常
哺乳動物細胞 中測得mRNA僅占hnRNA量的5%,則相當於有25%的hnRNA可轉變為mRNA。這意味著有3/4的
hnRNA 即在核內降解。hnRNA被切除
內含子 後即成為mRNA,並進入細胞漿內。但在切除內含子之前,hnRNA可先
加帽 和加poly(A)尾鏈。有一種稱為poly(A)聚合酶的酶可以用
ATP 為底物,以加上poly(A)尾鏈,這是hnRNA轉變為成熟的mRNA所必須的。在哺乳動物細胞中,僅約30%的hnRNA被
多聚腺苷酸化 ,而mRNA中卻約70%是有poly(A)尾鏈的。可能多聚腺苷酸化是hnRNA分子要被加工的信號。hnRNA的尾端要被切去一段,然後才加上poly(A)。因為
RNA聚合酶 在
轉錄 時即已通過了相當於加上poly(A)的位點,故hnRNA尾端的多餘部分要由內切核酸酶切去,才能加上poly(A)。
RNA的編輯 RNA的編輯是某些RNA,特別是mRNA前體的一種加工方式,如插入、刪除或取代一些核苷酸殘基。介導
RNA編輯 的機制有兩種:
特異性脫氨基作用
比如:哺乳動物的
載脂蛋白 mRNA的編輯 其蛋白
編碼區 的
DNA序列 在所有組織中都一樣;在肝臟中該
基因轉錄 為完整的蛋白質,而在腸中合成的Pr長度只有其一半(只是全長載脂蛋白的N端),是由於2153位上的
密碼子 從CAA突變為UAA(使編碼
谷氨醯胺 的密碼子變為
終止密碼子 )。還有一個例子 大鼠腦中的
谷氨酸受體 蛋白mRNA經編輯後,分子中有多個編碼
谷氨酸 的密碼子變成了在控制通過神經遞質的離子流過程中又主要作用的
精氨酸 ,表明RNA的編輯可能是充分發揮生理功能必需的。
以上兩種情況分別由胞嘧啶和
腺嘌呤脫氨酶 所催化;通常情況下該酶促反應的特異性不強,腺嘌呤脫氨酶可作用於雙鏈RNA區的任何
腺苷酸 殘基;但是,RNA的編輯發生在帶有具催化作用的脫氨酶亞基的複合體中,有附加的RNA結合區能幫助識別所編輯的特異性靶位點。
尿嘧啶插入或刪除
指導RNA:特異性插入這些殘基的信息來自因為它含有與編輯後mRNA互補的核苷酸序列,指導RNA與被編輯區及周圍部分核酸序列雖然有相當程度的互補性,但該RNA上存在一些未能配對的腺嘌lin,形成缺口為插入
尿嘧啶 提供了模板。
再編碼 mRNA在某些情況下不是以固定的方式翻譯,而可以改變原來的編碼信息,以不同的方式進行編碼 包括:+1/-1移位;
核糖體 跳躍
化學修飾 六大類化學修飾:
甲基化 ;去氨基化,硫代(S代替
鹼基 的O分子),鹼基的同分異構化(
尿嘧啶 變構生成假尿嘧啶);二價鍵的飽和化;核苷酸的替代(用不常見的核苷酸替換常見的核苷酸)
核酶 核酶(ribozyme)是指一類具有催化功能的RNA分子,通過催化靶位點RNA鏈中
磷酸二酯鍵 的斷裂,特異性地剪下底物RNA分子,從而阻斷基因的表達.
核酶的催化功能與其空間結構有密切關係,目前已知有多種特殊結構的核酶:
RNaseP的RNA鹼基(M1 RNA)、錘頭型、髮夾型
丁型肝炎病毒 RNA、1類
內含子 和2類內含子,大多有hammerhead structure。
1 剪下型核酶:只剪不接,如M1 RNA
2 剪接型核酶:該酶具有序列特異的內切核酸酶、
RNA連線酶 等多種酶活性,如1類和2類內含子
聯繫 為了識別在RNA干涉(RNAi)和
微RNA 介導 的
基因表達調控 中所涉及的因素,Gary Ruvkun及其同事對86種真核生物進行了系統發生分析,所得到的候選物再用
轉錄 和蛋白組相互作用數據進行Bayesian分析,來估計它們參與小RNA調控的機率。所識別出的小RNA
輔因子 中大約一半是RNAi沉默所必需的,其他當中的很多參與剪接,說明在這兩個過程之間存在一個聯繫。