基因反應
剪接方式並不是唯一的(參看替代剪接),所以外顯子只能在成體mRNA中被看出。即使是使用生物信息學方法,要精確預測外顯子的位置也是非常困難的,外顯子的識別及其拼接都是難題。
真核生物的
基因,其線性表達被
內含子阻斷,這就是所謂的
斷裂基因(英語splitgene),該現象的發現者RichardJ.Roberts和PhillipA.Sharp獲得了1993年
諾貝爾獎。
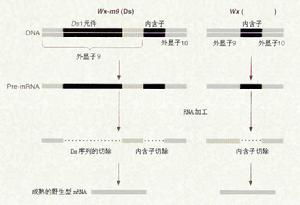 外顯子
外顯子表達序列
在
反式剪接中,不同mRNA的外顯子可以被接合在一起。外顯子在剪接(Splicing)後仍會被保存下來,並可在
蛋白質生物合成過程中被表達為蛋白質。外顯子是最後出現在成熟RNA中的
基因序列,又稱表達序列。既存在於最初的轉錄產物中,也存在於成熟的RNA分子中的核苷酸序列。術語外顯子也指編碼相應RNA外顯子的DNA中的區域。簡言之,外顯子就是指
真核細胞的基因在表達過程中能編碼蛋白質的核苷酸序列。關鍵概念:比較不同物種的相關基因,發現相應的外顯子序列通常是保守的,而
內含子序列則很少保守。編碼蛋白質的序列通常處於
選擇壓力之下,內含子由於沒有選擇壓力,因此比外顯子的進化快得多。通過確定在多種生物中出現的片段來鑑定編碼區域,而外顯子的
保守性可以作為這種鑑定的基礎。
人類大部分
基因組序列都是被垃圾DNA序列分隔成一段段,給定一個已知的目標蛋白質和基因組序列,在該基因組序列中找出一組子字元串(候選外顯子),使得其拼接(剪接)與目標蛋白質最匹配(即去掉垃圾DNA序列)。一個強力方法是尋找基因組序列與目標蛋白質序列間的所有局部相似性。若第一個取自基因組序列的子字元串展示了充分相似性於目標蛋白質,那么這個子字元串可被認為是一個推定的外顯子。將推定外顯子結構化為基因組序列中的賦權區間,它可用三個參數(l、r、w)來描述,l、r分別是推定的外顯子的左邊、右邊的位置,w為其權重。權重w可反該區間是一個外顯子的可能性。鏈是不重疊賦權區間的任一集合,一個鏈的總權重是該鏈中所有區間的權重之和。給定一個推定的外顯子集,尋找非重疊的推定的外顯子的一個最大集。輸入:賦權區間(推定的外顯子)集。輸出:該集合中區間的最大。
基因捕捉
外顯子捕捉(exontrapping)是構建一種載體,從其
插入片段中識別和回收外顯子序列,從而克隆目的
基因。捕捉外顯子的載體pETV—SD是一種
反轉錄病毒穿梭載體(shuttlevector),即可在不同種生物中如大腸桿菌和酵母,細菌和哺乳動物細胞等進行複製的載體(見圖5—14)。因為凡是有內含子和外顯子的基因在轉錄後都要經過RNA剪接,這就需要有
剪接供體(splicingdonor,SD)位點和
剪接受體(splicingacceptor,SA)位點。因此,SA位點可作為基因的標誌。pETV—咀載體的
克隆位點上游有一個“外顯子捕捉序列”(exontrapcassette),可用來識別載體的
插入片段中有無SA位點。它含有β—
珠蛋白(HBG)
基因的第1個外顯子及其有功能的SD位點,該基因的間隔序列(ⅣS)和α,β—半乳糖苷酶(αβ—GAL)基因。
 外顯子
外顯子 操作步驟
操作步驟及其基本原理是:
⑵將這些重組載體匯總後感染
反轉錄病毒的專宿包裝細胞系(ecotropicretroviralpackagingcellline)——ψ2細胞系。ψ2細胞提供蛋白質產物使載體(自身不能合成病毒蛋白質)成為反轉錄病毒在細胞里增殖。當反轉錄病毒在細胞內轉錄時,如果
插入片段中包含有功能的SA位點,則有可能發生RNA剪接反應而將ⅣS切除。
⑶已剪接和未剪接的病毒RNA都包裝在病毒子(virion)中,從細胞培養液中收集後用來感染兼宿
反轉錄病毒包裝細胞系(amphotropicretroviralpackagingcellline)PA-317。這使反轉錄病毒再進行一輪複製,並產生能感染猴腎細胞系COS細胞的高效價病毒原種。這樣做是由於上一輪克隆在病毒中的插入片段的剪接效率極低,而在第二輪複製時則大大提高了RNA剪接的機會。
⑷從第二個細胞系PA-317細胞中分離得到的病毒,用來感染組成型產生SV40T(腫瘤)抗原的COS細胞。病毒
RNA基因組被
反轉錄,並在載體上的SV40複製起點作用下,以環狀DNA
附加體形式進行複製。
⑸從COS細胞中回收複製的附加體DNA,經
限制性內切酶DpnI酶切後轉化細菌。在含卡那黴素(Kn)和5—氯—4—溴—3—
吲哚—β—D—半乳糖苷(X-gal)的培養基上挑選
轉化子。盧—半乳糖苷酶可水解X—gal而生成藍色產物。因此,不產生β—半乳糖苷酶的轉化子
菌落則呈白色。
⑹只挑選出白色菌落作進一步研究的材料。白色菌落的生成可以有二種原因。一是由於
基因發生突變,使夕—半乳糖苷酶失去活性;二是由於在
反轉錄病毒生活周期的RNA時期中發生了剪接反應,從而丟失了α,β—半乳糖苷酶基因。
⑺如果是基因突變,則大多數將是缺失了載體中的“
外顯子捕捉”部分,就可用人的口—
珠蛋白基因片段為探針作菌落雜交,很快可得到驗證。
⑻如果是真正發生了RNA剪接事件,準確的剪接反應可切除作為標記的ⅣS,使人口—珠蛋白基因的第1外顯子與落入了捕捉陷阱的
插入片段中的外顯子序列連線,這可直接測定其序列加以證明。從捕捉到的外顯子出發,就可進一步用作探針去從基因組
基因文庫或
cDNA文庫中分離出基因。
套用機理
套用
聚合酶鏈反應-
單鏈構象多態性(polymerasechainreaction-singlestrandconformationpolymorphsim,PCR-SSCP)及DNA直接測序技術檢測68例SAD患者和65名正常老年人的早老素-1
基因第5外顯子。
結果套用
結果發現68例SAD患者中有4例患者的SSCP發生泳動異常,DNA序列分析發現:這4例SAD患者的130號
密碼子發了CTG→ATG
錯義突變(388位點發生C→A突變),使
胺基酸由
亮氨酸變為蛋氨酸(Leu130Met);157號密碼子發生了GTG→CTG錯義突變(469位點發生G→C突變),使胺基酸由
纈氨酸變為亮氨酸(Val157Leu);有11例患者的SSCP表現為一條單鏈
電泳遷移率明顯增快,DNA序列分析發現:這11例SAD患者的130號密碼子發生了CTG→ATG錯義突變(388位點發生C→A突變),使胺基酸由亮氨酸變為蛋氨酸(Leu130Met);154號密碼子發生了TGC→TGT
同義突變(462位點發生C→T)突變。結論,發現在SAD患者中存在早老素-1基因第5外顯子突變,該突變點可能為中國人SAD患者早老素基因突變點之一。
 外顯子
外顯子多數早發性家族性
阿爾茨海默氏病(familialalzheimer'sdisease,FAD)與
14號染色體上的早老素-1(presenilin-1,PS-1)
基因突變有關,少數早發性FAD與PS-2基因突變有關。早老素
基因與散發性Alzheimer病(sporadicalzheimer'sdisease,SAD)的關係,目前國內外研究較少,為探討PS-1基因突變在SAD發病機理中的作用,我們用
聚合酶鏈反應-
單鏈構象多態性(polymerasechainreaction-singlestrandconformationpolymorphism,PCR-SSCP)、DNA直接測序技術檢測了68例SAD患者及65名正常老年人PS-1基因第5外顯子,發現在SAD患者中也存在PS-1基因第5外顯子突。
跳躍突變
超過一半的
基因編碼區的單核苷酸突變引起的疾病都是影響了RNA的剪下。例如這些突變導致
基因的外顯子缺失,被稱為外顯子跳躍現象。如果能將外顯子重新恢復到
基因轉錄本中去將會給許多疾病的治療帶來曙光。AdrianKrainerandLucaCartegni開發了一種新的方法ESSENCE(exon-specificsilencingenhancementbysmallchimericeffectors),模仿基本剪下因子SR(serine/arginine)蛋白的功能糾正這些遺傳的突變。SR蛋白結合於外顯子剪下增強因子(ESE-exonicsplicingenhancers),將剪下所需要的功能蛋白通過自身的
結構域(幾個
精氨酸和
絲氨酸組成的
二肽)招募到
轉錄本上來。
 外顯子
外顯子AdrianKrainerandLucaCartegni為了在外顯子跳躍突變中恢復正常的外顯子,將一個合成的RS(精氨酸-絲氨酸)結構域融合到能夠與
特異性外顯子結合的反義核苷酸片段上。他們首先檢測了ESSENCE方法對乳腺癌
基因1(BRCA1)突變的作用,BRCA1在外顯子18上的ESE突變會導致外顯子跳躍。他們發現將ESSENCE化合物與能夠與外顯子18反義結合的片段融合作用後在體外能夠恢復正常的剪下,其中反義片段和RS片段都是必需的。
研究者接著對另一種外顯子跳躍突變導致的疾病模型進行研究。
神經退行性疾病脊髓肌肉萎縮由運動神經元存活基因1(SMN1)的功能性拷貝缺失導致。SMN1的缺失可以有SMN2的功能所補償,但SMN2的外顯子7的單核苷酸突變會導致整個外顯子缺失。研究者發現用ESSENCE方法也能在體外恢復SMN2突變缺失的外顯子7。這個新方法雖然還需要體內的許多研究數據,但顯然對相關遺傳疾病的治療確實帶來的曙光。
基因識別
許多
基因中遺傳上的“無義”片段--即
內含子,會妨礙基因指導蛋白質的合成。現在,一篇發表於3月11日期的《自然遺傳學》雜誌上的文章提出了
基因識別這些內含子的新機制。
細胞產生一種蛋白質時,首先需要將編碼蛋白質的
基因轉化成RNA分子,接下來,通過細胞的剪接機制除去有潛在破壞作用的內含子,再把基因序列中剩下的所謂外顯子接合到一起。許多遺傳缺陷都是由於剪接過程出錯引起的。當內含子邊緣
鹼基發生突變,
剪接酶無法識別時,剪接過程通常就要出錯。但現在,由FranciscoBaralle領導的義大利
國際遺傳工程和生物技術中心的研究人員發現,內含子中間鹼基的突變也能夠改變剪接機制處理內含子的方式。研究小組分析了神經退行性變疾病--共濟失調
毛細血管擴張(ataxia-telangiectasia,A-T)病人的DNA序列。他們發現,致病基因中內含子20內部的4個
鹼基對丟失了。但病人免疫系統細胞中的
信使RNA鏈卻比正常細胞中的長,研究人員證明這是由於RNA鏈中含有多餘的內含子引起的。換句話說,內含子中4個鹼基對的缺失產生令人驚異的效果--缺失的鹼基對轉移到外顯子中去了:即當“剪接機器”啟動開始工作時,內含子已經離開“剪接室”,溜之大吉了。
 外顯子
外顯子試驗項目
為進一步驗證實驗結果,Baralle的研究小組將含有A-T病人中缺失的這個
鹼基對,共由12鹼基對組成的健康
基因序列插入到一個完全不同基因的外顯子中。令人驚異的是,剪接機制開始把整個外顯子當作內含子處理,將該外顯子剪下掉。Baralle得出結論:實驗結果表明,這個序列行使作用時,能夠幫助剪接酶識別內含子;缺失時(如在A-T病人中),就會錯移到外顯子中去。Baralle猜測,這個序列可能也控制著其它基因的剪接,對引起包括癌症在內的各種疾病有一定作用。
這項工作標誌著一次“重大發現”,紐約城
哥倫比亞大學的JimManley評價道。Manley認為
內含子中間的這段關鍵序列也許是幫助剪接機制識別和除去內含子的“踏腳石”。在整個
基因組中,可能存在“幾十個類似機制”來確定內含子的組成
 外顯子
外顯子 外顯子
外顯子 外顯子
外顯子 外顯子
外顯子 外顯子
外顯子
 外顯子
外顯子 外顯子
外顯子 外顯子
外顯子 外顯子
外顯子 外顯子
外顯子