報告全文
2023年,國家藥監局以習近平新時代中國特色社會主義思想和黨的二十大精神為指導,全面落實黨中央國務院重大決策部署,按照“講政治、強監管、保全全、促發展、惠民生”的工作思路,繼續深化醫療器械審評審批制度改革,全面加強醫療器械註冊質量管理,統一規範各級醫療器械審評審批要求,不斷夯實醫療器械監管基礎,持續推動產業創新高質量發展。
一、醫療器械註冊工作情況
(一)醫療器械監管法規制度體系更加完善。2023年9月8日,十四屆全國人大常委會將《醫療器械管理法》列入立法規劃項目,國家藥監局已成立工作領導小組、工作組、專家諮詢組,著手起草相關法律文本。會同國家衛生健康委、國家疾控局聯合印發《醫療器械緊急使用管理規定(試行)》,為醫療器械緊急使用提供法律支撐。起草《醫療機構臨床急需醫療器械臨時進口使用管理要求》。
(二)創新醫療器械質量數量實現雙豐收。2023年,國家藥監局共批准創新醫療器械61個,優先審批醫療器械12個,創新醫療器械批准數量再創新高,比2022年增加6個。在數量增加的同時,創新醫療器械“含金量”不斷提升,在全球率先批准通過破壞交感神經治療肺動脈高壓的一次性使用環形肺動脈射頻消融導管上市,單光子發射及X射線計算機斷層成像系統、腹腔內窺鏡單孔手術系統、顱內取栓支架等產品技術達到國際領先水平,更好地滿足了公眾使用高端醫療器械的需求。
(三)服務國家重大戰略穩步實施。大力支持京津冀、長三角、粵港澳大灣區、海南自貿港、福建等重點區域建設。批准人工耳蝸聲音處理器等3個海南臨床真實世界套用試點產品上市,截至目前,累計批准產品9個,惠及更多患者。指導召開第二屆博鰲國際藥械真實世界研究大會。指導粵港澳大灣區使用20種、29批次港澳已上市的醫療器械,服務區域診療需要。設立醫療器械創新山東、北京、河北、湖北服務站,創新服務站數量已達11個,服務區域產業高質量發展成效初步顯現。推進人工智慧醫療器械、生物材料創新任務揭榜掛帥工作,共遴選出48個人工智慧醫療器械、40個生物材料揭榜項目。籌建高端醫療裝備創新合作平台,加速高端醫療器械創新轉化速度。完善前置申請機制,加大前置審評輔導力度,9個產品通過輔導已申請註冊。
(四)常態化疫情防控保障有力。應急批准廣東、北京、江蘇3家企業的3個國產體外膜肺氧合系統(ECMO)上市,助力疫情防控“保健康、防重症”目標落實。全年批准新冠病毒檢測試劑21個,其中核酸檢測試劑9個,抗原檢測試劑12個。截至目前累計批准新冠病毒檢測試劑157個,充分滿足疫情防控需要。協同國家衛生健康委、國家疾控局聯合推進猴痘檢測試劑產品研發和產品註冊上市。持續做好新冠病毒變異株監測和檢測試劑能力評估,確保產品有效檢出能力。
(五)醫療器械註冊備案管理水平顯著提升。部署各地開展第二類醫療器械註冊清理規範全面整改,召開全國第二類醫療器械註冊管理工作會議,印發強化醫療器械註冊管理工作意見,部署全面加強註冊管理有關工作。對一次性使用微波消融針、重組膠原蛋白創面敷料等,出台相關檔案和指導原則,統一規範註冊工作要求。指導基層做好第一類醫療器械備案工作。持續規範第一類產品備案,切實加強對市級監管部門的監督指導。
(六)醫療器械臨床試驗管理力度繼續加大。開展27個品種的臨床試驗產品真實性核查,31個品種的臨床試驗監督抽查,較2022年數量加倍。發布監督抽查情況通報一期,對存在問題的產品嚴肅處理,作出不予註冊、一年內不予受理的決定。截至2023年底,醫療器械臨床試驗機構備案數量達到1340家,與2022年相比增加13.8%。
(七)醫療器械標準質量不斷提升。修訂發布《醫療器械標準報批發布工作細則》《醫療器械標準驗證工作細則》,制定《醫療器械標準實施評價工作細則》等檔案,標準制修訂管理更加精細。成立全國醫用防護標準化工作組及口腔數位化醫療器械、醫療器械可靠性與維修性等2個標準化技術歸口單位。發布28項醫療器械國家標準、131項行業標準及14項行業標準修改單。截至2022年底,現行有效醫療器械標準共1974項,其中國家標準271項,行業標準1703項,與國際標準一致性程度超過90%,標準體系覆蓋性、系統性不斷提升。我國主導制定的ISO 24072《輸液器進氣器件氣溶膠細菌截留試驗方法》國際標準正式發布,2名中國專家當選國際電工組織(IEC)技術委員會副主席和分技術委員會主席,《人工智慧醫療器械 肺部影像輔助分析軟體 算法性能測試方法》標準獲批國際標準立項。發布《國家藥品監督管理局關於GB 9706.1-2020及配套並列標準、專用標準實施有關工作的通告》及兩期解讀,印發《GB 9706.1-2020標準檢驗要點》,公開發布41個新版GB 9706系列標準的檢驗報告模板,建立專家諮詢機制,有效推動新版GB 9706系列標準的平穩有序實施。
(八)醫療器械分類管理紮實推進。發布《關於進一步加強和完善醫療器械分類管理工作的意見》,強化分類管理頂層設計。完成醫療器械分類技術委員會換屆工作,修訂發布《醫療器械分類技術委員會工作規則》。動態調整分類目錄,發布《關於調整〈醫療器械分類目錄〉部分內容的公告》,涉及58個產品。發布《重組膠原蛋白生物材料命名指導原則》解讀,進一步指導和規範醫療器械領域重組膠原蛋白生物材料的命名。組織成立中醫(民族醫)器械專項工作小組,統籌開展中醫(民族醫)器械分類、命名、標準、審評、檢驗、核查等工作。
(九)醫療器械唯一標識工作有序開展。開展唯一標識第一批、第二批實施工作總結,通報先進經驗做法。發布《關於做好第三批實施醫療器械唯一標識工作的公告》,將臨床需求量較大的一次性使用產品、集中帶量採購中選產品、醫療美容相關產品等103種風險較高的第二類醫療器械納入第三批實施範圍。組建醫療器械唯一標識專家諮詢團隊,為深入推進唯一標識實施工作提供支撐。制定《醫療器械唯一標識的形式和內容》《醫療器械唯一標識的包裝實施和套用》兩項醫療器械行業標準,進一步指導醫療器械唯一標識工作實施。
(十)監管科學研究工作成果顯著。組織推進第二批監管科學6個重點項目13個醫療器械子項目工作,已形成醫療器械監管新工具、新標準、新方法141項。組織藥品監管科學體系建設第一批重點項目醫療器械領域重點項目申請和遴選;啟動新一代基因測序產品評價方法研究、數字療法醫療器械質量評價方法研究等9項重點項目。配合開展監管科學研究基地和重點實驗室考核,促進研究質量提升。
(十一)醫療器械技術審查能力持續提升。技術審評質量管理體系與業務工作高效融合,審評質量監測、運行和改進體系持續完善。醫療器械註冊審評購買服務工作穩步實施。長三角、大灣區審評分中心審評人員數量分別增加176%、109%。全年發布67項指導原則和6項審評要點,現行有效指導原則達到613項,對醫療器械分類目錄覆蓋率達92.2%。持續開展全系統醫療器械註冊管理實務培訓、充分發揮實訓基地作用,線上舉行12期省級醫療器械審評審批人員線上培訓,8300餘人參訓,舉辦首次省級醫療器械審評員線下實地培訓,提升培訓效果。公開已發布的GB 9706相關醫療器械標準解讀視頻,150餘萬人次線上瀏覽學習。
二、醫療器械註冊申請受理情況
2023年,國家藥監局依職責共受理醫療器械首次註冊、延續註冊和變更註冊申請總計13260項,與2022年相比增加25.4%。
(一)整體情況
受理境內第三類醫療器械註冊申請7106項,受理進口醫療器械註冊申請6154項。
按註冊品種區分,醫療器械註冊申請9968項,體外診斷試劑註冊申請3292項。
按註冊形式區分,首次註冊申請3559項,占全部醫療器械註冊申請的27%;延續註冊申請4676項,占全部醫療器械註冊申請的35%;變更註冊申請5025項,占全部醫療器械註冊申請的38%。註冊形式與數量比例情況見圖1。
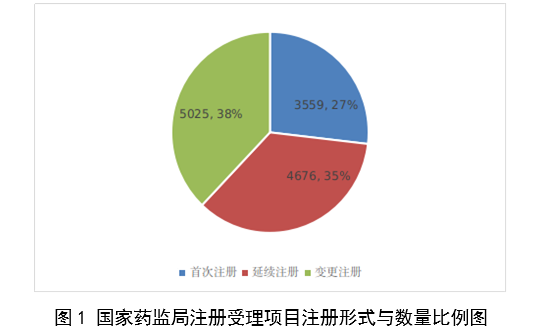
圖1
(二)分項情況
1.境內第三類醫療器械註冊受理情況
境內第三類醫療器械註冊受理共7106項,與2022年相比增加31%。其中,醫療器械註冊申請5432項,體外診斷試劑註冊申請1674項。
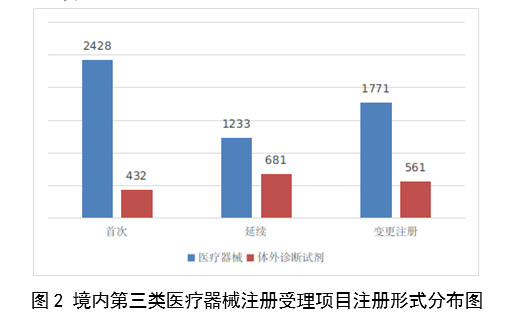
圖2
從註冊形式看,首次註冊2860項,占全部境內第三類醫療器械註冊申請數量的40.2%;延續註冊1914項,占全部境內第三類醫療器械註冊申請數量的26.9%;變更註冊2332項,占全部境內第三類醫療器械註冊申請數量的32.8%。註冊形式分布情況見圖2。
2.進口第二類醫療器械註冊受理情況
進口第二類醫療器械註冊受理共3036項,與2022年相比增加23.1%。其中醫療器械註冊申請1723項,體外診斷試劑註冊申請1313項。
從註冊形式看,首次註冊300項,占全部進口第二類醫療器械註冊申請數量的9.9%;延續註冊1631項,占全部進口第二類醫療器械註冊申請數量的53.7%;變更註冊1105項,占全部進口第二類醫療器械註冊申請數量的36.4%。註冊形式分布情況見圖3。
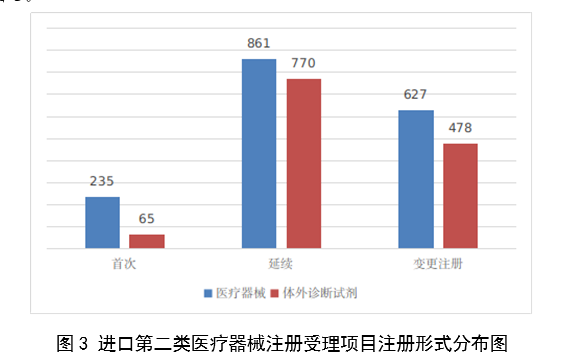
圖3
3.進口第三類醫療器械註冊受理情況
進口第三類醫療器械註冊受理共3118項,與2022年相比增加16.4%。其中醫療器械註冊申請2813項,體外診斷試劑註冊申請305項。
從註冊形式看,首次註冊399項,占全部進口第三類醫療器械註冊申請數量的12.8%;延續註冊1131項,占全部進口第三類醫療器械註冊申請數量的36.3%;變更註冊1588項,占全部進口第三類醫療器械註冊申請數量的50.9%。註冊形式分布情況見圖4。
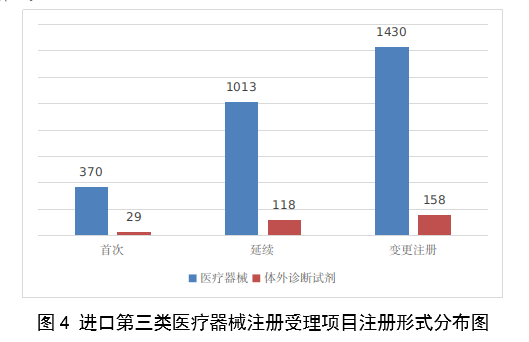
圖4
三、醫療器械註冊審批情況
2023年,國家藥監局共批准醫療器械首次註冊、延續註冊和變更註冊12213項,與2022年相比註冊批准總數量增長2.3%。
其中,首次註冊2728項,與2022年相比增加9.1%。延續註冊4788項,與2022年相比減少8.2%,連續兩年減少。變更註冊4697項,與2022年相比增加11.2%。
2023年,企業自行撤回首次註冊申請、自行註銷註冊證書287項。
近10年國家藥監局批准醫療器械註冊情況見圖5。
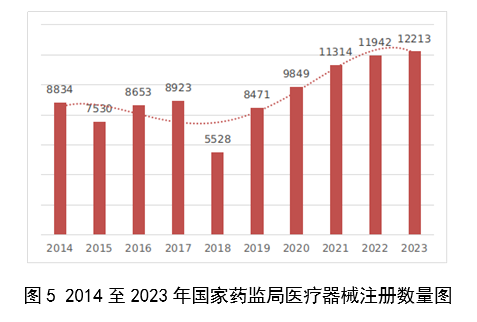
圖5
(一)整體情況
2023年,國家藥監局批准境內第三類醫療器械註冊6151項,與2022年相比增加8.1%,進口醫療器械6062項,與2022年相比減少3%。
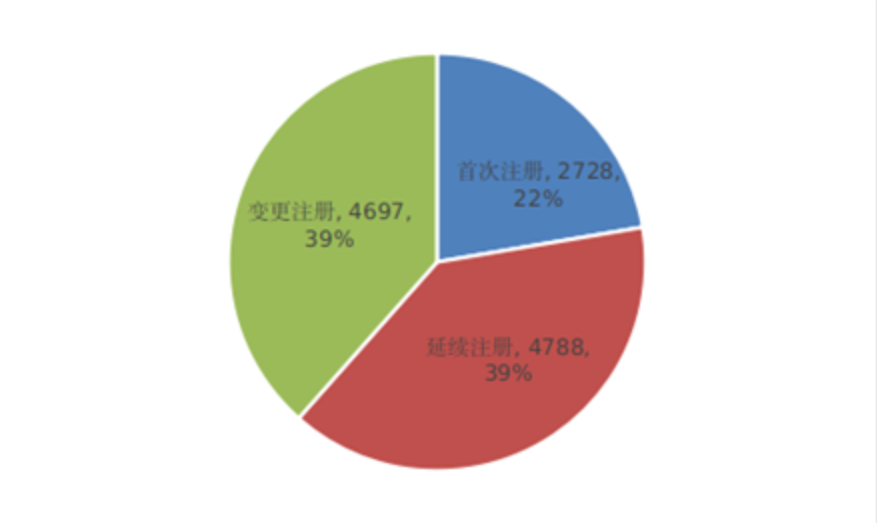
圖6
按照註冊品種區分,醫療器械9130項,占全部醫療器械註冊數量的74.8%;體外診斷試劑3083項,占全部醫療器械註冊數量的25.2%。
按照註冊形式區分,首次註冊2728項,占全部醫療器械註冊數量的22.3%;延續註冊4788項,占全部醫療器械註冊數量的39.2%;變更註冊4697項,占全部醫療器械註冊數量的38.5%。註冊形式比例情況見圖6。
(二)分項情況
1.境內第三類醫療器械註冊審批情況
境內第三類醫療器械註冊6151項。其中,醫療器械4667項,體外診斷試劑1484項。
從註冊形式看,首次註冊2079項,占全部境內第三類醫療器械註冊數量的33.8%,延續註冊1897項,占全部境內第三類醫療器械註冊數量的30.8%;許可事項變更註冊2175項,占全部境內第三類醫療器械註冊數量的35.4%。註冊形式分布情況見圖7。
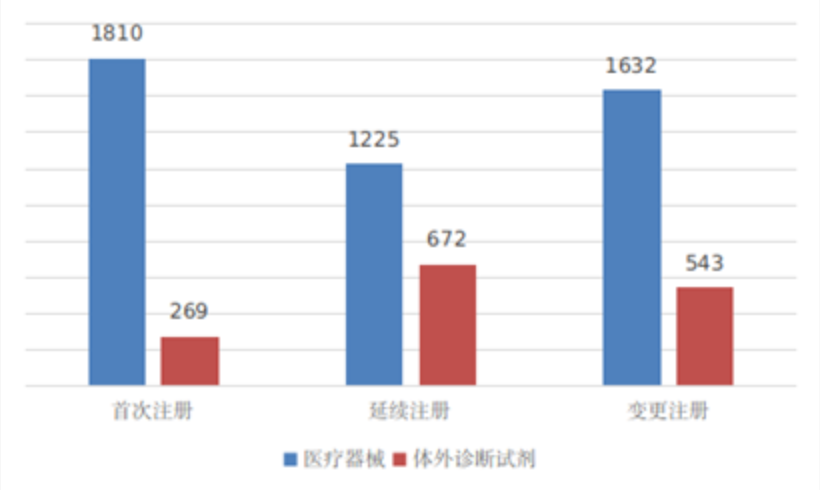
圖7
2.進口第二類醫療器械註冊審批情況
進口第二類醫療器械注2947項。其中,醫療器械註冊1654項,體外診斷試劑註冊1293項。
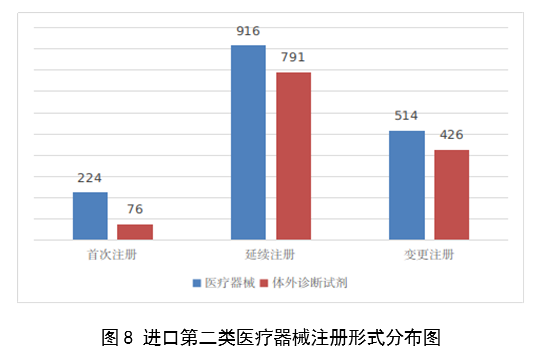
圖8
從註冊形式看,首次註冊300項,占全部進口第二類醫療器械註冊數量的10.2%;延續註冊1707項,占全部進口第二類醫療器械註冊數量的57.9%;許可事項變更註冊940項,占全部進口第二類醫療器械註冊數量的31.8%。註冊形式分布情況見圖8。
3.進口第三類醫療器械註冊審批情況
進口第三類醫療器械註冊3115項。其中,醫療器械註冊2809項,體外診斷試劑註冊306項。
從註冊形式看,首次註冊349項,占全部進口第三類醫療器械註冊數量的11.2%;延續註冊1184項,占全部進口第三類醫療器械註冊數量的38%;許變更註冊1582項,占全部進口第三類醫療器械註冊數量的50.8%。註冊形式分布情況見圖9。
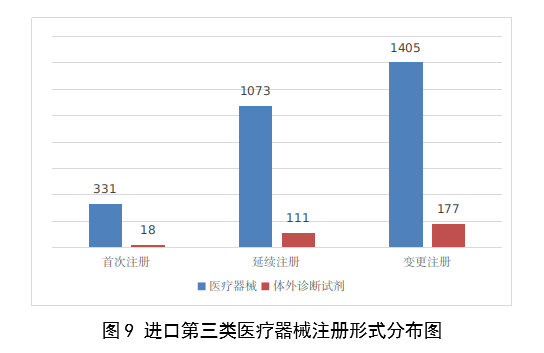
圖9
(三)首次註冊項目月度審批情況
2023年,國家藥監局共批准醫療器械首次註冊2728項,月度批准數量情況見圖10。

圖10
(四)具體批准品種種類分析
註冊的境內第三類醫療器械,除體外診斷試劑外,共涉及《醫療器械分類目錄》中18個子目錄的產品。
註冊數量前五位的境內第三類醫療器械是:無源植入器械,神經和心血管手術器械,注輸、護理和防護器械,有源手術器械,醫用成像器械。與2022年相比,有源手術器械超過醫用成像器械,註冊數量同比增加54%,其他品類註冊數量也有所增加,如注輸、護理和防護器械增加26.2%,神經和心血管手術器械增加11%,無源植入器械增加18.8%。
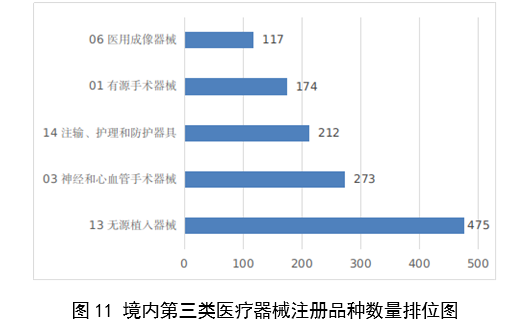
圖11
註冊的進口醫療器械,除體外診斷試劑外,共涉及《醫療器械分類目錄》中22個子目錄的產品。
註冊數量前五位的進口醫療器械,主要是:無源植入器械,口腔科器械,眼科器械,醫用成像器械,有源手術器械,與2022年相比,變化較大,眼科器械取代注輸、護理和防護器械,有源手術器械取代神經和心血管手術器械,無源植入器械數量增加43.3%,口腔科器械數量增加57.8%,醫用成像器械註冊數量減少44.2%。
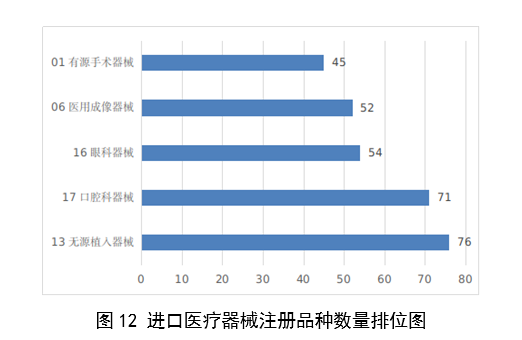
圖12
(五)進口醫療器械國別情況
2022年,共有31個國家(地區)產品在我國獲批上市。
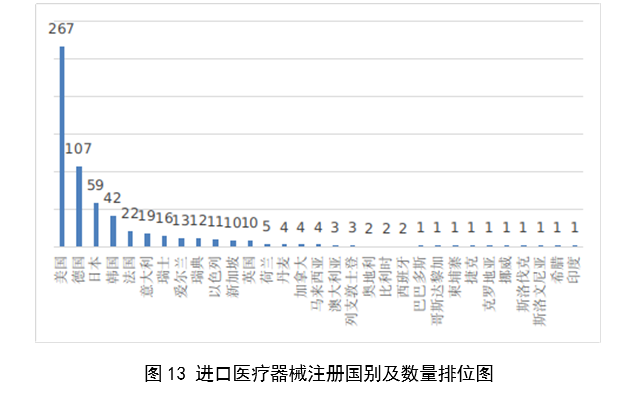
圖13
其中,美國、德國、日本、韓國、法國醫療器械在中國醫療器械進口產品首次註冊數量位列前5位,註冊產品數量約占2023年進口產品首次註冊總數量的77%,與2022年相比略有增加。
從進口醫療器械代理人分布看,共有16個省涉及有本省企業作為進口醫療器械代理人,其中上海市的進口醫療器械代理人代理的進口醫療器械首次數量最多,占全部進口醫療器械首次註冊數量的64%。
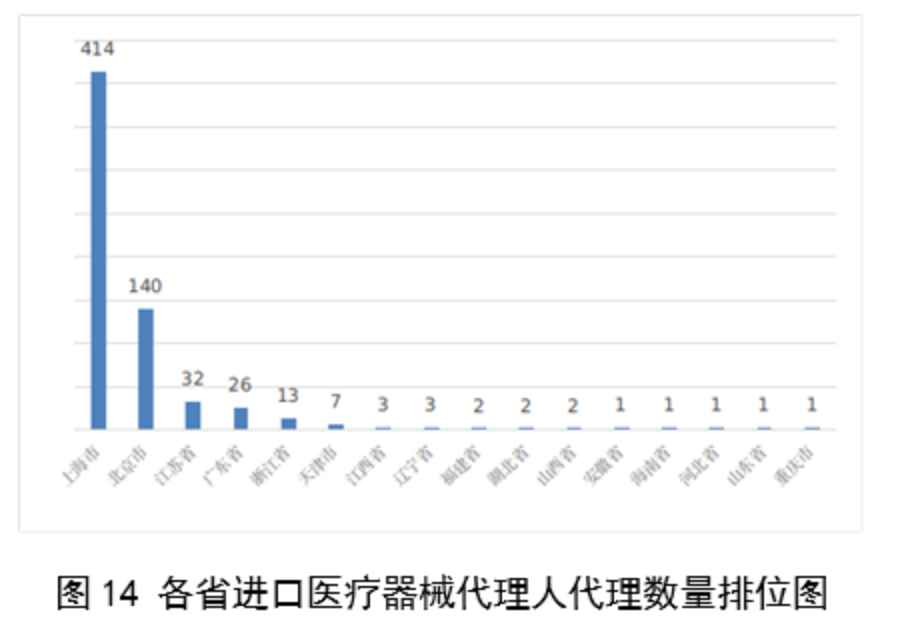
圖14
(六)境內第三類醫療器械首次註冊省份分析
從2023年境內第三類醫療器械首次註冊情況看,相關註冊人主要集中在沿海經濟較發達省份。青海首次有境內第三類醫療器械獲準註冊。
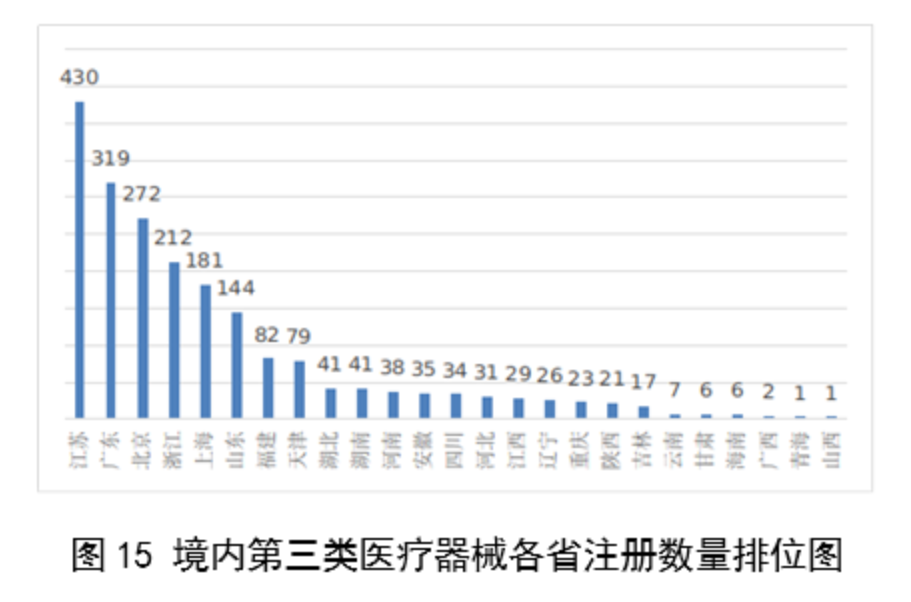
圖15
其中,江蘇、廣東、北京、浙江、上海是境內第三類醫療器械首次註冊數量排前五名的省份,占2023年境內第三類醫療器械首次註冊數量的68%,但與2022年相比略有減少。
四、創新醫療器械等產品註冊審批情況
2023年,國家藥監局按照《創新醫療器械特別審查程式》《醫療器械優先審批程式》繼續做好相關產品的審查工作,共收到創新醫療器械特別審批申請466項,比2022年增加35.9%,其中69項獲準進入創新醫療器械特別審查程式。
從2014年至2023年,國家藥監局共批准250個創新醫療器械。其中,境內創新醫療器械涉及16個省的167家企業,進口創新醫療器械涉及5個國家的18個企業。
北京、上海、廣東、江蘇、浙江創新醫療器械獲批產品數量和相應企業數量最多,約占全部已批准的250個創新醫療器械的78.4%,但與2022年相比有所下降。

圖16
2023年,國家藥監局共批准61個創新醫療器械產品上市,相比2022年增加11%。其中有源醫療器械43個,無源醫療器械16個,體外診斷試劑2個。有源手術器械、無源植入器械、醫用軟體、醫用成像器械、放射治療器械等高端醫療器械是2023年批准的創新醫療器械數量前五位。具體見圖17。
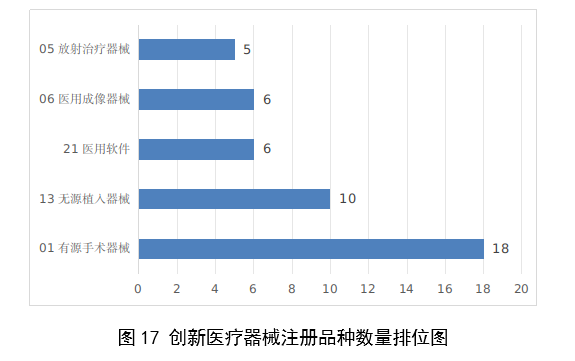
圖17
這些創新產品核心技術都有我國的發明專利權或者發明專利申請已經國務院專利行政部門公開,產品主要工作原理/作用機理為國內首創,具有顯著的臨床套用價值。以下是已批准創新醫療器械產品介紹:
(一)病人監護儀:該產品由主機、外掛程式模組和附屬檔案組成。可對患者進行心電(含ST段測量及心律失常分析)、阻抗呼吸、體溫、脈搏血氧飽和度、脈率、無創血壓、有創血壓、呼吸及呼吸末二氧化碳、麻醉氣體、無創心輸出量(僅適用於成人患者)、有創心輸出量(僅適用於成人患者)監護,同時具有心電圖、PICC、呼吸氧合圖、腎功能計算、血液動力學計算、氧合計算、通氣計算、藥物計算、記錄儀功能。該產品預期在醫療機構由經培訓合格的專業臨床醫生和護士使用,其套用領域包括手術室、ICU和普通科室。
該產品採用了心電信號自適應濾波技術和四電極心電系統技術,可通過實時觀察腔內心電圖P波的變化,反饋導管末端位置,實現置管操作過程中對導管末端的實時定位。與傳統中心靜脈置管術方法相比,該產品具有中心靜脈置管末端定位功能,有助於提高PICC導管到位率。
(二)混合閉環胰島素輸注系統:該產品由胰島素泵套件、傳送器套件和葡萄糖感測器組成,具有兩項主要核心技術:一是自動模式使用的混合閉環算法;二是用於檢查感測器狀態的電化學阻抗譜技術,該技術可確保葡萄糖感測器有充分的準確度。該產品通過人體佩戴的葡萄糖感測器對皮下組織間液的葡萄糖濃度趨勢持續監測,根據接收的動態葡萄糖監測水平,混合閉環胰島素泵可持續向14歲及以上Ⅰ型糖尿病患者體內輸注基礎量胰島素(用戶可選速率)與胰島素大劑量輸注(用戶可選劑量),通過安全防護技術,可根據持續葡萄糖監測情況自動調整基礎率胰島素的輸注,確保全天候的血糖可控,便利糖尿病患者的生活。
(三)血液透析尿素清除率計算軟體:該產品是具有自主智慧財產權的國內首創產品,性能指標達到國際先進水平。臨床用於維持性血液透析成年患者的血液透析尿素清除率計算,不適用於殘腎功能計算。尿素清除率是衡量血液透析充分性的重要指標。目前主要採用有創方式取血法進行計算,存在操作繁瑣、無法連續計算等問題,可能導致患者出現貧血。與取血法相比,該產品可結合患者已有指標和血液透析治療參數計算尿素清除率,依據局部尿素動力學模型計算患者模擬體液量,具有無創、操作簡單、可連續計算等優勢,能夠及時調整透析方案,有效提高患者透析效果。
(四)膠原蛋白軟骨修復支架:該產品在生產中創新性地採用了膠原提取的過程除菌工藝,並去除了具有免疫原性的端肽結構,能夠批量化、穩定地生產出具有完整三螺旋結構的膠原蛋白材料。該產品以膠原蛋白為主要成分,將其作為生物支架為自體骨髓間充質幹細胞(BMSCs)提供細胞粘附、增殖、遷移的空間。膠原蛋白軟骨修復支架植入後,其中的軟骨細胞由BMSCs分化以及周圍健康軟骨組織中遷移並增殖。軟骨細胞不斷合成分泌II型膠原蛋白,形成新的軟骨組織,進而修復缺損軟骨。在此過程中,膠原蛋白支架逐步降解,降解產物可被軟骨細胞作為營養物質吸收,也可經過代謝排出體外。現有的軟骨損傷修復技術常見包括微骨折術、軟骨移植、軟骨細胞移植以及關節置換等。膠原蛋白軟骨修復支架配合膝關節微骨折術使用,產品的上市預期讓更多的患者受益。
(五)磁共振監測半導體雷射治療設備:該產品的磁共振監測核心技術具有國家發明專利,在雷射治療過程中,通過磁共振溫度成像技術,實時接收磁共振設備的梯度回波序列,從而計算治療區域溫度,對治療過程實時監控。該產品與一次性使用雷射光纖套件配合,用於對藥物難治性癲癇患者(有明確的致癇區部位或明確的癲癇傳導途徑)的局部病灶進行雷射治療且治療時間短,對健康腦組織損傷小,術後併發症少,患者恢復快,降低了神經外科顱內病灶的治療難度。
(六)冠狀動脈CT血流儲備分數計算軟體:該產品基於冠脈CT血管造影圖像計算獲得CT血流儲備分數,用於輔助評估穩定性冠心病患者的功能性心肌缺血狀態,可以幫助臨床醫生判斷冠脈狹窄是否引起心肌缺血,確定患者是否需要進一步進行介入檢查和治療。作為傳統影像學檢查的補充,相應軟體的上市,將有助於進一步減少患者診斷時間和支出負擔。
(七)一次性使用雷射光纖套件:該產品的材料、結構和製作工藝等核心技術具有國家發明專利。在長時間工作狀態下,光纖受熱幾乎不發生形變,沿其軸向散射出的雷射強度能夠保持相對一致,不僅可以增加治療範圍,同時也可降低雷射功率密度,有效提高了使用安全性。該產品與磁共振監測半導體雷射治療設備配合使用,實現了神經外科顱內病灶的全微創治療,用於對藥物難治性癲癇患者(有明確的致癇區部位或明確的癲癇傳導途徑)的局部病灶進行雷射治療。治療時間短,對健康腦組織損傷小,術後併發症少,患者恢復快,降低了神經外科顱內病灶的治療難度。
(八)人工晶狀體:該產品為一件式後房人工晶狀體,採用專利波前塑形技術,可較為充分地利用進入眼內的光線,同時預期將改善衍射型人工晶狀體普遍存在的光暈和/或其他視覺干擾的副反應。該產品適用於術前角膜散光<1.00D且經囊外白內障摘除術摘除白內障晶狀體後無晶狀體眼的成人患者,一期植入人工晶狀體進行視力矯正。該產品通過擴展焦深來減輕老視對患者近視力、中視力及遠視力的影響,在保持相當遠視力的前提下,擴展從遠距離至功能性近距離的視力範圍,降低患者對眼鏡的依賴。產品的上市將為患者帶來新的治療選擇。
(九)冠狀動脈功能測量系統:該產品由工作站、感測器支架、IBP導聯線、IBP信號輸入電纜(選配)組成,僅限與該公司的一次性使用有創壓力感測器配合使用。該產品通過對冠狀動脈造影影像進行血管分割、三維重建,獲取血流速度,結合有創壓力感測器測量的主動脈壓進行血流動力學分析,實現對冠狀動脈造影微循環阻力指數(caIMR)的評估,輔助臨床醫生評價患者冠狀動脈微循環功能情況。
(十)金屬增材製造胸腰椎融合匹配式假體系統:該產品包括胸腰椎融合匹配式假體,以及配合組件釘扣、螺釘。該產品創新性採用聚乙烯釘扣作為柔性連線裝置,聯合後路釘棒系統,實現前後路聯合固定的“桁架”結構。對於需進行多節段胸腰椎切除重建的患者人群,該產品採用多孔結構,同時可實現患者匹配設計(基於患者CT數據設計製造)和植入假體固定,可在一定程度提高患者術後生活質量和患者生存率。該產品適用於上胸椎至下腰椎(T1-L5)因腫瘤或其它病變需行連續三個及以上節段椎體切除後的結構重建,需與脊柱內固定系統匹配並實現永久植入。產品的上市將為患者治療提供新的選擇。
(十一)腸息肉電子下消化道內窺鏡圖像輔助檢測軟體:該產品在醫療機構供執業內窺鏡醫師用於成人結腸內窺鏡檢查時,在內窺鏡圖像處理器輸出的獨立視頻圖像中實時顯示疑似息肉的區域。該產品為國內首個利用深度學習技術同時進行結直腸鏡檢查質量控制和息肉輔助檢測的軟體。該產品與現有國內外已上市同類產品相比,在識別息肉的同時,採用深度學習技術、感知哈希算法等技術輔助醫生進行操作控制,進一步確保腸鏡檢查質量,減少漏檢率,並提升檢查操作的規範性。
(十二)血管內成像設備與一次性使用血管內成像導管:兩個產品配合使用,用於經皮冠狀動脈介入手術時對冠狀動脈進行血管內成像。該產品成像導管遠端安裝有聲學探頭與光學探頭,能自動獲取圖像並反饋至圖像處理模組,實現同步配準的血管內超聲和光學干涉斷層成像。該產品優於同類已上市產品,能夠同時實現上述兩種成像,同步滿足醫生對分辨力和穿透力的要求,簡化了醫生操作,提高了成像的準確性和安全性。
(十三)放射治療計畫軟體:該產品適用於制定光子束和電子線的外照射放療計畫。其核心技術主要包括自動布野技術和自動計畫最佳化技術,前者根據患者體位、靶區位置和投影形狀等信息,自動設計機架射束角度和準直器角度;後者通過預設的方案自動調整相關最佳化目標,使得最終計畫的各項要求達到處方要求。與現有放射治療計畫軟體相比,可減少人工操作步驟,降低用戶工作強度,減輕對用戶操作經驗的依賴。
(十四)冠狀動脈介入手術控制系統及其一次性使用附屬檔案:冠狀動脈介入手術控制系統和一次性使用冠狀動脈介入手術控制系統附屬檔案配套使用,輔助臨床醫生在經皮冠狀動脈介入手術期間,輸送和操作導絲、導引導管或者快速交換球囊擴張導管/支架。與傳統冠狀動脈介入手術方式相比,醫生在禁止環境下通過該產品的操作控制台,驅動機械臂及其末端安裝的配套附屬檔案,實現對介入器械的操控,減少了醫生在手術中的射線暴露,並且該產品可實現量化的血管尺寸測量,輔助醫生判斷病變長度。
(十五)結腸息肉電子內窺鏡圖像輔助檢測軟體:該產品用於成人結腸息肉檢查,可在電子內窺鏡設備輸出視頻圖像中顯示疑似息肉區域。其原理是在電子內窺鏡圖像處理器輸出的視頻流中導入視頻圖像信號,經過軟體深度學習算法分析後將疑似息肉位置進行標記,並在視頻客戶端顯示,電子內窺鏡原始圖像顯示不受影響。醫生結合患者病情,根據電子內窺鏡標記圖像,研判是否存在息肉。
(十六)碳離子治療系統:該產品為我國第二款具有自主智慧財產權的國產碳離子治療系統,性能指標達到國際水平。該產品的獲批,標誌著我國高端醫療器械國產化又邁出重要一步,對於提升我國醫學腫瘤診療手段和水平,具有重大意義。該產品包含4個治療室,與此前已批准國產碳離子產品相比,增加45度和90度2個治療室,縮小調製掃描治療頭束斑尺寸,提升束流強度,縮短束流關斷時間,配置圖像引導系統,升級患者支撐裝置,提升了治療的效率和安全性。該產品獲批上市後,將進一步提升治療水平,降低治療成本,滿足惡性實體腫瘤患者治療需要。使用者應當嚴格按照產品批准的適用範圍使用產品,同時應當嚴格遵守衛生健康部門的診療規範。
(十七)植入式左心室輔助系統:該產品由植入部件、體外部件、手術附屬檔案組成,與特定人工血管配套使用,為進展期難治性左心衰患者血液循環提供機械支持,用於心臟移植前或恢復心臟功能的過渡治療。該產品為第三代非接觸式磁懸浮離心泵,核心技術主要為盤式電機技術,其利用位置感測器檢測並控制轉子的轉速和懸浮高度。該產品電機僅採用一組定子線圈同時控制轉子的旋轉和懸浮,結構更簡單、重量更輕、體積更小、功耗更低,在臨床套用中,手術切口較小,患者恢復較快,適用人群更廣,並可降低血泵熱量導致的血栓風險。
(十八)多模態腫瘤治療系統:該產品是集液氮冷凍與射頻加熱於一體的多模態治療系統,通過對目標病灶預冷凍,後續進行射頻加熱並對過程精確控制,從而實現加熱區域與冷凍區域重合的多模態腫瘤消融,達到病灶精準治療效果。該產品通過對消融針設計最佳化,有效克服氣阻問題,實現高效相變換熱。在消融針治療段通過禁止射頻干擾,實現治療過程中腫瘤組織精準測量與實時反饋。在消融針非治療段採用高真空工藝技術,構建超薄真空絕熱層,實現射頻電磁場禁止,在完全消融腫瘤的同時,最大程度避免周圍組織的損傷。一體化控制系統通過對預冷凍和射頻加熱過程的精準控制,還可實現消融區域的可視化。
(十九)植入式骶神經刺激系統:該產品由“植入式骶神經刺激器”、“植入式骶神經刺激延伸導線”、“植入式骶神經刺激電極”三個產品配套使用,構成植入式骶神經刺激系統,其核心技術具有自主智慧財產權。該系統通過六觸點骶神經刺激輸出,可產生多路刺激脈衝信號,利用遠場程控通信技術可實現非近距離接觸下刺激器參數調控。而且,該系統結合六觸點電極可提供更多刺激組合,調控範圍更加精細,並增加了下尿路功能障礙治療方法,進一步滿足患者臨床需要。
(二十)穿刺手術導航定位系統:該產品將導航配準、機械臂定位、呼吸追蹤集成為胸腹部穿刺導航定位系統,為國內首創。與常規CT引導方式相比,該產品可以提高成人肺及腹部實體器官穿刺手術的一次到位率,減少進針次數和CT掃描次數,具有顯著臨床套用價值。
(二十一)鋯鈮合金股骨頭:鋯鈮合金股骨頭與該企業同系列髖關節假體組件配合使用,適用於全髖關節假體置換。該產品採用符合國際標準(ASTM F2384)的鋯鈮合金,經表面梯度氧化形成類陶瓷層,可以減少高交聯聚乙烯髖臼內襯磨損,降低髖關節假體翻修率。與目前臨床常用類似預期用途的鈷鉻合金股骨頭產品相比,該產品可減少金屬離子析出、降低關節面磨損;與陶瓷股骨頭產品相比,可降低假體碎裂、關節異響等風險。該產品上市將為臨床治療提供更多選擇。
(二十二)腹腔內窺鏡單孔手術系統:該產品由醫生控制台、患者手術平台、三維電子腹腔內窺鏡、手術器械及附屬檔案組成,用於泌尿外科腹腔鏡手術操作,為國內首個內窺鏡單孔手術系統,有效填補了國內空白。該產品中的手術器械採用國際首創、擁有自主智慧財產權的創新技術,具有運動範圍廣、負載能力強和可靠性高等技術優勢。該產品以單孔方式實施手術,減少患者腹部開孔數量。內窺鏡及手術器械有多個主動自由度,僅通過手術器械在患者腹腔內的運動即可完成手術操作。體外定位臂在遙操作過程中保持靜止,避免了術中相互碰撞的風險。醫生利用該產品特有操控系統進行控制,可提高操作精細化水平,減少手術創傷。
(二十三)頭頸部X射線立體定向放射外科治療系統:該產品由3MV醫用直線加速器、傾斜軸和垂直軸機架、X射線高壓發生器、X射線管組件、X射線探測器、治療床、空壓機、主電源、副電源、水冷系統、懸吊式控制台、操作者控制台、治療計畫軟體組成,用於顱內和頸部實體惡性腫瘤和病變的放射治療。該產品的自禁止結構設計將輻射水平限制在可接受的安全閾值範圍內,不需建設防護牆,降低了醫院機房建設成本,加快了產品安裝周期。鎢輪準直器和最佳化的直線加速器進一步提高了劑量準確性,實現輻射束半影最小化,確保更多輻射劑量到達腫瘤區域,減少對腫瘤周圍正常組織的輻射,具有一定臨床優勢。
(二十四)膝關節置換手術導航定位系統:該產品由主機、主控台車、導航定位工具包組成,在成人全膝關節置換手術過程中,套用六自由度機械臂輔助醫生完成膝關節假體安裝等工作,為國內首創。該產品與傳統人工全膝關節置換術相比,可以保證手術定位精度,減輕不良事件和併發症的發生機率,降低X射線對醫生和患者的輻射損傷。
(二十五)人工晶狀體:該產品為一件式後房人工晶狀體,其前表面中心採用具有專利技術的波前塑形結構。該產品適用於存在角膜散光且經囊外白內障摘除術摘除白內障晶狀體後的成人患者,一期植入該產品通過擴展焦點深度進行視力矯正,即在保持相當遠視力的前提下,擴展從遠距離至功能性近距離的視力範圍,降低患者對眼鏡的依賴。該產品上市將為臨床治療提供更多選擇。
(二十六)靜脈支架系統:靜脈支架系統由自膨式鎳鈦合金支架和輸送系統組成。自膨支架由鎳鈦絲編織而成,具有柔順性、抗折性和耐疲勞性。該產品帶有獨特的釋放自補償結構,保證在手術過程中靜脈支架釋放形態穩定精準;還具有可回收功能,可在靜脈支架沒有被完全推出輸送系統的情況下,將90%支架長度重新回收至輸送系統內,並重新定位釋放一次,解決釋放中的異常問題,提高產品安全性。該產品預期在髂股靜脈內使用,用於治療非血栓性髂靜脈壓迫綜合徵和深靜脈血栓形成后綜合征。該產品上市將為臨床治療提供更多選擇。
(二十七)衝擊波治療儀:產品由主機(含衝擊波源、水處理裝置、定位架、台車)、治療頭(含水囊)、腳踏開關(選配)組成。該產品在醫療機構中使用,用於對輕中度血管性勃起功能障礙的輔助治療。
(二十八)醫用電子直線加速器:該產品由機架、束流產生模組、射野成形模組、治療床、圖像引導系統、控制系統組成,屬國內首創,用於對人體適合接受放射治療的實體腫瘤和病變提供圖像引導下的三維適形放射治療、適形調強放射治療、容積調強放射治療以及體部立體定向放射治療。該產品套用帶導電滑環的環形機架,對於臨床上較複雜的需要多次連續治療的患者,可縮短治療時間,提高治療效率。
(二十九)硬性鞏膜接觸鏡:該產品為日戴型硬性鞏膜接觸鏡,是一種大直徑的硬性接觸鏡(俗稱“鞏膜鏡”),鏡片材料為氟矽丙烯酸酯(hexafocon A),著冰藍色。該產品由光學區(OZ)、中周區(PCCZ)、角膜緣區(LCZ)和鞏膜著陸區(SLZ)四個弧段組成,在臨床驗配時可通過對各弧段進行參數調整獲得更理想的鏡下液厚度,改善患者視覺質量的同時還可保護角膜組織。該產品創新性採用雙矢深非對稱設計,能夠更好地匹配不對稱鞏膜;鞏膜著陸區為反轉弧面設計,患者佩戴體驗更舒適。該產品適用於矯正不規則散光,或同時合併有+25.00D至-25.00D,角膜規則散光小於5.00D的屈光不正患者。該產品上市將為臨床治療提供更多選擇。
(三十)髖關節置換手術導航定位系統:該產品由機械臂台車、主控操作台車、光學追蹤台車、腳踏開關、醫用電動骨鑽和手術工具組成,與經驗證的髖關節假體和手術工具聯合使用,可以在髖關節置換手術中輔助醫生完成髖臼打磨、股骨截骨、髖關節假體安裝等工作。該產品具有自主智慧財產權,各項性能指標達到國際同品種器械水平。與傳統人工髖關節置換術相比,該產品可以提升手術定位精度,減輕不良事件和併發症的發生機率,降低X射線對醫生和患者的輻射損傷。
(三十一)磁共振成像系統:該產品由磁體、檢查床、譜儀、梯度功率放大器、射頻功率放大器、氙射頻功率放大器、配電系統、生理信號門控單元等組成,擁有自主智慧財產權。該產品在常規磁共振成像系統基礎上增加氙核成像功能,可使氣體無侵入、無輻射地在肺部分布,為我國首款可用於肺部氣體成像的磁共振成像系統。
(三十二)顱內取栓支架:該產品由頭端、絲網、推送軸、控制絲和手柄組成,與國內外已上市同類產品相比,其可控膨脹技術為國際首創。在手術過程中,醫生能實時控制該產品的膨脹程度和施加在血管與血栓上的徑向力大小,使其安全輸送至病變部位,釋放過程更加精準,增加取栓成功率;回撤時,醫生也可對該產品進行適度收縮,降低徑向力從而減少對敏感脆弱血管壁的擾動和損傷。該產品預期可提高急性缺血性腦卒中患者的術後血管再通率,提高患者生活質量。
(三十三)冷凍消融設備和球囊型冷凍消融導管:兩個產品配套使用,用於藥物難治性、復發性、症狀性的陣發性房顫治療,屬國內首創。其採用目標溫度控制技術和多路測溫技術,在治療過程中可控制球囊內部溫度,並實現球囊表面溫度監測,確保手術更加安全。該產品的上市可進一步滿足我國在陣發性房顫治療領域的臨床需求。
(三十四)注射用重組Ⅲ型人源化膠原蛋白溶液:該產品為無色或類白色液體,由重組Ⅲ型人源化膠原蛋白和0.9%的生理鹽水組成,適用於面部真皮組織填充以糾正額部動力性皺紋(包括眉間紋、額頭紋和魚尾紋)。該產品採用的重組膠原蛋白生物材料可組裝成膠原蛋白纖維網,對細胞、組織起支撐作用,使皺紋塌陷的部位得到物理填充。產品免疫原性風險可控,注射後會逐漸被體內膠原蛋白酶分解吸收。
(三十五)二尖瓣夾系統:該產品由二尖瓣夾、輸送系統和跨瓣器組成。其中,輸送系統由輸送器、推送器、裝載器、導管鞘和擴張器組成。使用該產品,在手術中無需心臟停跳和體外循環,創口小,手術入路短,定位直接;且單純超聲引導介入,使得醫生和患者不會受到X射線影響。其二尖瓣夾捕獲範圍較大,有利於操作;採用了閉合環設計,夾臂之間不易分開,保證夾合穩固。該產品採用經心尖手術方式,適用於經專業心臟團隊評估後認為存在外科手術高風險,且二尖瓣瓣膜解剖結構適合的退行性二尖瓣反流(MR≥3+)患者。這些患者的基礎疾病不應影響降低二尖瓣反流後帶來的臨床受益。該產品的上市將為臨床治療提供更多選擇。
(三十六)非小細胞肺癌組織TMB檢測試劑盒(可逆末端終止測序法):該產品用於體外定性檢測EGFR基因突變陰性和ALK陰性的非鱗狀非小細胞肺癌患者經福馬林固定的石蠟包埋(FFPE)組織樣本中的腫瘤突變負荷(TMB)。腫瘤突變負荷(TMB)是一個免疫檢查點抑制劑治療療效預測標誌物。該產品由我國自主研發並擁有智慧財產權,通過高通量測序技術檢測425個基因,計算腫瘤突變負荷。臨床研究數據顯示,腫瘤突變負荷高的人群使用抗腫瘤藥物卡瑞利珠單抗聯合化療比腫瘤突變負荷低的人群可顯著延長無進展生存期。
(三十七)X射線計算機體層攝影設備:該產品由掃描架、高壓發生器、X射線球管以及X射線管組件、限束器、光子計數探測器、電源分配單元、患者支架、雷射器、控制台、圖像處理軟體、控制主機、重建工作站組成,用於常規CT檢查,支持冠狀動脈CT血管造影和能譜檢查。該產品採用光子計數探測器創新技術,能夠計算入射的X射線光子數量並測量光子的能級。與使用傳統能量積分探測器的CT相比,該產品的空間解析度更高,能夠直接獲取能譜圖像,可以進一步滿足臨床影像診斷需求。
(三十八)關節置換手術模擬軟體:該產品由掃描安裝程式和授權檔案組成。軟體包括6個功能模組:用戶管理模組、三維重建顯像模組、基於深度學習的骨骼分割模組、骨骼髓腔中心線提取模組、基於深度學習的識別和測量模組、假體模板匹配模組。該產品採用國內首創的深度學習技術,對符合格式的CT圖像進行三維重建、分割,自動識別解剖位點,輔助醫生進行成人髖關節、全膝關節置換手術模擬。該產品上市預期可提高人工關節安放的精準性,減少術後併發症。
(三十九)質子治療系統:該產品由加速器子系統和治療子系統組成。加速器子系統包括主加速器系統、能量選擇系統和射束傳輸系統,治療子系統含3個治療室,包括360度旋轉束治療系統和治療計畫系統。該產品提供質子束進行放射治療,適用於治療全身實體惡性腫瘤及三叉神經痛等良性疾病,具體適應症由臨床醫師根據實際情況確定。該產品是首台獲批的採用超導回旋加速器技術和360度旋轉機架的質子治療系統。上述技術確保了產品結構緊湊,並可以實現多角度治療。同時,該產品在保證患者治療效果的前提下,能夠有效縮短患者治療時間。
(四十)單光子發射及X射線計算機斷層成像系統:該產品由單光子發射計算機斷層掃描系統(SPECT)主機(含兩個SPECT探測器)、CT主機架、檢查床、PDU伺服器、採集客戶端工作站、SPECT採集伺服器工作站、CT採集重建工作站、影像處理工作站、患者定位監視器、SPECT準直器等組成。該產品臨床用於腫瘤、心血管系統、泌尿系統、神經系統疾病的影像學檢查及評估,其SPECT部分還可單獨成像。作為國產首台可變角、雙探頭、通用型SPECT/CT一體機,該產品不僅填補了國內空白,而且各項性能指標達到國際先進水平,其臨床套用可進一步提升我國腫瘤、缺血性心臟病、腎臟疾病的診斷能力,有助於節省臨床資源、降低醫療成本。
(四十一)增材製造聚醚醚酮顱骨缺損修復假體:該產品基於患者顱骨缺損的影像學數據,創新性採用聚醚醚酮醫用粉料,經選擇性雷射燒結增材製造加工而成,能夠匹配患者缺損部位,通過三維嵌入方式實現顱骨缺損替代,恢復患者原顱骨曲率實現缺損區三維重建。該產品適用於顱骨缺損修復重建的外科治療。其利用增材製造技術可列印更多複雜的顱頜骨形態,同時顱骨缺損修復假體的列印紋理對頭皮無機械切削作用,無假體穿出風險。此外,該產品還解決了聚醚醚酮粉末在選擇性雷射燒結成形中的回收問題,在同等臨床效果基礎上,提高材料利用率,降低生產成本。產品上市將為患者治療提供新選擇。
(四十二)增材製造匹配式人工膝關節假體:該產品包含股骨髁假體、脛骨托假體、半月板假體。股骨髁假體和脛骨托假體由鈷鉻鉬粉材經雷射增材製造而成,半月板假體由超高分子量聚乙烯材料製成。該產品採用全膝關節假體的個性化設計,其關節曲面仿生設計能夠重建正常股髕關節運動功能。該產品與骨水泥配合使用,適用於膝關節假體置換,骨關節炎患者和特殊患者均可使用。產品能夠在各截骨面上實現良好覆蓋,有效解決了不匹配和過覆蓋問題。產品的上市將為患者治療提供新的選擇。
(四十三)腹腔內窺鏡單孔手術系統:該產品由醫生控制台、患者手術平台、圖像處理機、三維電子腹腔內窺鏡、手術器械和附屬檔案組成。基於單孔手術方式的腹腔內窺鏡手術系統,設計了多自由度具有肩肘-腕柔性鉸鏈關節的手術器械,實現操作靈活精準性和較大負載能力,在以單孔方式實施腹腔鏡手術時,由於內窺鏡及手術器械具有多個主動自由度,僅依靠手術器械在患者腹腔內的運動即可完成手術操作,而體外定位臂在遙操作過程中保持靜止,避免了術中相互碰撞風險,可提高手術操作精細化水平,減少患者腹部開孔數量、減少手術創傷。
(四十四)一次性使用心腔內超聲診斷導管:該產品由導管主體、操作手柄和連線器組成,配合該公司生產的攜帶型彩色超聲診斷儀,適用於醫療機構開展心臟及心臟大血管、心內解剖結構的超聲成像。該產品通過高頻超音波對心臟部位進行二維成像和三維建模,能夠準確、快速、高效地實現超聲手術。該產品可提供實時精確的解剖圖像,同時監測血流動力學變化,對於心臟組織特徵及細微結構的顯示較好,能夠實時監測,及時發現與手術相關的併發症,最大限度保障手術安全。該產品的上市有利於降低臨床治療費用,使更多患者受益。
(四十五)明膠-聚己內酯分層牙齦修復膜:該產品為白色膜狀,纖維層結構,是由明膠和聚己內酯經靜電紡絲技術製成的三層複合膜,上下兩層為明膠,中間層為聚己內酯,不區分正反面。其中,明膠纖維層與創面接觸,協助角化齦增寬;聚己內酯纖維層為複合膜增加機械強度,方便操作及取出,不與人體組織直接接觸。該產品適用於口腔角化齦增寬,加深前庭溝,可根據適用部位預期修復面積大小選擇合適型號。產品的上市將為患者治療提供新的選擇。
(四十六)經導管二尖瓣夾系統:該產品由導引鞘、二尖瓣夾系統兩個部件組成。其中,二尖瓣夾系統包含二尖瓣夾和輸送系統,其二尖瓣夾的彈性中心封堵網結構,可以增加夾合密封性,降低中心殘餘反流,降低瓣葉夾合力;同時,二尖瓣夾還具有單獨捕獲瓣葉、重複定位抓捕等功能設計,可以提高操作精度,減少二尖瓣夾脫落及瓣葉穿孔的風險。該產品適用於經心臟團隊評估後,認為存在外科手術高風險,且二尖瓣瓣膜解剖結構適合的退行性二尖瓣反流(MR≥3+)患者。該產品的上市將為臨床治療提供更多的選擇。
(四十七)冷凍消融設備和球囊型冷凍消融導管:“冷凍消融設備”由冷凍裝置、真空系統、低溫工質輸送迴路和控制系統組成。“球囊型冷凍消融導管”由設備連線部件、操作控制部件和血液接觸部件組成。上述兩個產品在醫療機構配套使用,用於藥物難治性、復發性、症狀性、陣發性房顫的治療。治療過程中,“冷凍消融設備”可將氮氣經熱交換器冷卻後輸送至球囊內腔,使與組織接觸的球囊產生低溫,並通過導管反饋的溫度,動態調控冷凍介質的壓力和流量,將球囊表面溫度維持在規定範圍內。同時,該設備真空泵持續抽取導管外層管路內的空氣,使產品外層管路達到高真空的隔熱狀態,確保非消融區域的安全,提高了手術安全性。
(四十八)骨盆骨折復位手術導航定位系統:該產品由主控台車、機械臂台車、導航定位工具組成,用於成人骨盆骨折手術中骨折復位,以及手術過程中手術工具、骨針及螺釘植入物的導航定位。該產品基於術前CT與術中CBCT影像配準、鏡像與曲面連續性約束、力—位置雙重反饋控制等技術,實現術中骨塊及工具三維實時導航、骨盆骨折閉合復位手術規劃建議、機器人復位操作控制等功能。該產品是國內首個採用機器人技術實現骨盆骨折閉合復位的手術導航定位系統,與傳統手術相比,可提高閉合復位的成功率,降低開放手術風險,縮短恢復時間和住院時間,同時減少患者、醫護輻射暴露劑量。
(四十九)可降解鎂金屬閉合夾:該產品由可降解鎂金屬閉合夾和基座組成。鎂金屬閉合夾包括上臂、下臂和尾部O型結構三部分,放置於基座內。其中,可降解鎂金屬閉合夾由高純鎂材料製成,可避免現有鎂合金產品中常用的鋁、稀土等元素對人體健康的潛在風險,且植入後不影響術後X光、CT、核磁等影像學診斷;通過塑性變形和熱處理技術調控,增強高純鎂金屬的力學性能,提高了閉合夾的穩定性和可靠性。該產品適用於外科手術不需要提供永久閉合力的血管或膽管等管狀組織的結紮和閉合,不適用於大動脈和大靜脈。該產品的上市將為臨床治療提供更多的選擇。
(五十)人乳腺癌分子分型檢測試劑盒(PCR-螢光探針法):該產品由檢測體系混合液、酶混合液、陽性對照、陰性對照組成,用於體外半定量檢測浸潤性乳腺癌FFPE組織切片樣本中基因ERBB2(HER2)、ESR1(ER)、PGR(PR)以及MKI67(Ki-67)的mRNA表達水平。該產品通過逆轉錄實時定量PCR(RT-qPCR),利用Taqman技術對四個目標基因(ERBB2、ESR1、PGR以及MKI67)及兩個參考基因的mRNA表達水平進行定量檢測。對傳統免疫組化分析不易判定的情況,以及傳統免疫組化分析結果與治療預期有較大差別的病例樣本可提供進一步檢測,輔助判斷乳腺癌分子分型,提高分型準確性,從而協助醫生制定更合理的診療方案。
(五十一)一次性使用環形肺動脈射頻消融導管:該產品由射頻段、連線段、可彎段、主鞘管、色標、控制手柄和連線器組成,是由中國在全球率先批准的通過破壞交感神經治療肺動脈高壓的產品,為肺動脈高壓患者提供了新的治療方式選擇,將使更多肺動脈高壓患者受益。該產品採用穿刺介入方式通過血路進入人體,配合該公司生產的肺動脈射頻消融儀使用,輸送射頻能量作用於肺動脈相應靶點,從而破壞交感神經,實現治療肺動脈高壓的效果。該產品適用於藥物治療無效、小於70周歲的特發性肺動脈高壓、先天性心臟病相關肺動脈高壓和結締組織病相關肺動脈高壓的成人患者的輔助治療。
(五十二)一次性使用心臟脈衝電場消融導管和心臟脈衝電場消融儀:一次性使用心臟脈衝電場消融導管由導管和連線電纜組成,心臟脈衝電場消融儀由主機、輸出盒和附屬檔案組成,這是國內首個心臟脈衝電場消融類產品。上述兩個產品配套使用,通過控制、釋放適當強度的脈衝電場能量,有選擇性地對需要治療的病灶部位的心肌細胞產生不可逆的電穿孔損傷,從而達到治療房顫的目的,為藥物難治性、復發性、症狀性、陣發性房顫的治療提供了更多選擇。
(五十三)自膨式可載粒子膽道支架:該產品由內、外支架組成,各帶有一個一次性使用置入器,外支架帶有粒子囊(不含粒子)。該產品將放射性粒子與支架技術結合運用於膽道惡性梗阻治療,採用內、外雙支架結構設計,降低置入器的外管直徑,實現微創介入治療,在擴張支架的同時為三維立體空腔臟器內放射治療提供載體。該產品適用於因惡性腫瘤導致的無法手術或者不願手術切除的膽道狹窄/梗阻的擴張及治療。自膨式可載粒子膽道支架植入後,能起到擴張膽道狹窄的作用,支架上攜帶的放射粒子對腫瘤組織進行近距離放射治療,抑制腫瘤生長,預期延長膽管有效通暢時間,提高患者生存時間和生活質量。產品的上市將為患者治療提供新的選擇。
五、其他註冊管理情況
(一)境內第二類醫療器械註冊審批情況
2023年,各省級藥品監管部門共批准境內第二類醫療器械註冊33584項,與2022年相比增加2.1%。其中,首次註冊13952項,與2022年相比增加4.6%。首次註冊項目占全部境內第二類醫療器械註冊數量的41.5%。延續註冊9437項,與2022年相比減少11.3%,占全部境內第二類醫療器械註冊數量的28.1%;變更註冊10195項,與2022年相比增加14.3%,占全部境內第二類醫療器械註冊數量的30.4%。境內第二類醫療器械註冊形式及數量情況見圖18。
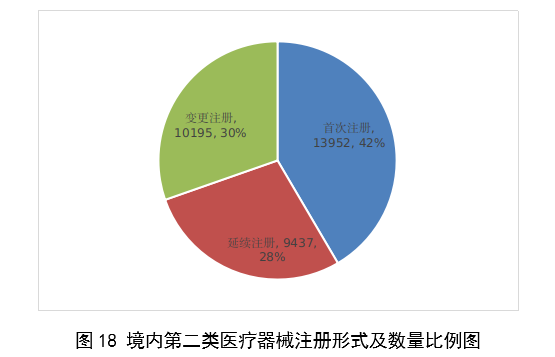
圖18
從註冊情況看,廣東、江蘇、北京、湖南、河南、浙江、山東、重慶、上海、湖北10省(直轄市)辦理境內第二類醫療器械註冊事項較多。
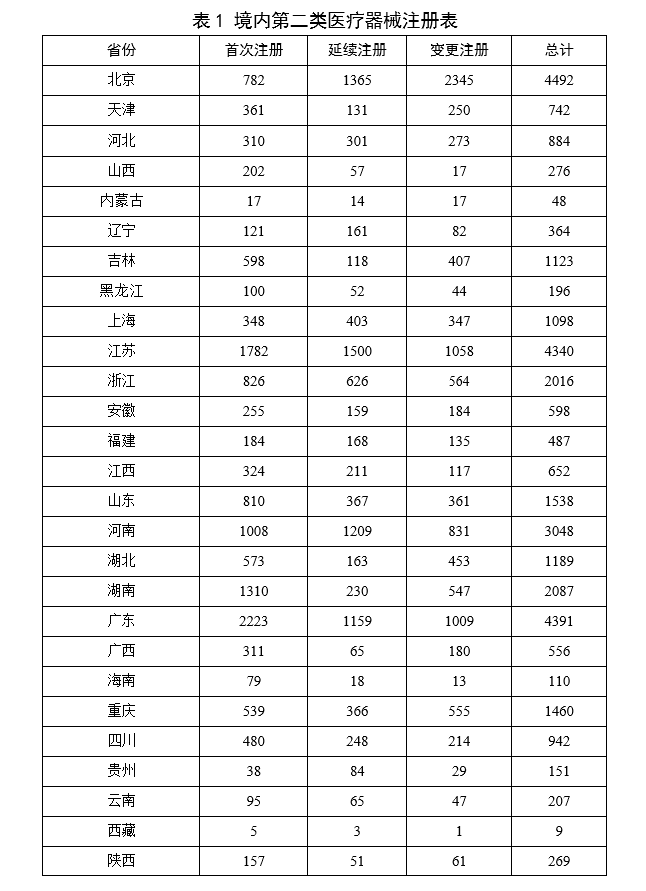
表1
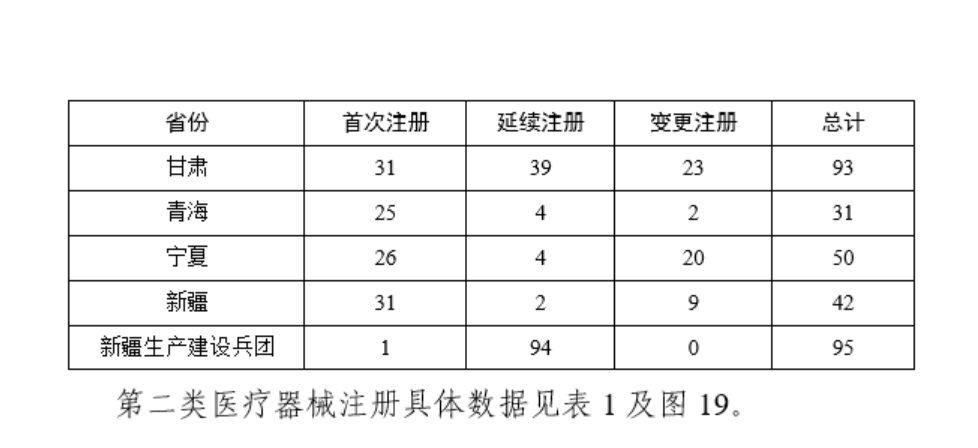
圖19
從首次註冊情況看,廣東、江蘇、湖南、河南、浙江、山東、北京、吉林、湖北、重慶10省(區、市)首次註冊的境內第二類醫療器械數量較多。各省第二類醫療器械首次註冊數量排位見圖20。
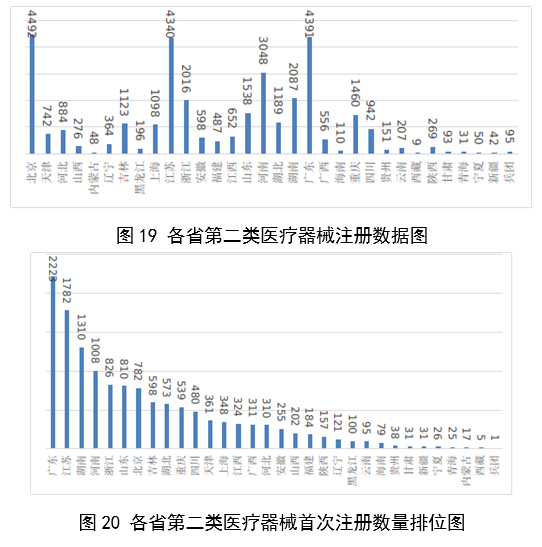
圖19、20
(二)第一類醫療器械備案情況
2023年,國家藥監局依職責共辦理進口第一類醫療器械備案數量2453項,與2022年相比增加21.2%。
全國設區的市級藥品監管部門依職責共辦理境內第一類醫療器械備案數量25681項,與2022年相比減少9.9%。此外,2023年各省取消第一類醫療器械備案9876項。其中江蘇、山東、廣東、浙江、湖北是第一類備案數量前五的省份。各省第一類醫療器械備案數量排位見圖21。
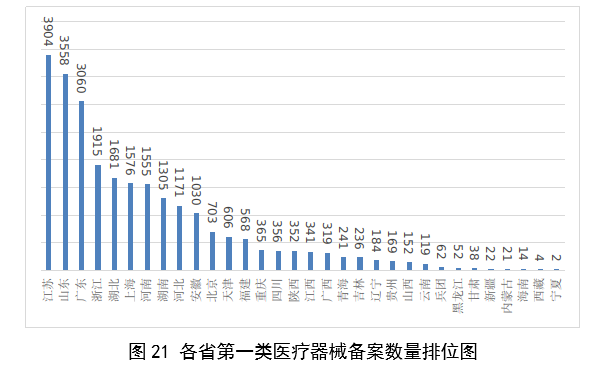
圖21
(三)變更備案情況
2023年,國家藥監局依職責共辦理進口第二、三類和境內第三類醫療器械變更備案6352項,與2022年相比增加17.8%。
其中,境內第三類醫療器械變更備案4443項,進口第二類、三類醫療器械變更備案1909項。
各省級藥品監管部門依職責共辦理境內第二類醫療器械變更備案15583項,與2022年相比增加33.9%。
(四)醫療器械臨床試驗機構備案情況
自2018年1月1日《醫療器械臨床試驗機構條件和備案管理辦法》頒布實施以來,全國總計1340個機構完成了醫療器械臨床試驗機構備案工作,比2022年增加13.8%。
其中廣東、山東、江蘇、河南、浙江臨床試驗機構備案數量居全國前五名。全國醫療器械臨床試驗機構分布情況見圖22。
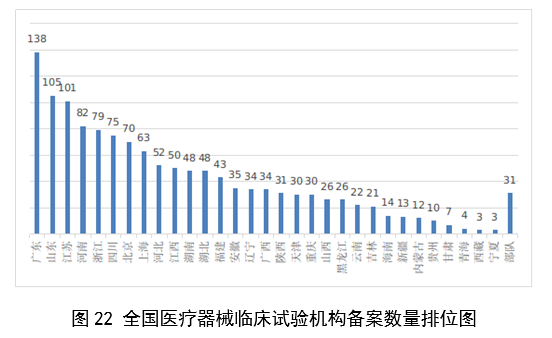
圖22
註:本報告的數據統計自2023年1月1日至2023年12月31日。
內容解讀
《2023年度醫療器械註冊工作報告》顯示,2023年,該局共批准上市創新醫療器械61個,數量再創新高,比2022年增加6個。另據了解,從2014年至2023年,國家藥監局共批准250個創新醫療器械上市。
報告介紹,2023年,國家藥監局共收到創新醫療器械特別審批申請466項,比2022年增加35.9%,其中69項獲準進入創新醫療器械特別審查程式。最終,共批准61個創新醫療器械產品上市。其中,有源醫療器械43個,無源醫療器械16個,體外診斷試劑2個。
報告指出,在數量增加的同時,創新醫療器械“含金量”不斷提升。例如,在全球率先批准通過破壞交感神經治療肺動脈高壓的一次性使用環形肺動脈射頻消融導管上市,單光子發射及X射線計算機斷層成像系統、腹腔內窺鏡單孔手術系統、顱內取栓支架等產品技術達到國際領先水平,更好地滿足了公眾使用高端醫療器械的需求。















































