病原結構
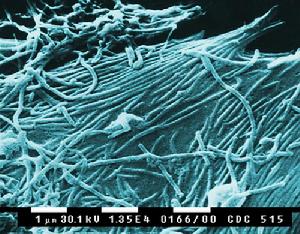
馬爾堡病毒結構為典型的
絲狀病毒,形似絲線,直徑通常一樣,但長度介於80nm至14,000nm(註:納米),通常感染力最強時長度約為790 nm。病毒物質由七種已知蛋白質組成。馬爾堡病毒結構與伊波拉幾乎一樣,但兩者的抗原反應不一。換言之,兩者在引致感染者體內產生的抗體不同。
馬爾堡病毒是第一種被發現的線狀病毒,病毒基因組為單股負鏈
RNA,長約19kb,編碼7種病毒蛋白,包括N蛋白 (nucleoprotein,NP)、病毒蛋白35 (VP35)、病毒蛋白30 (VP30)、病毒蛋白24 (VP24)、
糖蛋白4 (gp4)、RNA依賴的RNA聚合酶主要成分糖蛋白7 (gp7) 和次要成分病毒蛋白40 (VP40)。
傳播歷史
馬爾堡病毒與
伊波拉病毒屬於同“絲狀病毒科”家族,它的發現早於伊波拉病毒。
在1967年秋,西德馬爾堡、法蘭克福和南斯拉夫貝爾格勒的幾所醫學實驗室的工作人員中同時暴發了一種嚴重出血熱,有31人發病,其中7人死亡,病症亦因此而以該地命名,之後在法蘭克福及貝爾格勒亦有病例。31人中,25人是直接感染,當中七人死亡。直接染病的人多是因為接觸當地實驗室內染有馬爾堡病的猴子而致病。另外六人是二次感染,當中包括兩名醫生,一名護士,一名解剖助理,及一名獸醫的妻子。他們都是與直接感染的病人,有緊密接觸。兩名醫生是在抽血時不慎接觸病者血液染病。這次爆發的來源經調查後,發現是來自非洲烏干達一種品種為 Cercopithecus aethiops 的猴子。西德的一家公司入口該批染有病毒的
猴子,原本是用來研製小兒麻痹症的疫苗。
 馬爾堡病毒
馬爾堡病毒1975年,一名從
辛巴威回到
南非的人,感染了另外三名南非人。但該次小規模爆發只引致了一人死亡。
1980年及1987年在肯亞亦有發現馬爾堡出血病,但亦沒有大規模爆發。之後最大的爆發發生在1998年至2000年的
剛果民主共和國。149宗個案中123人死亡。
2004年10月起,馬爾堡病毒在非洲
安哥拉爆發,至2005年7月才平息,超過300人病發身亡。據美國疾病預防及控制中心數字,2005年內,病症個案以每天3%速度增加。這次爆發的發病死亡率維持高達10%,首五個月更高達20%。
 馬爾堡病毒
馬爾堡病毒2014年10月5日,由烏干達政府衛生部宣布:該國發生新一輪馬爾堡出血熱疫情。烏干達首都坎帕拉一名醫務人員被發現死於馬爾堡病毒,這名死者在9月18日前後出現頭痛等症狀,身體狀況不斷惡化,9月28日不幸離世。他的血液樣本經過檢驗後,確證感染馬爾堡病毒。烏當局已將與這名死者有過接觸的80人隔離。烏衛生部強調,這次發現的馬爾堡出血熱和正在西非暴發的伊波拉出血熱疫情無關。
2014年10月7日,根據烏衛生部10月7日發布的訊息稱,與馬爾堡病毒感染死亡者親密接觸的人中,有8人出現症狀,另外,烏衛生部在密切接觸死者名單中,增加了17人,截止6日為止,處於醫學觀察的人數達到97人。
易感人群
馬爾堡病毒最容易感染兒童,在非洲,有75%的病例發生在5歲以下兒童,成人感染者大多為與受感染兒童接觸密切的親屬和醫護人員。
生物特性
病毒對熱有中度抵抗力,56℃ 30分鐘不能完全滅活,但60℃ 1小時感染性喪失。在室溫及4℃存放35 天其感染性基本不變,-70℃可以長期保存。一定劑量的
紫外線、γ射線、脂溶劑、β-丙內酯、
次氯酸、酚類等均可滅活。本病毒可在多種細胞中培養,其中包括Vero細胞、Vero E6細胞和Hela細胞等。只發現一種血清型。
 馬爾堡病毒
馬爾堡病毒傳播途徑
感染病毒的非人靈長類動物和病人是主要傳染源。通常先由被感染的非人靈長類動物(如
綠猴) 將病毒傳染給人,然後再由病人傳染給其他健康人。馬爾堡病毒的傳染性極強,症狀越重的患者傳染性越強,潛伏期患者的傳染性弱。人不是病毒自然循環中的一部分,只是偶然被感染。本病毒在自然界中的儲存宿主尚不清楚。
 馬爾堡病毒
馬爾堡病毒主要經密切接觸傳播,即接觸病死動物和病人的屍體,以及感染動物和病人的血液、分泌物、排泄物、嘔吐物、飛沫等,經黏膜和破損的皮膚傳播。在非洲疫區,因葬禮時接觸病人屍體,曾多次發生本病暴發。通過密切接觸也可以造成
醫院感染和實驗室感染。此外,通過使用被污染的注射器等可造成醫源性傳播。有報導,病人在臨床康復3月內,仍可在
精液中檢出馬爾堡病毒,因此,存在
性傳播的可能性。通過含本病毒的氣溶膠感染實驗動物也有報導。
發病機制
馬爾堡病毒進入人體後,首先侵犯樹突狀細胞和巨噬細胞,爾後被帶至區域淋巴結,在
淋巴系統內播散,並通過血行感染肝、
脾和其他組織。本病的發病機制主要包含以下兩方面:
1.
病毒感染宿主細胞導致細胞的直接損傷:其機制是:病毒和細胞表面的凝集素結合,通過病毒蛋白的毒性作用導致細胞壞死。
2. 病毒和機體免疫系統相互作用導致細胞的間接損傷:其機制是:1 病毒由入侵部位擴散至各系統,從而抑制機體
固有免疫應答,包括樹突狀細胞和
巨噬細胞對1型干擾素的應答;2 由於病毒感染,樹突狀細胞對T細胞的活化受到部分抑制,從而影響
體液免疫反應; 3 在整個感染過程中產生大量
淋巴細胞凋亡,導致
免疫抑制; 4 受感染的巨噬細胞產生各種介質,並通過各種途徑導致嚴重病變,如細胞表面表達組織因子引發播散性血管內凝血;細胞因子和趨化因子的釋放導致血管功能失調、低血壓和多臟器功能衰竭等。
臨床表現
馬爾堡病毒感染後,可引起臨床表現以發熱、出血症狀為主要表現的疾病,被稱為
馬爾堡出血熱。由於馬爾堡病毒來自於非洲綠猴並主要在非洲流行,因此馬爾堡出血熱又被稱為青猴病和非洲出血熱。馬爾堡出血熱初期的病徵與其他傳染病如瘧疾、傷寒相似,因此有時斷症因難,特別是零星出現時。
 馬爾堡病毒疫苗
馬爾堡病毒疫苗馬爾堡出血熱的潛伏期一般為3~9天,病人突然發熱、畏寒、頭痛、全身疲乏、大量出汗、
肌肉酸痛、
咽痛、咳嗽、胸痛。最初的症狀很像流感,隨後病人會出現噁心、嘔吐、腹瀉、腹痛、全身
皮疹,最後出現
口鼻出血、尿血、陰道出血和消化道出血,嚴重者可發生
休克,有大約1/4的患者死亡。
發病特徵是突然出現的發燒,頭痛,肌肉痛。一星期內,皮膚出現
紅疹,然後有嘔吐、胸及腹痛,及腹瀉。之後病者可能出現
黃膽,神志不清,肝衰竭,嚴重出血。患者復原過程十分漫長,並且經常出現陰囊收縮、復發肝炎、脊隨炎、眼睛、耳下腺感染等等後遺症。不同地區的醫療設備及支援對生還率影響很大,部分已開發國家出現時死亡率只有25%,但在開發中國家死亡率卻可以高達100%。
一般相信病毒是透過與染病的人畜緊密接觸,通過體液傳播。日常接觸相信不會傳染。病患者危急時,體內的病毒傳染力最強。部分非洲地區的殮葬風俗應該是導致疾病傳播的原因之一。
不少研究機構正嘗試研製對抗馬爾堡藥物及疫苗。2004年美國的研究人員已發現豚鼠注入不活躍的病毒後不會被感染。
病理改變
除橫紋肌、肺和骨骼之外,幾乎所有器官都可受損。其中肝、腎、淋巴組織的損害最為嚴重,腦、心、
脾次之。肝、脾腫大,呈黑色。肝易破碎,切開時有多量血液流出,呈淺黃色。脾明顯充血,濾泡消失,髓質軟,呈粥糊樣,在紅色脾髓中可見大量巨噬細胞。紅髓壞死並伴
淋巴組織破壞,脾小體內淋巴細胞明顯減少。肝細胞變性和壞死,常見透明變性。
庫普弗細胞 (
枯否細胞) 腫脹凸出,充滿細胞殘渣和紅細胞,竇狀隙充滿細胞碎屑。門靜脈間隙內單核細胞蓄積,但在
肝壞死達到高峰時,可見肝細胞再生現象。淋巴組織的單核細胞變形。除了局限的出血和小動脈內膜炎外,肺內損害較少。神經系統的病變主要散布在腦神經膠質的各種成分,包括星狀細胞、小
神經膠質細胞和少突膠質神經細胞等。
神經膠質的損害有兩種,一是增生性,表現為膠質結節和玫瑰花狀形成。二是變性,表現為核固縮和核破裂。腦實質中可見多處出血。此外,還普遍存在腦水腫。
治療措施
一般支持治療
應臥床休息,就地隔離治療。給高熱量、適量維生素流食或半流食。
液體療法
補充足夠的液體和電解質,補液應以等滲液和鹽液為主,常用的有平衡鹽液和葡萄糖鹽水等。以保持水、電解質和酸鹼平衡。
恢復期病人血清治療
如給早期病人注射恢復期患者的血清,可能有效。
對症和併發症治療
有明顯出血者應輸新鮮血,以提供大量正常功能的血小板和凝血因子;血小板數明顯減少者,應輸血小板;對合併有彌散性血管內凝血者,可用肝素等抗凝藥物治療。心功能不全者套用強心藥物;腎性少尿者,可按
急性腎功能衰竭處理:限制入液量,套用利尿劑,保持電解質和酸鹼平衡,必要時採取
透析療法;肝功能受損者可給予
保肝治療。重症病人可酌情套用抗生素預防感染。
抗體治療
PNAS:抗體治療讓靈長類動物抵抗伊波拉和馬爾堡病毒
來自美國陸軍傳染病醫學研究所的軍事科學家們首次證實基於抗體的療法能夠成功地保護猴子免受致命性伊波拉病毒和馬爾堡病毒感染。此外,甚至是感染後兩天進行抗體治療,這些猴子也得到全面的保護。迄今為止,這一成就不是任何抵抗這些病毒的實驗性治療方法所能比擬的。相關研究結果於2012年3月12日發表在PNAS期刊上。
屬於線狀病毒的伊波拉病毒和馬爾堡病毒導致人患上出血熱(hemorrhagic fever),病死率高達90%。它們是一種全球性健康問題,且被認為是潛在性的生物威脅因子。當前,還沒有獲得批准上市進行銷售的疫苗或療法用於人類治療,這就使得開發這些產品成為當務之急。
來自美國陸軍傳染病醫學研究所在受控實驗室條件下,讓一些猴子接觸致死劑量的絲狀病毒,然後從存活下來的猴子體內提取抗體。這些存活下來的猴子產生高水平的抗體來抵抗這些傳染病。研究人員從它們身上收集血清,進行抗體純化,並對純化的抗體進行病毒中和活性測試,然後開展進一步實驗。
在第一項研究中,感染馬爾堡病毒的猴子在感染15到30分鐘後用抗體進行治療,然後在感染後第4天和第8天再進行治療。這些猴子完全得到保護,沒有表現出任何疾病症狀,而且在它們的血液里也不存在可檢測到的病毒水平。再者,所有猴子對馬爾堡病毒產生免疫應答,而且當這種病毒再次侵襲時都能夠存活下來。
在接下來一系列實驗中,猴子感染上伊波拉病毒或者馬爾堡病毒,在感染2天后對它們進行抗體治療,然後在感染後第4天和第8天再進行治療。抗體延遲治療同樣保護這兩組猴子(一組感染伊波拉病毒,一組感染馬爾堡病毒)免受侵襲。在每組中,三隻猴子中有兩隻在治療後沒有表現出臨床疾病症狀,而第三隻猴子在完全康復後產生輕微的症狀。
在過去將近十年里,絲狀病毒研究科學界因為大量嘗試利用抗體保護猴子免受絲狀病毒侵襲的實驗都遭遇失敗,因而不重視基於抗體的療法。用於人類的抗絲狀病毒療法提供新的方法。
 馬爾堡病毒
馬爾堡病毒 馬爾堡病毒
馬爾堡病毒 馬爾堡病毒
馬爾堡病毒 馬爾堡病毒
馬爾堡病毒 馬爾堡病毒疫苗
馬爾堡病毒疫苗
