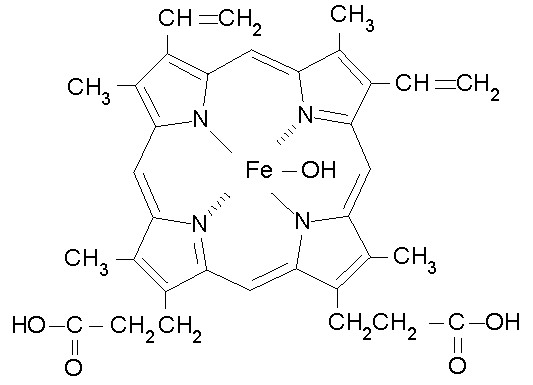
結構組成
人體內的每一個血紅蛋白由4個血紅素(又稱亞鐵原卟啉)和中間的1個珠蛋白組成,每個血紅素又由四個吡咯類亞基組成一個環,環中心為一個亞鐵離子。每個珠蛋白則有四條多肽鏈,每條多肽鏈與一個血紅素連線,構成血紅蛋白的一個單體,或者說亞單位(即亞基)。在與人體環境相似的
電解質溶液中血紅蛋白的四個亞基可以自動組裝成α2β2的形態。
組成珠蛋白的四條肽鏈各不相同,成年人可由2條α鏈和2條β鏈構成,稱HbA。胎兒由2條α鏈2條γ鏈構成,稱HbF。出生後不久由HbA取代。即血紅蛋白由一個珠蛋白和四個血紅素組成,而珠蛋白的一條肽鏈與一個血紅素結合成為血紅蛋白的一個亞單位,四個亞單位之間及亞單位內部以鹽鍵相互結合。每個血紅素基團中間的亞鐵則可以與氧結合使之成為氧合血紅蛋白。與氧結合或解離將影響鹽鍵的形成或斷裂,使Hb的四級結構發生改變,其與氧的親和力亦隨之改變,是氧解離曲線成S形和波爾效應的基礎。
 化學式
化學式物性數據
1.性狀:是高等動物血液和肌肉中的紅色色素。從乙酸或從氯仿-吡啶-冰乙酸中結晶呈長的薄體狀晶,在透射光中呈棕色,反射光中呈鋼藍色。
2..溶解性:易溶於稀氨水
提取測定
1.試劑0.5%~1%檸檬酸三鈉;生理鹽水;95%乙醇;氯仿;0.15%亞硫酸氫鈉;丙酮;0.1 mol/L NaOH;1 mol/L鹽酸,血紅素標準品。
2.器材離心機;真空濃縮裝置;真空乾燥機;分光光度計;新鮮豬血。
1.血紅素製備與純化
(1)新鮮豬血抗凝新鮮豬血,加入0.5%~1%檸檬酸三鈉溶液(V/V=10:1),攪拌均勻,得新鮮抗凝豬血。 (2)分離紅細胞取抗凝豬血10 mL於離心管中,以3 000 r/min離心15 min,傾出上清液(血漿),收集紅細胞,用0.9%NaCl洗滌2次。洗滌方法為:用適量生理鹽水懸浮紅細胞,攪拌均勻,離心,收集紅細胞沉澱,測定紅細胞體積(mL)。
(3)溶血加入相當於紅細胞體積1倍的去離子水、0.25倍95%乙醇,攪拌30 min,紅細胞吸水脹裂,血紅蛋白釋放出來。
(4)分離血紅蛋 白溶血後加人紅細胞體積0.15倍的氯仿,攪拌15 min,離心,得到含血紅蛋白的沉澱物。
(5)分離血紅素 上述沉澱物中加入相等於紅細胞體積的0.15%亞硫酸氫鈉溶液,使其溶解,然後加入紅細胞體積4倍的丙酮,攪拌均勻,用0.1 mol/L鹽酸溶液調節pH為3,使珠蛋白與血紅素充分分離(抽提時間為10 min以上),然後4000 r/min離心10 min,棄沉澱,上清液即為血紅素丙酮溶液。
(6)血紅素純化 血紅素丙酮溶液採用真空濃縮並回收丙酮,濃縮物用0.1 mol/L NaOH溶解,3 000 r/min離心10 min,收集上清液。用0.1 mol/L鹽酸調pH至4~5,沉澱血紅素,收集沉澱,用水洗沉澱至中性,50℃真空乾燥至恆重,得血紅素。測定血紅素製品的重量(mg)。
2.血紅素測定
以0.1 mol/L NaOH分別溶解血紅素標準品和提取得到的血紅素製品,調整至適宜濃度,於385 nm處測定吸光度,計算樣品中血紅素提取率及純度。
合成分解
生物合成
紅細胞中最主要成分是血紅蛋白,約占其濕重的32%、乾重的97%。血紅蛋白是由珠蛋白與血紅素結合而成。血紅素不僅是Hb的輔基,也是肌紅蛋白、細胞色素、過氧化物酶等的輔基二血紅素可在體內多種細胞內合成,參與血紅蛋白組成的血紅素主要在骨髓的幼紅細胞和網織紅細胞中合成。珠蛋白的生物合成與一般蛋白質相同,故下面介紹血紅素的合成。體內合成血紅素的基本原料是甘氨酸、琥珀醯輔酶A和Fe2+。
血紅素的合成過程
(1)δ-氨基-γ-酮戊酸(ALA)的生成:線上粒體內,甘氨酸和琥珀醯CoA在ALA合成酶催化下,縮合生成ALA。此反應需要磷酸呲哆醛作為輔酶,ALA合成酶是血紅素合成的限速酶。
 圖1:血紅素的生物合成
圖1:血紅素的生物合成(2)卟膽原的生成:ALA生成後擴散到胞漿,兩分子ALA在ALA脫水酶作用下,脫水縮合生成一分子卟膽原(PBG)。
(3)尿卟啉原Ⅲ及糞卟啉原Ⅲ的生成:在胞漿四分子卟膽原在卟膽原脫氨酶和尿卟啉原Ⅲ同合酶協同催化下,脫氨縮合成尿卟啉原Ⅲ,再經尿卟啉原脫羧酶作用生成糞卟啉原Ⅲ。
(4)血紅素的生成:糞卟啉原Ⅲ經擴散重新進入線粒體。在糞卟啉原氧化脫羧酶催化下,生成原卟啉原Ⅸ,再經氧化酶作用,生成原卟啉Ⅸ。後者和Fe卜在血紅素合成酶催化下,生成血紅素。血紅素由線粒體轉入胞漿與珠蛋白結合成血紅蛋白。(圖1)
代謝分解
含血紅素蛋白的代謝在哺乳動物中需要:
①對卟啉環剪下產生的疏水性產物進行處理;
②所含鐵的保留和動用,使其重新被利用。紅細胞的生存周期大約為120天,衰老細胞通過膜的改變被識別,並被血管外的網狀內皮系統吞噬。珠蛋白鏈變性後,將血紅素釋放於細胞質中;珠蛋白被降解為其組成的胺基酸,重新被利用以滿足一般代謝的需要。
如圖2描述了血紅素代謝的過程。血紅素主要通過網狀內皮細胞中的內質網內的酶降解,這一過程需要氧分子和NADPH參與。血紅素加氧酶(heme oxygenase)有兩個異構體,I型是底物誘導型,Ⅱ型是組成型。該酶催化一個亞甲基橋的剪下,這個亞甲基橋連線包含乙烯基取代基的兩個吡咯基團。
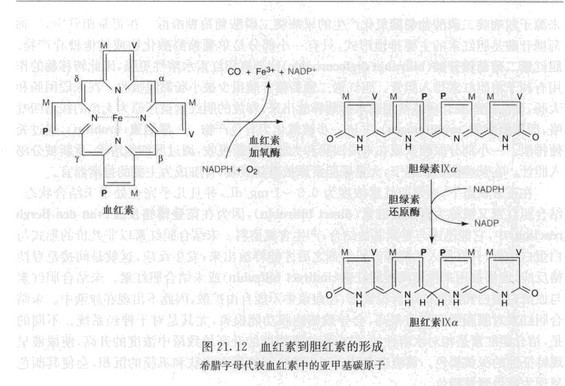 圖2:血紅素到膽紅素的形成
圖2:血紅素到膽紅素的形成一個亞甲基碳轉變為一氧化碳,這是人體內一氧化碳(carbon monoxide)唯一的內生性來源。一部分一氧化碳通過呼吸道釋放,因此,通過測定呼出的一氧化碳可作為衡量個體血紅素降解情況的指標。一氧化碳中的氧和新生衍生性內醯胺環中的氧均完全來源於氧分子。通過化學計量,每剪下一個環,反應需要3mol氧。血紅素加氧酶只能以血紅素作為底物,鐵可能參與了剪下反應。因此,自由原卟啉Ⅸ不是其底物。線性四吡咯膽綠素Ⅸ(biliverdinⅨ)通過血紅素加氧酶形成。膽綠素Ⅸ被膽綠素還原酶(biliverdin reductase)還原為膽紅素Ⅸ。
作用功能
與氧結合
血紅素與
氧結合的過程是一個非常神奇的過程。首先一個
氧分子與血紅素四個亞基中的一個結合,與氧結合之後的
珠蛋白結構發生變化,造成整個血紅素結構的變化,這種變化使得第二個氧分子相比於第一個氧分子更容易尋找血紅素的另一個亞基結合,而它的結合會進一步促進第三個氧分子的結合,以此類推直到構成血紅素的四個亞基分別與四個氧分子結合。而在組織內釋放氧的過程也是這樣,一個氧分子的離去會刺激另一個的離去,直到完全釋放所有的氧分子,這種有趣的現象稱為
協同效應。
血紅素分子結構由於協同效應,血紅素與
氧氣的結合曲線呈S形,在特定範圍內隨著環境中
氧含量的變化,血紅素與氧分子的結合率有一個劇烈變化的過程,生物體內組織中的氧濃度和肺組織中的氧濃度恰好位於這一突變的兩側,因而在肺組織,血紅素可以充分地與氧結合,在體內其他部分則可以充分地釋放所攜帶的氧分子。可是當環境中的氧氣含量很高或者很低的時候,血紅素的氧結合曲線非常平緩,氧氣濃度巨大的波動也很難使血紅素與氧氣的結合率發生顯著變化,因此健康人即使呼吸純氧,血液運載氧的能力也不會有顯著的提高,從這個角度講,對健康人而言吸氧的所產生心理暗示要遠遠大於其生理作用。當血液內
紅細胞破壞過多,肝臟負荷增加
肝細胞內運送、結合和
排泄障礙,或肝外膽道阻塞,都可引起血內
膽紅素濃度增高而出現
黃疸。
其他功能
除了運載氧,血紅素還可以與二氧化碳、一氧化碳、
氰離子結合,結合的方式也與氧完全一樣,所不同的只是結合的牢固程度,一氧化碳、氰離子一旦和血紅素結合就很難離開,這就是
煤氣中毒和
氰化物中毒的原理,遇到這種情況可以使用其他與這些物質結合能力更強的物質來解毒,比如一氧化碳中毒可以用
靜脈注射亞甲基藍的方法來救治。
用作藥物和保健品,有載氧、貯氧、促進氧化還原、進行電子傳遞等重要生物學功能。可用作半合成血卟啉(HP)及其衍生物(HPD)、原卟啉鈉原料。也可用作肉類食品添加劑,主要作著色劑使用。
 化學式
化學式 圖1:血紅素的生物合成
圖1:血紅素的生物合成 圖2:血紅素到膽紅素的形成
圖2:血紅素到膽紅素的形成