基本簡介
疾病名稱:膜增殖性腎小球腎炎疾病別名:系膜毛細血管性腎小球腎炎,系膜毛細血管增生性腎炎,膜增生性腎炎,小葉性腎炎,分葉性腎炎,低補體血症性腎炎,持續性低補體腎炎,膜增生性腎小球腎炎,mesangiocapillaryglomerulonephritis,MCGN,membranousproliferativeglomerulonephritis
 膜增殖性腎小球腎炎
膜增殖性腎小球腎炎疾病分類:腎臟內科
膜增生性腎小球腎炎(membrano-proliferativeglomerulonephritis,MPGN),是腎小球腎炎中最少見的類型之一,一般分為原發性和繼發性。此病曾有多種名字,包括系膜毛細血管性腎小球腎炎(MCGN)、系膜毛細血管增生性腎炎、小葉性腎炎、低補體血症性腎炎等。本病是一種具有特定病理形態及免疫學表現的綜合徵。臨床主要表現為腎炎、腎病或腎炎腎病同時存在和低補體血症;組織學上可見系膜增生,毛細血管壁增厚,腎小球呈分葉狀,故又稱分葉性腎炎。其病理改變的主要特點是系膜細胞增生、毛細血管壁增厚及基底膜雙軌。根據電鏡下電子緻密物沉積的部位可將MPGN分為3型:Ⅰ型為內皮下緻密物沉積;Ⅱ型為特徵性基膜內緻密物沉積;Ⅲ型是上皮下和內皮下緻密物同時出現;大多認為Ⅱ型是一種獨特的腎小球疾病,Ⅲ型可能是Ⅰ型膜增生性腎炎的一種變異。本病臨床主要特徵是大多患者有持續性低補體血症,因而病程較長、難以治癒且預後差。
臨床表現
本組疾病在原發性腎小球病中較少見,也是腎病綜合徵中為數不多的增殖性腎炎之一。各種病理類型的臨床表現基本相似,無論本病的臨床表現為何種綜合徵,幾乎都有蛋白尿和血尿同時存在,蛋白尿為非選擇性,血尿常為鏡下持續性血尿,有10%~20%患者常於呼吸道感染後出現發作性肉眼血尿,為嚴重的、多樣尿紅細胞畸形的腎小球源性血尿。約1/3以上患者伴有高血壓,高血壓的程度一般比較輕,但也有個別病例,尤其是Ⅱ型患者,可能發生嚴重的高血壓,大劑量的激素治療也有可能誘發高血壓危象。至少有半數的患者出現急性或慢性腎功能不全,在發病初期出現腎功能不全常提示預後不良。患者常於起病後即有較嚴重的正細胞正色素性貧血,表現為面色蒼白,氣短、乏力,並且貧血的程度與腎功能減退程度不成比例。其發生機制尚不清楚,可能與紅細胞表面的補體激活有關,也可能因為毛細血管的病變使紅細胞的壽命縮短。 本病發病時,至少有1/2的患者表現為腎病綜合徵;約1/4的患者表現為無症狀性血尿和蛋白尿;還有1/4~1/3的患者表現為急性腎炎綜合徵,伴有紅細胞及紅細胞管型尿、高血壓和腎功能不全。約有一半的患者可有前驅呼吸道感染史,40%在起病前有抗“O”滴度升高和鏈球菌感染的其他證據。有的患者可發生部分脂質營養不良(Barraquar-Simmons病),尤其是Ⅱ型病變,甚至可以在還沒有腎臟病臨床表現時發生。某些患者可顯示X-連鎖遺傳。先天性的補體和a1-抗胰蛋白酶缺乏也易發生在本病Ⅰ型。在腎病綜合徵時,可發生腎靜脈血栓形成。儘管本病發展有高度的個體差異性,但本病病情總體上呈緩慢的進行性進展。因本病Ⅰ型和Ⅱ型組織病理和免疫病理改變不一樣且為兩種類型的形態,目前臨床上多認為它們是代表不同的疾病。臨床上Ⅱ型更傾向於表現為腎炎徵象,新月體腎炎和急性腎衰的伴發率高,而Ⅰ型具有更多腎病的特徵,常有先驅感染和貧血;Ⅱ型患者血清常常有持續的低補體血症,並且發病年齡較小,幾乎所有患者發病均在20歲以下,儘管也有例外。此外,Ⅱ型更容易在腎移植後復發。Ⅲ型很少見,主要發生在兒童和青年,10~20歲為高峰,40歲少見。男女發病接近。對於該型的臨床表現描述很少,基本與Ⅰ型的長期臨床改變相似。據Strife的描述,Ⅲ型有C3水平降低,但無C3腎炎因子。非腎綜性蛋白尿的預後比腎病綜合徵表現者要好。該型進入終末期腎病的個體差異比較大,在長期的病程中,有些患者病情可以比較穩定甚至逐漸改善。
 表1
表1流行病學
本病雖然可見於任何年齡,但90%的Ⅰ型和70%的Ⅱ型病人發病是在8~16歲,也有報導本病的發病年齡多在5~30歲,2歲以下和老年人很少見。Ⅰ型中男性稍多於女性,Ⅱ型男女均等。在本病中65%~70%病人為Ⅰ型,20%~35%為Ⅱ型,剩餘病人為其他類型。西方國家中,本病占兒童腎病綜合徵的7%,成人中約占10%,並且其發病還呈下降的趨勢,尤其是Ⅰ型,因此本病在臨床上並不常見。北大附院的資料提示Ⅰ型占原發性腎病綜合徵的14%,略高於西方國家。本病地區與種族略有差異,不同地區及人種百分比有所不同。歐美國家MPGN的發病占腎穿刺活檢患者的2%~6%,其中Ⅰ型MPGN最為常見,占原發腎小球腎炎的3.2%~9.0%。兒童及成人Ⅰ型MPGN分別占其各自MPGN發病的52%~57%及78%,Ⅱ型MPGN發病率較低。在我國Ⅰ型MPGN多見,Ⅰ型及Ⅲ型MPGN約占原發性腎小球腎炎的8.9%。遺傳方面發現先天性補體缺陷者易患MPGN,已證實白種人HLA-B8、DR3與Ⅰ型MPGN有關。
發病原因
疾病病因
膜增生性腎炎按其臨床和實驗室特點分為原發性和繼發性腎小球病,見表1。
原發性膜增生性腎炎病因不明,一般認為Ⅰ型為免疫複合物病;Ⅱ型為免疫複合物及自身抗體性疾病,可能與遺傳有關。繼發性膜增生性腎炎中混合性冷球蛋白血症有3種亞型。Ⅰ型冷球蛋白血症是單株峰球蛋白,通常為骨髓瘤蛋白。Ⅱ型通常為單株峰IgM球蛋白結合IgG,又稱抗IgG類風因子,而Ⅲ型則是多株峰免疫球蛋白。Ⅱ型和Ⅲ型冷球蛋白血症易發生腎損害。其病理特徵為系膜細胞大量增生、白細胞尤其單核細胞浸潤、腎小球基膜增厚有雙軌現象。約1/3病例有中小動脈炎,毛細血管內有微血栓形成。MPGN的病因與發病機制不十分明確。Ⅰ型MPGN認為是免疫複合物病,由相對大的難溶的免疫複合物反覆持續沉積引起。Ⅱ型MPGN患者血清中也存在免疫複合物,冷球蛋白、補體異常、血清C3持續降低。均提示免疫複合物在Ⅱ型MPGN中的作用。Ⅱ型MPGN患者血清中可檢出C3腎炎因子(C3NeF),C3NeF是C3bBb轉化酶的自身抗體,使C3bBb作用加強,導致補體旁路持續激活,產生持續低補體血症和基膜變性。所以補體代謝障礙為中心環節。另外,Ⅱ型MPGN腎移植中常復發,可能因病人血清中存在能引起異常糖蛋白形成的物質沉積於基底膜而導致腎炎。本病可能與遺傳有關,Ⅱ型MPGN患者常出現HLA-B7。大多Ⅰ型MPGN病人具有特殊B細胞同種抗原。
病理生理
MPGN的發病機制尚不清楚,目前認為與免疫學機制有關。50%~60%的MPGN患者血中出現補體C3、C1q及C4降低,提示旁路途徑及經典途徑均被激活而導致血中補體的降低。並伴有免疫複合物的輕度增多及冷球蛋白血症,腎小球內有免疫球蛋白及補體的沉積。但補體的異常與疾病的關係、免疫複合物的作用還有待進一步探討。根據各種免疫複合物沉積在腎小球基底膜內和系膜區的形式及沉積的程度不同將MPGN分為3種類型。
1.Ⅰ型以內皮下及系膜區的複合物沉積為主。Ⅰ型與病毒、細菌及寄生蟲感染及一些免疫複合物疾病有關(如遺傳性補體缺失、SLE、混合性冷球蛋白血症、SBE、分流性腎炎、淋巴瘤、血吸蟲病),但常為特發性。在Ⅰ型MPGN患者中33%~50%出現低補體血症,25%~30%患者Clq、C4及C5降低,15%~20%的患者B因子降低。
2.Ⅱ型被稱為自身免疫性疾病,在電鏡下可觀察到沿著基底膜的層黏蛋白層呈均勻一致的帶狀沉積,此型又稱為緻密物沉積病(DDD),還常伴有上皮下類似駝峰樣沉積物沉積。PAS染色有時可見毛細血管襻上呈條帶狀深染。Ⅱ型主要被認為與鏈球菌感染有關,由於鏈球菌與腎臟抗原有交叉反應,可引起抗體介導的腎損害。Ⅱ型常並發血漿低C3水平,因為部分患者血中存在補體激活物,一種自身抗體,也稱致腎炎因子或C3腎炎因子,直接抗C3bBb,改變C3旁路轉化,通過與轉化酶結合,阻止一些正常抑制因子如H因子等作用,增加了補體的活化及消耗。C3腎炎因子在Ⅰ型和Ⅱ型MPGN中多見,尤其是在Ⅱ型中更為常見。部分與脂質營養不良有關。由於MPGNⅡ型主要是基底膜的損害,如有大量的緻密沉積物沉積在基底膜上,這些沉積物可以激活補體,補體被一些特殊物質如核糖酶激活,通常又可以激活旁路途徑,使C3腎炎因子繼發性持續增加,而導致血中補體C3的下降。Ⅱ型MPGN中。70%的患者補體C3和B因子降低。
3.Ⅲ型內皮下、系膜區及上皮下都有沉積物沉積。Ⅲ型和Ⅰ型的區別在於上皮下是否有沉積。伴隨時間的遷移,MPGN的病理改變多從增生走向明顯的硬化。亞型為局灶型MPGN時,病變可移行為瀰漫經典型MPGN。部分小兒或青少年,開始為瀰漫性MPGN,亞型多為分葉型,之後可移行為局灶型或完全緩解。
科學診斷
診斷
本病診斷的主要依據是病理檢查結果,電鏡和免疫螢光檢查可以區分Ⅰ型和Ⅱ型。持續性的低補體血症,持續無選擇性的蛋白尿(或腎病綜合徵)伴有嚴重的多樣畸形的紅細胞尿,與腎功能下降不成比例的貧血,常提示該病發生。C3腎炎因子和血補體C3同時降低常提示病情活動。低C3血症還見於其他繼發性腎小球病如:活動性肝病、白血病、轉移性腫瘤、和免疫球蛋白血症,因其有原發病的特徵不難鑑別。由於MPGN常在上呼吸道感染之後急性起病,表現為急性腎炎綜合徵,甚至半數左右患者抗“O”鏈球菌感染的證據呈陽性,故應與鏈球菌感染後腎小球腎炎相鑑別。後者常有肉眼血尿,而血補體水平在2個月內常恢復正常。本病肉眼血尿在發病後第1年內較為少見,而持續的低補體血症則應懷疑本病。另外鏈球菌感染後腎炎的病理常表現為毛細血管內增生性腎小球腎炎,結合病理檢查不難區分。Ⅳ型系統性紅斑狼瘡活動期,補體,尤其C3常降低,病理檢查有時也有系膜結構向基底膜和內皮間長入形成間位,病變累及廣泛,免疫複合物可以沉積於腎小球的各個部位,與本病Ⅰ型有些混淆,但是注意結合臨床其他表現和免疫螢光檢查的C1q的陽性程度以及血清免疫學檢查可加以鑑別。Ⅰ型的病理檢查系膜區明顯擴張,可表現為結節性硬化灶,與糖尿病腎小球硬化或者輕鏈沉積病的光鏡改變相似,但是免疫螢光和電鏡的結果可以容易地將本病和其他疾病區分開,當然結合臨床表現,血生化和血清免疫學檢查就更容易鑑別。
 膜增殖性腎小球腎炎
膜增殖性腎小球腎炎應與其他的繼發性系膜毛細血管性腎炎相鑑別。如B肝相關性腎炎,根據病毒血清學及腎臟組織B肝病毒抗原標誌物可以鑑別。冷球蛋白血症臨床與病理均與該病相似,但很少見,並且前者有相應的全身表現,病理有腎臟小血管炎和透明血栓形成提示為繼發性的病變。
檢查
實驗室檢查
本病患者幾乎總有血尿,包括鏡下或者肉眼血尿。蛋白尿可以比較輕微,約有30%表現為無症狀性蛋白尿,但半數患者尿蛋白>3.5g/24h,90%以上患者蛋白尿選擇性差。尿FDP和C3可升高。實驗室檢查的一個特徵性改變就是血補體的降低。約有75%的本病患者C3持續性降低,其中Ⅱ型病變中較常見,占80%~90%,約10%的患者顯著下降到低於20~30mg/dl。在Ⅰ型病變中,平均C3濃度降至正常的68%,在Ⅱ型降為正常的47%,而且Ⅱ型比Ⅰ型持續時間更長。早期起作用的補體成分(如C1q、CA),在Ⅰ型病變中有不同程度的下降,而在Ⅱ型中通常正常或者輕度下降,但Ⅱ型常伴有晚期起作用的補體成分C5b-9的下降。在沒有任何病情變化或治療的情況下,血清C3水平可有波動,並有可能隨時間的推移有恢復正常的傾向,說明補體的變化與病情及治療無相應的關係。繼發於狼瘡性腎炎、晚期肝病、單克隆球蛋白病、白血病和轉移癌的腎病綜合徵可以出現C3下降,但是其他原發性腎病綜合徵,除鏈球菌感染後腎炎外,少見C3降低,因此持續的補體降低對於該病的診斷有很大的提示作用。與本病不同,鏈球菌感染後腎小球腎炎的C3水平常下降,但在6~8周多特徵性地恢復到正常水平。毛細血管性腎小球腎炎腎病綜合徵時補體持續降低,多大於2個月。C3的低下,是補體途徑激活和合成減少的結果。C3降低而經典途徑C1q和C4一般正常,表明替代途徑可能被激活。但是,繼發於冷球蛋白血症的系膜毛細血管性腎小球腎炎,C4的降低比C3更顯著。本組疾病患者血中存在一種熱穩定因子,又稱C3腎炎因子(C3NF)這是一種對自身C3轉化酶的抗體。Ⅱ型中60%以上檢測有C3NF陽性,Ⅰ型僅有10%~20%呈陽性,可能是引起這些患者持續低C3血症的原因之一。C3NF及其類似物,還可見於其他與腎炎相關的腎小球疾病。其他一些降解C3的因子在急性腎炎尤其是狼瘡性腎炎中可以檢測到。血清備解素水平通常正常,如果C3水平下降,則備解素水平也可輕度下降。B因子的血清水平通常正常或稍下降。循環免疫複合物及冷球蛋白可呈陽性。75%以上的Ⅰ型有特殊B細胞同種抗原,提示有易感性的遺傳基礎。HLA-AB7和家族性BIH缺陷與Ⅱ型疾病相關。臨床上部分患者可有氮質血症,這往往提示急性腎炎綜合徵。腎小球濾過率常降低,但也可正常,甚至腎活檢顯示腎小球嚴重損害,GFR有時也會正常。常伴有水鈉瀦留,導致高血壓。半數以上患者可有正細胞正色素性貧血,貧血可以很嚴重,其嚴重程度與氮質血症不成比例。紅細胞和血小板壽命可以縮短。40%~60%患者的抗鏈球菌抗體滴度增高。
其他輔助檢查
1.Ⅰ型膜增殖性腎小球腎炎病理及活檢檢查
(1)光鏡:
Ⅰ型膜增殖性腎小球腎炎主要改變是瀰漫性的毛細血管壁增厚和血管內細胞增生,還有單個核白細胞和中性粒細胞浸潤。系膜區和毛細血管壁由於細胞增生和基質增加而呈現不同程度的擴張,通常是均一地影響幾乎所有的小葉,可引起毛細血管叢的分葉結構突出,因此早期稱這一病變為小葉性腎小球腎炎。至於分葉型和非分葉型病變之間是否存在因果或先後關係,至今尚無定論。系膜區明顯擴張形成結節狀,結節中間區可有硬化灶,與糖尿病腎小球硬化或者輕鏈沉積病的病變相似,但是結合光鏡、免疫螢光和電鏡的結果就可以容易地將本病和其他疾病區分開來。另一明顯但不是特異的表現是腎小球基底膜增厚,用適當的染色(如銀染或過碘酸希夫酸染色)可以很容易看到呈雙軌狀或者多層,這是由於增生了的系膜細胞及其基質伸展和插入基膜與內皮細胞之間,形成間位所致,即插入的系膜形成偽基底膜,而不是一般認為的基底膜分裂。偶爾可在內皮下部位見有嗜伊紅沉積物。少數患者可有新月體,但很少累及50%以上的腎小球,與其他的腎炎一樣,如有大量新月體則提示預後不良。晚期病人常有間質纖維化、小管萎縮和間質單核炎症細胞浸潤。毛細血管腔內出現“透明血栓”,提示病變可能繼發於冷球蛋白血症或者系統性紅斑狼瘡。“透明血栓”並不是真正的血栓,而是免疫複合物充填毛細血管腔所致。腎活檢光鏡下可將MPGN分為5個亞型:①分葉型:毛細血管襻呈明顯的分葉狀,主要以細胞增生為主,也可以伴有不同程度的硬化。②經典型(雙軌型):由於系膜插入而使基底膜瀰漫性增厚,出現雙軌,分葉狀不典型。③混合型:系膜插入和分葉狀雖不典型,但是在基底膜的上皮下、內皮下及系膜區內都有免疫複合物沉積,系膜細胞增生及基質增生,基底膜明顯肥厚。這種類型與狼瘡性腎炎的瀰漫增生型非常相似,有人稱之為混合性膜性和增生性腎小球腎炎。④局灶型:MPGN的改變只占全部腎小球的50%以下。⑤新月體型:50%以上的腎小球出現新月體。
(2)電鏡:
超微結構的典型特徵是系膜細胞和基質在腎小球毛細血管基膜與內皮細胞之間的伸展和間位,有電子緻密免疫複合物沉積。系膜毛細血管性腎小球腎炎這一名稱正是由Ⅰ型病變中系膜和毛細血管的這種改變而來。在內皮下沉積物的周圍和系膜細胞胞漿附近區域,可見有新的基底膜物質形成。在系膜細胞增生和系膜基質擴展的區域通常有散在的緻密物沉積。上皮下可有多少不一的電子緻密物沉積,當數量足夠多時與膜性腎病相似,一些腎臟病理學家稱之為“混合性膜性和增生性腎小球腎炎”,或者Burkholder提出的“Ⅲ型系膜毛細血管性腎小球腎炎”。有極少數病變其腎小球損害與Ⅰ型的光鏡和免疫螢光相似,但超微結構以腎小球基底膜不規則增厚,膜內有密度不一的大量沉積物為特徵,這類病變也歸入Ⅲ型。系膜基質和基底膜之間可有單核細胞或中性粒細胞浸潤。有些腎活檢組織中有少至中量的膜外沉積物呈“駝峰”狀。上皮足突常消失。光鏡下的透明血栓表現為血管腔內球性緻密物,當這些結構或者任何其他電子緻密沉積物呈現微管樣結構,提示可能為冷球蛋白血症或者免疫觸鬚樣腎病。(3)免疫螢光:
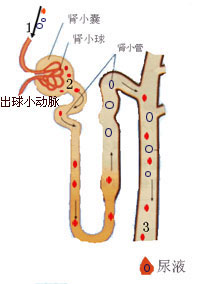 腎小管
腎小管特徵性的改變是補體尤其是C3和免疫球蛋白呈顆粒狀或帶狀分布,可顯示出小葉外周的輪廓,這與電鏡觀察到的內皮下免疫複合物沉積的部位相一致,沉積物的形態通常不如膜性腎病對稱,顆粒狀也沒有那么明顯。備解素及B因子呈相似分布。系膜的顆粒狀沉積可以明顯也可以不明顯。少數Ⅰ型可見免疫複合物沿小管基底膜和(或)腎小球外的血管沉著。沉積的免疫複合物的成分可有很大不同,可能反映了引起Ⅰ型的多種原因,大多數患者C3的沉積比任何免疫球蛋白都明顯;有一些以IgG或IgM為主;還有極少數以IgA為主,可以認為是表現為系膜毛細血管性腎小球腎炎的IgA腎病。早期起作用的補體成分如C1q和C4,比C3稍少見。少數病人可見毛細血管壁有Ig(尤其是IgM和IgG)呈節段性顆粒狀分布,偶爾也可見於系膜區。毛細血管腔內大量的免疫球蛋白和補體沉積形成球狀結構,這與光鏡觀察的透明血栓相一致,提示病變繼發於系統性紅斑狼瘡或者冷球蛋白血症。
2.Ⅱ型膜增生性腎小球腎炎病理及活檢檢查
(1)光鏡:Ⅱ型的光鏡改變比Ⅰ型變化更多,不只是膜增殖的改變,這使一些腎臟病理學家認為稱之為緻密物沉積病比Ⅱ型系膜毛細血管性腎小球腎炎更準確。1995年WH0將其分類為繼發性代謝性疾病中。在組織學上,表現為腎小球系膜細胞和基質增生,增生明顯時,可以形成明顯的分葉結構以及毛細血管壁增厚。有些毛細血管因系膜間位,使毛細血管壁呈雙軌狀。這些典型的膜增殖性改變與Ⅰ型相似,但是部分有明顯的毛細血管壁增厚,細胞增生呈灶狀或者不伴有細胞增生,還有部分僅有細胞呈灶狀或者瀰漫增生,但沒有毛細血管壁的明顯增厚。系膜改變的程度有很大的個體差異性,系膜細胞和基質的增加可以很輕微也可以很嚴重。用Masson三色染色在系膜區常可見有圓形嗜伊紅沉積物,有些可有上皮下“駝峰”狀沉積物。毛細血管腔內中性白細胞數常增加,少數有新月體形成,間質可有白細胞浸潤和纖維化。因此,Ⅱ型的光鏡改變可以與其他腎炎類似,需要結合電鏡和免疫螢光的結果才能準確判斷。有個別報告此型患者不伴有系膜增生性改變,因而與Ⅰ型不同。(2)電鏡:Ⅱ型又叫做緻密物沉積病,強調對本病具有診斷性的特徵是腎小球基底膜上不連續的電子緻密帶形成,並伴有系膜球狀或不規則狀緻密物沉積,有時內皮下和上皮下也有沉積,一些改變與鏈球菌感染後腎小球腎炎的“駝峰”樣相似。基底膜明顯增寬和有極度電子緻密結構,這有很大的診斷意義。但在每一個腎小球中,有些毛細血管壁可沒有上述病損。緻密結構可呈梭狀、球狀或香腸狀,與正常結構之間的分界很清晰。系膜細胞和基質常向外周伸展和間位,但不及Ⅰ型明顯。上皮細胞足突常完全消失。許多病人系膜區常有圓形的電子緻密沉積物。如腎小管基底膜有電子緻密沉積物,則高度提示為Ⅱ型病損。
 表2
表2(3)免疫螢光:大量C3在腎小球毛細血管壁基底膜呈線狀或帶狀沉積,C3呈不連續的線狀類型,可以顯示出毛細血管壁、腎小球囊和腎小管的輪廓。系膜的沉積物呈分散的針狀或環狀,環狀是由於僅沉積物的外側被染色的結果。另外,許多毛細血管壁可有顆粒狀C3沉積物,線狀毛細血管壁螢光呈雙軌狀,是由於C3沉積於基底膜的兩側。其他補體成分僅見於不到50%的活檢病例。免疫球蛋白沉積很少。
3.其他類型系膜毛細血管性腎小球腎炎
目前尚不能確定它們是Ⅰ型病損的變異類型,還是獨立的病變。這些類型幾乎都以電鏡觀察為基礎加以識別。Burkholder提出了Ⅲ型病損,它的特徵是除了與Ⅰ型的共同病理改變之外,尚有較突出的上皮下免疫複合物沉著,並有細血管壁伴有孤立的膜外沉積物,被基膜物質突起所隔離(類似膜性腎小球腎炎基底膜的釘狀突起),有些學者認為此類型是膜性和增生性腎小球腎炎的混合型(表2)。
鑑別診斷
診斷MPGN需要排除所有繼發性因素,如B型肝炎或C型肝炎、愛滋病、其他感染或結締組織病。MPGN的診斷主要通過組織病理學的檢查,隨著C型肝炎相關性MPGN、HIV相關MPGNC的日趨流行,對表面上看似原發性MPGN的患者必須做相應的血清學檢查。
常見需要鑑別的疾病有:
1.糖尿病腎病MPGN的結節狀損害出現在大多數腎小球中,而糖尿病腎病發生結節狀損害的小球相對較少,另外從免疫病理學上可以進行鑑別。
2.澱粉樣變腎病HE、剛果紅染色及電鏡下完全可以鑑別。
3.輕鏈腎炎光鏡下與MPGN難以鑑別,免疫病理學可以明確區分。
4.狼瘡性腎炎慢性低補體血症應與狼瘡性腎炎進行鑑別。狼瘡性腎炎可以出現多種類型的病理學改變,如可出現類似於Ⅰ、Ⅲ型MPGN樣的改變,但狼瘡性腎炎在腎小球內可有IgG、IgM、IgA、C3、C4、C1q的沉積,即“滿堂亮”表現,而MPGN同時出現多種免疫球蛋白及補體沉積的情形罕見。
5.過敏性紫癜腎炎可出現類似於MPGN樣的病理變化,鑑別的要點為紫癜性腎炎腎小球系膜區及毛細血管襻上有大量的IgA沉積,還可表現出皮膚紫癜、關節痛和腹痛等。
6.感染後腎炎感染後腎炎與MPGN的Ⅰ型有時難以鑑別,但一般感染後腎炎的病程比較短。偶爾感染後腎炎也可發展為MPGN。
治療預防
治療
本病所致腎病綜合徵的治療常常比較困難。小劑量、隔天潑尼松治療可能有利於改善腎功能。West等使用隔天口服激素長期治療,在治療前後比較腎活檢,結果證明此法有利於腎臟的存活。 大部分腎病學家僅做對症治療。Ⅰ型的治療,除糖皮質激素外,還可用其他藥物如免疫抑制藥和抗凝劑。對於各年齡段MPGN患者,如腎功能正常且僅表現為無症狀輕度蛋白尿時,無須接受激素、免疫抑制藥治療。僅需每3~4個月隨訪1次,密切觀察腎功能、蛋白尿和血壓控制情況。成人和兒童原發性MPGN患者,在尿蛋白>3g/d,腎功能損害及活檢發現腎間質病變時,方可給予激素、免疫抑制藥治療。對於有蛋白尿(>3g/d)或腎功能損害的兒童原發性MPGN患者,大劑量糖皮質激素隔天40mg/m2,治療6~12個月後可能有效。如果無效則停止服用糖皮質激素,建議密切隨訪,著重保守治療(即控制血壓、套用降低尿蛋白藥物和糾正代謝紊亂)。對於有蛋白尿(>3g/d)或腎功能損害的成人原發性MPGN患者,應給予阿司匹林(325mg/d)、雙嘧達莫(潘生丁)治療(75~100mg,2次/d),或二者聯合套用12個月,該治療方案如果無效則停用。重視能夠延緩腎功能衰退的因素和密切隨訪應是治療計畫的一部分。幾項治療研究報導了隔天或每天口服糖皮質激素、靜脈注射大劑量糖皮質激素、及兩者聯合套用的結果:其中1項較嚴謹的研究證實:對兒童MPGN,激素治療在減緩腎小球濾過率(GFR)下降和穩定腎功能方面有效。80例患兒大部分為Ⅰ型MPGN,套用潑尼松(強的松)40mg/m2隔天口服,平均治療時間為13個月,61%的治療組患兒在研究階段腎功能穩定,而安慰劑組僅為12%。證明了兒童MPGN患者套用糖皮質激素有效。研究顯示兒童的MPGN早期套用大劑量潑尼松(強的松)可有效縮短病程。但尚有爭議,仍須用嚴格的隨機對照試驗來驗證。Danadio等分別研究雙嘧達莫(潘生丁)、阿司匹林和華法林在MPGN治療中對腎臟轉歸(包括尿蛋白排泄率)和血小板半衰期(出血傾向)的影響。結果是尿蛋白排泄率降低,但GFR無明顯變化。Cattran等研究59例MPGN患者服用環磷醯胺、華法林和雙嘧達莫(潘生丁)的療效,治療時間18個月。作者詳細說明了該項研究僅對Ⅰ型MPGN患者有較清晰的治療,而對Ⅱ型疾病沒有足夠有力的證據得出結論。目前對Ⅱ型還沒有很有效的治療方法。由於對治療本病的合理方案還有爭論,在選擇治療方案時應慎重地權衡療效與治療不良反應。葉任高等推薦使用下述方案:雙嘧達莫(潘生丁)50~300mg/d,分3次服用。如有腎病綜合徵表現者,可用對症的方法,並試用標準療程的激素,待減量至維持量(隔天晨頓服潑尼松0.4mg/kg)時,再維持套用較長時期,如有高血壓,建議使用新階梯法降壓治療。在實施治療方案中應密切觀察毒副作用,以揚長避短,達到治療效果。其他治療包括降脂、ACEI、ARB、低分子肝素等,近年有學者報導用霉酚酸脂(MMF)治療本病,顯示初步效果,但病例數尚少,且缺乏對照和長期觀察研究。另外,細胞毒藥物套用、血漿置換方法、中藥治療在一些研究治療中獲得一些療效。
 雙嘧達莫
雙嘧達莫臨床醫生在決定什麼類型的患者何時進行治療時,必須考慮疾病的預期病程和結局,以及治療的利弊,腎功能不全的進行性發展和藥物治療引起的依從性差等因素。潑尼松隔天治療本病的情況見表3。
預後
大量研究證實原發性MPGN10年腎存活率達60%~65%,而且各型MPGN病程及預後類似。腎病綜合徵(大量蛋白尿)和出現腎間質病變是預後不良的主要徵兆。臨床發現表現為持續性高血壓、GFR下降的腎病綜合徵預後差。發病年齡小和小兒患者預後良好;成年人發病者病變進行性加重,預後不良。腎小球系膜細胞增生、基底膜增厚與預後無明顯關係,而局灶性新月體形成的多少與預後明顯相關,間質改變的輕重程度與預後明顯相關,新月體形成及嚴重的腎小管間質病變預後差。約50%表現為腎病綜合徵的病人10年內發展為ESRF,50%病人腎病綜合徵持續數年後消失,腎功能正常。腎移植後,本病可再發,但小於10%病人導致移植腎喪失。接受糖皮質激素藥物、免疫抑制藥及抗凝藥物等聯合治療者,腎功能可保持穩定或得到較好改善。本病進入終末期腎病的個體差異比較大,Ⅰ型患者通常1/3可以自發緩解,1/3呈進行性發展,還有1/3疾病遷延進展緩慢,但一直不能完全緩解。文獻資料中提示原發性Ⅰ型病變的預後不良因素有:高血壓,腎功能損害,腎病綜合徵範圍的蛋白尿形成,腎活檢時發現細胞性新月體,合併動脈病變,有腎小管及間質的損害。英國的Cameron發現Ⅰ型有腎病綜合徵範圍的蛋白尿者10年的生存率為40%,而非腎綜範圍蛋白尿患者的10年生存率為85%;但另有研究認為二者預後沒有差別,血尿甚至肉眼血尿對預後都無影響,年齡和性別也都不影響本病預後。Ⅱ型較Ⅰ型的預後差,這可能是由於Ⅱ型為緻密物沉積疾病,腎活檢常會發現新月體和小管間質病變。Ⅱ型很少發生臨床緩解,兒童患者的臨床緩解率不足5%。患者通常在病程的第8~12年進入腎功能衰竭。Ⅱ型患者在做腎移植以後常常會復發,尤其是腎移植前活檢就發現有新月體改變的患者。Ⅰ型在腎移植後也可能出現再發,但是沒有Ⅱ型頻繁。
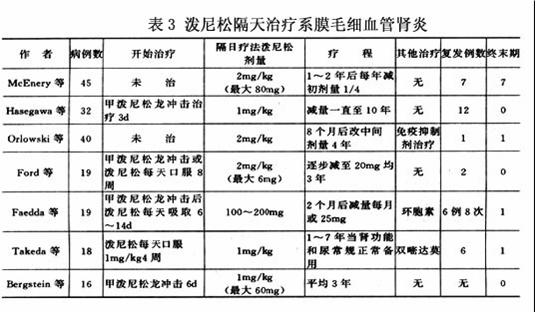 表3
表3預防
本病3型病程轉歸基本相同。預防要從自身健康著手,平時避免勞累,合理飲食,科學鍛鍊,增強體質,提高機體免疫力,以防疾病發生。對於已患和出現併發症的病人,應對原發病及併發症進行積極有效的預防和治療。一旦發現感染,應及時選用對致病菌敏感、強效且無腎毒性的抗生素治療,有明確感染灶者應儘快去除,以防腎功能不全的進行性發展。
 膜增殖性腎小球腎炎
膜增殖性腎小球腎炎 表1
表1 膜增殖性腎小球腎炎
膜增殖性腎小球腎炎 腎小管
腎小管 表2
表2 雙嘧達莫
雙嘧達莫 表3
表3 膜增殖性腎小球腎炎
膜增殖性腎小球腎炎 表1
表1 膜增殖性腎小球腎炎
膜增殖性腎小球腎炎 腎小管
腎小管 表2
表2 雙嘧達莫
雙嘧達莫 表3
表3