物質簡介,目錄,硫化氫-簡介,物化性質,物理性質,化學性質,計算化學數據,製備方法,簡介,原理,用品,操作,注意事項,口訣,基本用途,相關危害,健康危害,毒理學資料,相關措施,急救措施,消防措施,硫化氫檢測儀,硫化氫-儲運,
物質簡介
硫化氫是一種無機化合物,化學式為H2S。正常情況下是一種無色、易燃的酸性氣體,濃度低時帶惡臭,氣味如臭蛋;濃度高時反而沒有氣味(因為高濃度的硫化氫可以麻痹嗅覺神經)。它能溶於水,0°C時1
摩爾水能溶解2.6摩爾左右的硫化氫。硫化氫的水溶液叫氫硫酸,是一種弱酸,當它受熱時,硫化氫又從水裡逸出。硫化氫是一種急性劇毒,吸入少量高濃度硫化氫可於短時間內致命。低濃度的硫化氫對眼、呼吸系統及中樞神經都有影響。
硫化氫
目錄
1.簡介1.簡介2.物化性質2.物化性質2.1 物理性質2.1 物理性質2.2 化學性質2.2 化學性質3.計算化學數據3.計算化學數據4.製備方法4.製備方法4.1 簡介4.1 簡介4.2 原理4.2 原理4.3 用品4.3 用品4.4 操作4.4 操作4.5 備註4.5 備註4.6 口訣4.6 口訣5.基本用途5.基本用途6.相關危害6.相關危害7.相關措施7.相關措施8.硫化氫檢測儀8.硫化氫檢測儀9.儲運9.儲運科研專用硫化氫氣體 - 硫化氫-簡介
硫化氫-簡介
硫化氫,無色氣體,有惡臭和毒性。密度1.539g/L。相對密度1.1906(空氣=1)。熔點:-82.9℃,沸點:-61.8℃。溶於水、乙醇、甘油。溶於水生成氫硫酸(一種弱酸)。
化學性質不穩定,在空氣中容易燃燒。能使銀、銅等製品表面發黑。與許多金屬離子作用,生成不溶於水或酸的硫化物沉澱。氫硫酸(一種弱酸)。
化學性質不穩定,在空氣中容易燃燒。能使銀、銅等製品表面發黑。與許多金屬離子作用,生成不溶於水或酸的硫化物沉澱。
化學式:H2S 硫化氫分子式
式量:34.076
國標編號:21006
CAS號:7783-06-4
EINECS號:231-977-3
MDL號:MFCD00011444
RTECS號:MX1225000
BRN號:3535004
PubChem號:24888266
InChI:InChI=1/H2S/h1H2
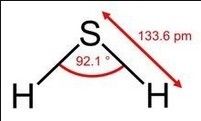
硫化氫分子式
科研專用硫化氫氣體 - 硫化氫-物化性質
物化性質
物理性質
物理性質
理化特性外觀:常溫下為無色氣體
氣味:有刺激性(臭雞蛋)氣味(注意:在一定濃度下無氣味)
嗅覺閾值:0.00041ppm
燃點:260℃
蒸汽壓:2026.5kPa/25.5℃
閃點:<-50℃
爆炸極限:4.3–46%
溶解性:溶於水、
乙醇。溶於水(溶解比例1:2.6)稱為氫硫酸(硫化氫未跟水反應)
電離常數:K1=0.9×10-7,K
2=0.12×10-14。乙醇。溶於水(溶解比例1:2.6)稱為氫硫酸(硫化氫未跟水反應)電離常數:K1=0.9×10-7,K
2=0.12×10-14。
密度:相對空氣密度1.19(空氣密度設為1)。密度:相對空氣密度1.19(空氣密度設為1)。
穩定性:不穩定,加熱條件下發生可逆反應H2S=H2+S
危險標記:2.1類易燃氣體,2.3類毒性氣體,有劇毒。易燃氣體,2.3類毒性氣體,有劇毒。
化學性質
不穩定性
H2S=H2+S(加熱)
酸性
H2S水溶液叫氫硫酸,是一種二元弱酸。
2NaOH+H2S=Na2S+2H2O
還原性
H2S中S是-2價,具有較強的還原性,很容易被SO2,Cl2,O2等氧化。氧化
可燃性
在空氣中點燃生成
二氧化硫和水:2H2S+3O2=2SO2+2H2O(火焰為藍色)(條件是點燃).若空氣不足或溫度較低時則生成單質硫和水。
沉澱性
硫化氫氣體通常運用沉澱性被除去,一般的實驗室中除去硫化氫氣體,採用的方法是將硫化氫氣體通入
硫酸銅溶液中,形成不溶解於一般強酸(
非氧化性酸)的硫化銅。CuSO4+H2S=CuS↓+H2SO4
注意:硫化氫的硫是-2價,處於最低價沒錯。但氫是+1價,能下降到0價,所以仍有氧化性。
如:2Na+H2S==Na2S+H2↑硫化氫亦有氧化性
硫和水:2H2S+3O2=2SO2+2H2O(火焰為藍色)(條件是點燃).若空氣不足或溫度較低時則生成單質硫和水。
硫化氫氣體通常運用沉澱性被除去,一般的實驗室中除去硫化氫氣體,採用的方法是將硫化氫氣體通入硫酸銅溶液中,形成不溶解於一般強酸(非氧化性酸)的硫化銅。CuSO4+H2S=CuS↓+H2SO4
注意:硫化氫的硫是-2價,處於最低價沒錯。但氫是+1價,能下降到0價,所以仍有氧化性。
如:2Na+H2S==Na2S+H2↑硫化氫亦有氧化性
科研專用硫化氫氣體 - 硫化氫-計算化學數據
計算化學數據
1、疏水參數計算參考值(XlogP):0.5
2、氫鍵供體數量:1
3、氫鍵受體數量:1
4、可旋轉化學鍵數量:0
5、互變異構體數量:無
6、拓撲分子極性表面積(TPSA):1
7、重原子數量:1
8、表面電荷:0
9、複雜度:0
11、確定原子立構中心數量:0
12、不確定原子立構中心數量:0
13、確定化學鍵立構中心數量:0
14、不確定化學鍵立構中心數量:0
15、共價鍵單元數量:1
科研專用硫化氫氣體 - 硫化氫-製備方法
製備方法
簡介
簡介
用硫化亞鐵與
稀硫酸反應即可製得硫化氫氣體。硫化亞鐵與稀硫酸反應即可製得硫化氫氣體。
因硫化亞鐵是不溶性固體,該反應不需加熱,可以用類似於氫氣製取時用的裝置(如
啟普發生器)。啟普發生器。
如用硫化鈉與稀硫酸反應,則因硫化鈉易溶於水反應過於激烈而無法控制。因此不用。硫化鈉與稀硫酸反應,則因硫化鈉易溶於水反應過於激烈而無法控制。因此不用。
原理
原理
用非氧化性的強酸與弱酸鹽(FeS)反應,可生成硫化氫(H2S溶於水即得弱酸氫硫酸):(弱酸氫硫酸):
FeS+H2SO4(稀)=FeSO4+H2S↑;
FeS+2HCl=FeCl2+H2S↑.
硫化氫能溶於水形成氫硫酸,因此不能用排水法收集。因硫化氫的密度比空氣大,可用瓶口向上的
排空氣集氣法收集。密度比空氣大,可用瓶口向上的排空氣集氣法收集。
用品
用品
啟普發生器或簡易氣體發生裝置、集氣瓶、玻璃片、FeS、稀鹽酸(或稀H2SO4)溶液、乙酸鉛試紙。乙酸鉛試紙。
操作
操作
製取H2S可以使用啟普發生器或制氣體的簡易裝置。把FeS放入啟普發生器的球形體內,漏斗里注入稀HCl。需用H2S時,打開導氣管活塞,FeS與稀HCl接觸產生H2S,停止用氣時,只需關閉活塞反應既可停止。
用蘸有乙酸鉛(或硝酸鉛)溶液的試紙,放在集氣瓶口試驗,如果試紙變黑則證明集氣瓶里已充滿了H2S氣:
(CH3COO)2Pb+H2S=PbS↓+2CH3COOH;
Pb(NO3)2+H2S=PbS↓+2HNO3.
備註
注意事項
1.所用硫化亞鐵應是新購置的,若存放時間過久,FeS中Fe和S都會被氧化,從而影響實驗效果。
2.放入氣體發生器中的硫化亞鐵要砸成蠶豆粒大小的塊狀。
3.不能用濃鹽酸,因濃鹽酸揮發出氯化氫,使硫化氫不純。氯化氫,使硫化氫不純。
4.不能用HNO3或濃H2SO4,因為它們都是氧化性酸,與FeS發生
氧化還原反應,而不能生成硫化氫:FeS+2H2SO4(濃)=FeSO4+SO2↑+S↓+2H2O;
FeS+4HNO3=Fe(NO3)2+2NO2↑+S↓+2H2O
5.H2S有毒,實驗時應注意通風,多餘的H2S應及時通入NaOH溶液(或金屬鹽溶液)中進行吸收。
口
口訣
硫化亞鐵稀酸逢,啟普器中氣體生。
櫥中操作上排氣,氧化性酸概不用。
解釋:
1、硫化亞鐵稀酸逢,啟普器中氣體生:“稀酸”在此指稀鹽酸或稀硫酸。這句的意思是說,在實驗室中常用硫化亞鐵(FeS)跟稀鹽酸(HCl)或稀硫酸(H2SO4),在啟普發生器中發生反應來製取硫化氫(H2S)。
2、櫥中操作上排氣:“櫥”指通風櫥。“櫥中操作”的意思是說,該實驗的操作過程必須在通風櫥中進行。“上排氣”意指用向上排空氣集氣法收集H2S,因為H2S能溶與水,且密度比空氣大。
3、氧化性酸概不用:“氧化性酸”在此指濃硫酸(H2SO4)和硝酸(HNO3)。這句的意思是說一概不用氧化性酸與硫化亞鐵反應來製取硫化氫,因為硫化氫是強還原劑,易被氧化性酸氧化。
科研專用硫化氫氣體 - 硫化氫-基本用途
基本用途
1.用於合成螢光粉,電放光、光導體、光電曝光計等的製造。有機合成還原劑。用於金屬精製、農藥、醫藥、催化劑再生。通用試劑。製取各種硫化物。
2.用於製造無機硫化物,還用於化學分析如鑑定金屬離子。
科研專用硫化氫氣體 - 硫化氫-相關危害
相關危害
健康危害
健康危害
侵入途徑:吸入。
健康危害:本品是強烈的
神經毒素,對黏膜有強烈刺激作用。它能溶於水,0℃時1摩爾水能溶解2.6摩爾左右的硫化氫。硫化氫的水溶液叫氫硫酸,是一種弱酸,當它受熱時,硫化氫又從水裡逸出。硫化氫是一種急性劇毒,吸入少量高濃度硫化氫可於短時間內致命。低濃度的硫化氫對眼、呼吸系統及中樞神經都有影響 。神經毒素,對黏膜有強烈刺激作用。它能溶於水,0℃時1摩爾水能溶解2.6摩爾左右的硫化氫。硫化氫的水溶液叫氫硫酸,是一種弱酸,當它受熱時,硫化氫又從水裡逸出。硫化氫是一種急性劇毒,吸入少量高濃度硫化氫可於短時間內致命。低濃度的硫化氫對眼、呼吸系統及中樞神經都有影響。
毒理學資料
毒理學資料
小鼠、大鼠吸入LC50:634×10-6/1h、712×10-6/1h;大鼠吸入LC50:444×10-6/4h。硫化氫主要經呼吸道吸收,人吸入(70~150mg/m3)/(1~2h),出現呼吸道及眼刺激症狀,硫化氫可以麻痹嗅覺神經,吸2~5min後不再聞到臭氣。吸入(300mg/m3)/1h,6~8min出現眼急性刺激症狀,稍長時間接觸引起肺水腫。吸入硫化氫能引起
中樞神經系統的抑制,有時由於刺激作用和呼吸的麻痹而導致最終死亡。在高濃硫化氫中幾秒內就會發生虛脫、休克,能導致呼吸道發炎、肺水腫,並伴有頭痛、胸部痛及
呼吸困難。硫化氫貯存區附近不應有氧化可燃材料、酸或其他腐蝕性材料。避免暴露於高溫環境。
急性毒性:LC50:618mg/m3(444ppm)(大鼠吸入)。
亞急性與慢性毒性:家兔吸入0.01mg/L,每天2h,3個月,引起中樞神經系統的機能改變,氣管、支氣管黏膜刺激症狀,大腦皮層出現病理改變。小鼠長期接觸低濃度硫化氫,有小氣道損害。
其他:LCLo:600ppm(人吸入30min)。
污染源:硫化氫很少用於工業生產中,多為化工過程的副產品。一般作為某些化學反應和蛋白質自然分解過程的產物以及某些天然物的成分和雜質,而經常存在於多種生產過程中以及自然界中。如採礦和有色金屬冶煉。煤的低溫焦化,含硫石油開採、提煉,橡膠、製革、染料、製糖等工業中都有硫化氫產生。開挖和整治沼澤地、溝渠、印染、下水道、隧道以及清除垃圾、糞便等作業。另外天然氣、火山噴氣、礦泉中也常伴有硫化氫存在。副產品。一般作為某些化學反應和蛋白質自然分解過程的產物以及某些天然物的成分和雜質,而經常存在於多種生產過程中以及自然界中。如採礦和有色金屬冶煉。煤的低溫焦化,含硫石油開採、提煉,橡膠、製革、染料、製糖等工業中都有硫化氫產生。開挖和整治沼澤地、溝渠、印染、下水道、隧道以及清除垃圾、糞便等作業。另外天然氣、火山噴氣、礦泉中也常伴有硫化氫存在。
危險特性:易燃,與空氣混合能形成
爆炸性混合物,遇明火、高熱能引起燃燒爆炸。與濃硝酸、
發煙硫酸或其它強氧化劑劇烈反應,發生爆炸。氣體比空氣重,能在較低處擴散到相當遠的地方,遇明火會引起回燃。濃硝酸、發煙硫酸或其它強氧化劑劇烈反應,發生爆炸。氣體比空氣重,能在較低處擴散到相當遠的地方,遇明火會引起回燃。
硫化氫是一種神經毒劑。亦為窒息性和刺激性氣體。其毒作用的主要靶器是中樞神經系統和呼吸系統,亦可伴有心臟等多器官損害,對毒作用最敏感的組織是腦和黏膜接觸部位。人(女性)吸入LCL0:600ppm/30M,800ppm/5M。人(M型硫化氫感測器、男性)吸入LCL0:5700ug/kg。大鼠吸入LC50:444ppm。小鼠吸入LC50:634ppm/1H。呼吸系統,亦可伴有心臟等多器官損害,對毒作用最敏感的組織是腦和黏膜接觸部位。人(女性)吸入LCL0:600ppm/30M,800ppm/5M。人(M型硫化氫感測器、男性)吸入LCL0:5700ug/kg。大鼠吸入LC50:444ppm。小鼠吸入LC50:634ppm/1H。
硫化氫在體內大部分經氧化代謝形成
硫代硫酸鹽和硫酸鹽而解毒,在代謝過程中谷胱甘肽可能起激發作用;少部分可經甲基化代謝而形成毒性較低的甲硫醇和甲硫醚,但高濃度甲硫醇對中樞神經系統有麻醉作用。體內代謝產物可在24小時內隨尿排出,部分隨糞排出,少部分以原形經肺呼出。在體內無蓄積。硫化氫的
急性毒作用靶器官和中毒機制可因其不同的濃度和接觸時間而異。濃度越高則中樞神經抑制作用越明顯,濃度相對較低時黏膜刺激作用明顯。人吸入70~150mg/m3/1~2小時,出現呼吸道及眼刺激症狀,吸2~5分鐘後嗅覺疲勞,不再聞到臭氣。吸入300mg/m3/1小時,6~8分鐘出現眼急性刺激症狀,稍長時間接觸引起肺水腫。吸入760mg/m3/15~60分鐘,發生肺水腫、支氣管炎及肺炎、頭痛、頭昏、步態不穩、噁心、嘔吐。吸入1000mg/m3/數秒鐘,很快出現急性中毒,呼吸加快後
呼吸麻痹而窒息死亡 。硫酸鹽而解毒,在代謝過程中谷胱甘肽可能起激發作用;少部分可經甲基化代謝而形成毒性較低的甲硫醇和甲硫醚,但高濃度甲硫醇對中樞神經系統有麻醉作用。體內代謝產物可在24小時內隨尿排出,部分隨糞排出,少部分以原形經肺呼出。在體內無蓄積。硫化氫的急性毒作用靶器官和中毒機制可因其不同的濃度和接觸時間而異。濃度越高則中樞神經抑制作用越明顯,濃度相對較低時黏膜刺激作用明顯。人吸入70~150mg/m3/1~2小時,出現呼吸道及眼刺激症狀,吸2~5分鐘後嗅覺疲勞,不再聞到臭氣。吸入300mg/m3/1小時,6~8分鐘出現眼急性刺激症狀,稍長時間接觸引起肺水腫。吸入760mg/m3/15~60分鐘,發生肺水腫、支氣管炎及肺炎、頭痛、頭昏、步態不穩、噁心、嘔吐。吸入1000mg/m3/數秒鐘,很快出現急性中毒,呼吸加快後呼吸麻痹而窒息死亡。
科研專用硫化氫氣體 - 硫化氫-相關措施
相關措施
急救措施
急救措施
皮膚接觸:脫去污染的衣著,用流動清水沖洗。就醫。
眼睛接觸:立即提起眼瞼,用大量流動清水或
生理鹽水徹底沖洗至少15分鐘。就醫。
吸入:迅速脫離現場至空氣新鮮處。保持呼吸道通暢。如呼吸困難,給輸氧。如呼吸停止,即進行人工呼吸。就醫。
消防措施
消防措施
燃燒(分解)產物:二氧化硫。二氧化硫。
滅火方法:消防人員必須穿戴全身防火防毒服。切斷氣源。若不能立即切斷氣源,則不允許熄滅正在燃燒的氣體。噴水冷卻容器,可能的話將容器從火場移至空曠處。
硫化氫檢測儀
1、攜帶型硫化氫檢測儀
HFPCY-H2S 攜帶型硫化氫檢測儀,可連續檢測作業環境中硫化氫氣體泄漏濃度。硫化氫檢測儀為自然擴散方式檢測氣體濃度,採用進口
電化學感測器,具有極好的靈敏度和出色的重複性;硫化氫檢測儀採用嵌入式微控制技術,選單操作簡單,功能齊全,可靠性高,整機性能居國內領先水平。檢測儀外殼採用高強度工程材料、複合彈性橡膠材料精製而成,強度高、手感好。
2、泵吸式硫化氫檢測儀
CY-H2S 泵吸式硫化氫檢測儀採用內置吸氣泵,可快速檢測工作環境中硫化氫濃度。泵吸式硫化氫檢測儀採用進口電化學感測器,具有非常清晰的大
液晶顯示屏,聲光報警提示,保證在非常不利的工作環境下也可以檢測危險氣體並及時提示操作人員預防。
3、線上式硫化氫檢測報警器
HFTCY-H2S 線上式硫化氫
檢測報警器由氣體檢測
報警控制器和固定式
硫化氫檢測器組成,氣體檢測報警控制器可放置於值班室內,對各監測點進行監測控制,硫化氫檢測器安裝於氣體最易泄露的地點,其核心部件為
氣體感測器。硫化氫檢測器將感測器檢測到的硫化氫濃度轉換成電信號,通過線纜傳輸到氣體檢測報警控制器,氣體濃度越高,電信號越強,當氣體濃度達到或超過報警控制器設定的報警點時,氣體檢測報警控制器發出報警信號,並可啟動電磁閥、排氣扇等外聯設備,自動排除隱患。線上式硫化氫檢測報警器廣泛套用於石油、化工、冶金、電力、煤礦、水廠等環境,有效防止爆炸事故的發生。
HFPCY-H2S攜帶型硫化氫檢測儀,可連續檢測作業環境中硫化氫氣體泄漏濃度。硫化氫檢測儀為自然擴散方式檢測氣體濃度,採用進口電化學感測器,具有極好的靈敏度和出色的重複性;硫化氫檢測儀採用嵌入式微控制技術,選單操作簡單,功能齊全,可靠性高,整機性能居國內領先水平。檢測儀外殼採用高強度工程材料、複合彈性橡膠材料精製而成,強度高、手感好。
2、泵吸式硫化氫檢測儀
CY-H2S泵吸式硫化氫檢測儀採用內置吸氣泵,可快速檢測工作環境中硫化氫濃度。泵吸式硫化氫檢測儀採用進口電化學感測器,具有非常清晰的大液晶顯示屏,聲光報警提示,保證在非常不利的工作環境下也可以檢測危險氣體並及時提示操作人員預防。
3、線上式硫化氫檢測報警器
HFTCY-H2S線上式硫化氫檢測報警器由氣體檢測報警控制器和固定式硫化氫檢測器組成,氣體檢測報警控制器可放置於值班室內,對各監測點進行監測控制,硫化氫檢測器安裝於氣體最易泄露的地點,其核心部件為氣體感測器。硫化氫檢測器將感測器檢測到的硫化氫濃度轉換成電信號,通過線纜傳輸到氣體檢測報警控制器,氣體濃度越高,電信號越強,當氣體濃度達到或超過報警控制器設定的報警點時,氣體檢測報警控制器發出報警信號,並可啟動電磁閥、排氣扇等外聯設備,自動排除隱患。線上式硫化氫檢測報警器廣泛套用於石油、化工、冶金、電力、煤礦、水廠等環境,有效防止爆炸事故的發生。
科研專用硫化氫氣體 - 硫化氫-儲運
硫化氫-儲運
1.儲存注意事項:儲存於陰涼、通風的庫房。遠離火種、熱源。庫溫不宜超過30℃。保持容器密封。應與氧化劑、鹼類分開存放,切忌混儲。採用防爆型照明、通風設施。禁止使用易產生火花的機械設備和工具。儲區應備有泄漏應急處理設備。
2.包裝注意事項:鋼質氣瓶;磨砂口玻璃瓶或螺紋口玻璃瓶外普通木箱;安瓿瓶外普通木箱。
3.運輸注意事項:鐵路運輸時應嚴格按照鐵道部《危險貨物運輸規則》中的危險貨物配裝表進行配裝。採用鋼瓶運輸時必須戴好鋼瓶上的安全帽。鋼瓶一般平放,並應將瓶口朝同一方向,不可交叉;高度不得超過車輛的防護欄板,並用三角木墊卡牢,防止滾動。運輸時運輸車輛應配備相應品種和數量的消防器材。裝運該物品的車輛排氣管必須配備阻火裝置,禁止使用易產生火花的機械設備和工具裝卸。嚴禁與氧化劑、鹼類、食用化學品等混裝混運。夏季應早晚運輸,防止日光曝曬。中途停留時應遠離火種、熱源。公路運輸時要按規定路線行駛,禁止在居民區和人口稠密區停留。鐵路運輸時要禁止溜放。




