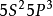氮族元素的定義
氮族(the Nitrogen group)是
元素周期表上的第VA族(IUPAC第15族),位於碳族和
氧族之間。氮族元素包括
氮(N、nitrogen)、
磷(P、phosphorus)、
砷(As、arsenic)、
銻(Sb、antimony)、
鉍(Bi、bismuth)。其中,氮和
磷是非金屬;
砷是準金屬;
銻,
鉍是金屬。
氮族元素的發現和存在
氮氣的發現是在研究空氣的組成過程中完成的。1772年,盧瑟福在論文中描述了一種不能維持生命,不能被石灰水吸收,不能燃燒的濁氣。與其同時,許多其他的化學家用不同的方法得到了氮氣。絕大部分氮以單質的形式存在,少量的氮以銨鹽,硝酸鹽的形式存在於土壤中。
17世紀,德國商人布蘭德將沙子木炭等混合蒸餾加熱,偶然得到了能在黑暗中發光的物質。這就是磷。自然界不存在單質磷,總是以磷酸鹽的形式存在。
砷和銻都是中國古代書籍就有記載的元素。曾經,砷被作為一種貴重藥物,又有毒性。砷主要以硫化物和氧化物的形式存在;銻曾在1753年被化學家弗拉明證明是一種元素。銻主要以硫化物礦的形式存在。
氮族元素的結構特點
氮族元素的價電子層結構是
,它們的p軌道都是半充滿狀態,因而與同周期的前後元素相比,有較高的電離能。由於惰性電子效應,氮族元素從上到下氧化數為3的化合物穩定性逐漸增加。氮族的最根本的特徵是其中所有元素的原子最外層都有5個電子——s亞層的2個電子和p亞層的3個未成對電子,因此它們在原子態時仍需3個電子才能充滿其最外層。
氮族元素的常見
氧化態有:-3、+3和+5。除此之外,磷還有-2和+1的氧化態,而氮的氧化態則從-3到+5都有。
除了氮以外,其他氮族元素都有空的d軌道可以參與成鍵,所以氮的最高配位數是4,其他元素最高的配位數是6。
氮族元素重要的單質和化合物
單質
氮氣常溫下是
氣體,其餘元素單質是
固體。氮氣是
空氣的重要組成部分,體積分數約為79%;白磷在空氣中會
自燃,有劇毒.(致死量0.1g,與
氰化鉀相同,但容易被忽視。)
氮的非金屬性很強,但氮氣的
氧化性卻不強,是因為氮氣分子中存在鍵能較高的N≡N
三鍵的緣故。
氫化物
氮族元素的
氫化物為
。除了
中H的氧化態為+1外,其他的氮族元素氫化物中H的氧化態都為-1(因為P、As的
電負性小於H)。
氮族元素氫化物溶於水時常常水合,不僅不像
氧族、
鹵素一樣形成
無氧酸溶液,反而生成弱鹼。但是在液態時由於
自偶電離亦可成為酸。
由於存在
孤對電子,氮族元素氫化物很容易因為X→H
配位鍵形成
離子,如
銨離子(
)、鏻離子(
)、鉮離子(
)。
學名
氨氣,是常見的鹼性氣體,在很多領域都有套用。比如其較高的汽化熱常用於製冷劑,
催化氧化反應間接製取硝酸等。
物理性質: 無色氣體。純時幾乎無味,但工業品有腐魚樣臭味。分子式H3-P。分子量34。相對密度 1.17。熔點 -133℃。沸點 -87.7℃。自燃點 100~150℃。蒸氣壓 20 atm(-3℃)。微溶於水(20℃時,能溶解 0.26 體積磷化氫)。
化學性質: 磷化氫是一個比氨還要弱的多鹼,它與識配的鹵化氫作用可生成鹵化磷,磷化氫是比氨還要強的還原劑,在空氣中容易燃燒,與氧發生爆炸反應.與空氣混合物爆炸下限 1.79%(26 g/m3)空氣中含痕量P2H4可自燃; 濃度達到一定程度時可發生爆炸。能與氧氣、鹵素髮生劇烈化合反應。通過灼熱金屬塊生成磷化物,放出氫氣。還能與銅、銀、金及他們的鹽類反應。 在約357°C下,磷化氫開始分解,生成磷和氫.磷化氫可與氯發生自發反應.
用途:可用於n-型半導體的摻雜劑,加加聚反應的引發劑,縮聚反應的催化劑,也可用於有機合成.
砷化氫
與
、
類似,砷能生成氫化物
,砷化氫或稱為胂,是一種無色、具有大蒜味的劇毒氣體。熔點(156.1K) 沸點(210.5K) 都很低,是共價型分子。
套用:醫學上鑑定砷的“馬氏試砷法”的根據。檢驗方法是用Zn、鹽酸和試樣混在一起,將生成的氣體導入熱玻璃管,若試樣中有砷的化合物存在,就會生成
,因生成的
在加熱部位分解產生As,As積集而成亮黑色的“砷鏡”(能檢出0.007mgAs)。“砷鏡”如果能用次氯酸鈉溶液洗滌而溶解,則證明是砷:砷鏡溶於NaClO,銻鏡則不溶。
氧化物
y氧化二氮俗稱
笑氣;NO、
是
硝酸工業的中間產物,屬於大氣的主要污染物,會導致
光化學反應;
(其實是
)是常用的效率高的酸性乾燥劑;
有劇毒,俗稱
砒霜。
氫氧化物
硝酸是國民工業“三大強酸”之一,是比較理想的氧化性酸和硝化劑;磷酸是
可樂的成分;硝酸鹽是常用氧化劑和氮肥;磷酸鹽是常用磷肥;K[Sb(OH)6]是實驗室中檢驗鈉離子的試劑;
亞硝酸鈉在食品工業中作為臘肉、香腸的增色劑,會致癌;高鉍酸鹽是強氧化劑。
有機物
含氮的
胺基酸是
蛋白質的組成部分,含氮、磷的
核苷酸是
核酸的組成部分,二者都是生物體所必需的元素,因此農業上常施氮肥和磷肥。
氮族元素其餘相關數據
性質 | 氮 | 磷 | 砷 | 銻 | 鉍 |
元素符號 | N | P | As | Sb | Bi |
原子序數 | 7 | 15 | 33 | 51 | 83 |
相對原子質量 | 14.01 | 30.97 | 74.92 | 121.8 | 220.90 |
常見氧化態 | -3,-2,-1,+1,+2,+3,+4,+5 | -3,+1,+3,+5 | -3,+3,+5 | +3,+5 | +3,+5 |
原子共價半徑/pm | 75 | 110 | 122 | 143 | 152 |
| 171 | 21 | 222 | 245 | |
| | | 69 | 92 | 108 |
| 11 | 34 | 47 | 62 | 74 |
第一電離能
kJ/mol
| 1402.3 | 1011.8 | 944 | 831.6 | 703.3 |
電負性 | 3.04 | 2.19 | 2.18 | 2.05 | 2.02 |
價電子層構型 | | | | | |