基本介紹
簡介,反應條件,酚酯結構,反應溫度,催化劑的選擇,反應機理,光佛利斯重排,陰離子佛利斯重排,
簡介
佛利斯重排反應由德國化學家 Karl Theophil Fries 首先報導。反應常用的路易斯酸催化劑有三氯化鋁、三氟化硼、氯化鋅、氯化鐵、四氯化鈦、四氯化錫和三氟甲磺酸鹽。也可以用氟化氫或甲磺酸等質子酸催化。鄰、對位產物的比例取決於原料酚酯的結構、反應條件和催化劑的種類等。一般來說,對位產物是動力學控制產物,鄰位產物是熱力學控制產物。反應在低溫(100°C 以下)下進行時主要生成對位產物,而在較高溫度時一般得到鄰位產物。可利用鄰、對位性質上的差異來分離這兩者。一般鄰位異構體可以生成分子內氫鍵,可隨水蒸氣蒸出。
反應條件
在反應中,催化劑的選擇及反應溫度對反應速度、收率、芳酮異構體的比例有很大影響。
酚酯結構
由Fries重排反應機理,醯基正離子作為親電試劑,與苯氧負離子發生親電取代,提高苯氧負離子的電子云密度有利反應的進行。因此酚酯上苯環帶有供電子基有利於重排反應,而吸電子基的存在使芳環鈍化,不利於Fries重排反應。當酚酯的芳環上帶有間位定位基(第二類定位基如—COOR、—NO2等)不能發生Fries重排,如硝基苯的酯。
反應溫度
反應溫度高低對反應產物影響很明顯,低溫有利於形成對位產物,高溫有利於形成鄰位產物,這是因為低溫時對位產物的生成速率比較大(動力學控制),而高溫時生成的鄰位產物能形成分子內的氫鍵,比對位穩定(熱力學控制)。
催化劑的選擇
Fries重排反應常用的催化劑是Lewis酸或Bronsted 酸,如 AlX3 (X=Cl、Br、I)、BF3 、TiCl4、FeCl3、ZnCl2、HF、H2 SO4 等。人們仍在廣泛使用這些催化劑催化 Fries 重排反應,但它們大多存在以下缺點:
(1)用量較大,通常按 1.1~3 倍摩爾比加入,且不能重複使用;
(2)自身有腐蝕性,操作處理有一定的危險性;
(3)選擇性差,副產物多,產品分離純化困難;
4)產生揮發性有毒氣體,污染環境。
人們開始改進和研發新型、環境友好、經濟適用的Fries重排反應催化劑,例如甲磺酸類、金屬-三氟甲磺酸鹽、雜多酸、沸石、離子液體等,已經取得了很好的催化效果。
反應機理
佛利斯重排的機理仍未完全清楚,可能有時為分子內的反應,而從交叉實驗結果來看可能有時又為分子間的反應。一個接受較廣的機理是圖1所示涉及碳正離子的機理:
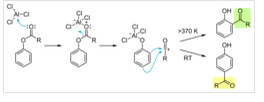
圖1 反應機理
該機理中,首先是酚酯的羰基氧與路易斯酸性的鋁原子進行配位。然後鋁基重排到酚氧上,C—O 鍵斷裂,產生酚基鋁化物和醯基正離子。醯基正離子接下來在苯環上酚基的鄰位或對位對其發生親電芳香取代,再經水解得到產物羥基芳酮。
光佛利斯重排
光佛利斯重排產率很低,很少用於合成。不過苯環上連有間位定位基時仍然可以進行光佛利斯重排。
該反應為自由基機理,首先是酚酯分子被光激發,激發態的酚酯在溶劑籠中均裂為一對酚基和醯基自由基,然後醯基自由基再從鄰位或對位與酚基自由基偶聯,並經互變異構得到產物羥基芳酮。酚是光佛利斯重排的常見產物,它是由酚基自由基從溶劑籠中脫離,並從其他分子中奪取氫原子生成的。
研究顯示光佛利斯重排是以聚對苯二甲酸乙二酯(PET)製成的塑膠瓶,在40°C 和波長為310nm的紫外光照射下發生降解的機理之一(這個條件類似於天氣炎熱時塑膠瓶的降解條件)。
此反應的套用是乙醇中的碳酸雙(對叔丁基苯)酯在光照射下的雙重排,產生雙(5-叔丁基-2-羥基苯基)甲酮。
陰離子佛利斯重排
指的是通過α—鹵代芳酯金屬化引發的佛利斯重排。
