功能特性
特性 端粒(Telomere)是
真核細胞 染色體 末端的特殊結構。人端粒是由6個鹼基重複序列(TTAGGG)和
結合蛋白 組成。端粒有重要的生物學功能,可穩定染色體的功能,防止染色體DNA降解、末端融合,保護染色體
結構基因 DNA ,調節正常細胞生長。
端粒酶 由於正常細胞線性DNA複製時5'末端消失,隨著
體細胞 不斷增殖,端粒逐漸縮短。當細胞端粒縮至一定程度,細胞停止分裂,處於靜止狀態。故有人稱端粒為正常細胞的“分裂鐘”(Mistosis clock),端粒長短和穩定性決定了細胞壽命,並與
細胞衰老 和癌變密切相關。
浙江大學 孔德華 博士介紹,端粒酶(Telomerase)是使端粒延伸的反轉錄DNA
合成酶 。是個由RNA和蛋白質組成的核糖核酸-蛋白複合物。其RNA組分為模板,蛋白組分具有
催化活性 ,以端粒5'末端為引物,合成端粒重複序列。
端粒酶的活性在真核細胞中可檢測到,其功能是合成染色體末端的端粒,使因每次細胞分裂而逐漸縮短的端粒長度得以補償,進而穩定端粒長度。主要特徵是用它自身攜帶的RNA作模板,以dNTP為原料,通過逆轉錄催化合成後延長鏈5‘端DNA片段或外加重複單位。端粒酶在細胞中的主要生物學功能,是通過其
逆轉錄 酶活性複製和延長端粒DNA來穩定染色體端粒DNA的長度。
近年有關端粒酶與腫瘤關係的研究進展表明,在腫瘤細胞中端粒酶還參與了對腫瘤細胞的凋亡和基因組穩定的調控過程。與端粒酶的多重生物學活性相對應,腫瘤細胞中也存在複雜的端粒酶
調控網路 。通過蛋白質-蛋白質相互作用在翻譯後水平對端粒酶活性及功能進行調控,則是目前研究端粒酶調控機制的熱點之一。
合成 端粒的存在是為了維持染色體的穩定。沒有端粒,則末端暴露,易被外切酶水解。而報導說端粒與生命長短有關,這只是個說法,還沒成定論。端粒不是用
DNA聚合酶 來合成的,是用端粒酶來合成的。端粒酶中含有RNA模板,用來合成端粒。
開發歷程
發現端粒 染色體末端的端粒
端粒是染色體末端的一段DNA片段。排線上上的DNA決定人體性狀,它們決定人頭髮的直與曲,眼睛的藍與黑,人的高與矮等等,甚至性格的暴躁和溫和。其實端粒也是DNA,只不過端粒是染色體頭部和尾部重複的DNA。把端粒當作一件絨線衫,袖口脫落的線段,絨線衫像是結構嚴密的DNA。細胞學家從來不對染色體棒尾巴拖出的DNA感興趣。他們把注意力聚集在46條染色的
基因圖 上面,而且把繪製的
人類基因組 草圖的事大聲喧譁。
人體衰老 1990年起Calvin Harley把端粒與人體衰老掛上了鉤。他講了三點,將它記錄如下:
端粒 第一 、細胞愈老,其端粒長度愈短;細胞愈年輕,端粒愈長,端粒與
細胞老化 有關係。衰老細胞中的一些端粒丟失了大部分端粒重複序列。當細胞端粒的功能受損時,出現衰老。而當端粒縮短至關鍵長度後,衰老加速,臨近死亡。
第二 、正常細胞端粒較短。細胞分裂會使端粒變短,分裂一次,縮短一點,就像磨損鐵桿一樣,如果磨損得只剩下一個殘根時,細胞就接近衰老。細胞分裂一次其端粒的DNA丟失約30-200bp(
鹼基對 ),鼠和人的一些細胞一般有大約10000bp。
第三 、研究發現,細胞中存在一種酶,它合成端粒。端粒的長短,是由酶決定的。細胞內酶多酶少可預測端粒的長短。正常人體細胞中檢測不到端粒酶。一些良性病變細胞,
體外培養 的成纖維細胞中也測不到端粒酶活性。但在
生殖細胞 睪丸、卵巢、胎盤及胎兒細胞中此酶為陽性。令人注目的發現是,
惡性腫瘤 細胞具有高活性的端粒酶,端粒酶陽性的腫瘤有卵巢癌、淋巴瘤、急性白血病、
乳腺癌 、結腸癌、肺癌等等。人類腫瘤中廣泛地存在著較高的端粒酶活性。這樣一來,我們又發現了一種腫瘤細胞的特異物質。
尋找衰老鐘 人體是由細胞組成的,人有衰老,細胞是否也有衰老呢?這就像一座大廈,它的壽命很大程度上與組成它的磚塊有關。細胞是有壽命的,這是細胞學家海弗列克(Hayflick)在四十年前發現的,他一代又一代地培養人體的成纖維細胞。但是在營養充分供給的情況下,細胞分裂到50代左右就停止活動了,真正地進入衰老期,這一發現似乎告訴人們在細胞內有一口衰老鐘,限定了細胞分裂的次數,也就限定了生物的壽命。因為高壽生物是由一個受精卵細胞分裂而形成的,它一分為二、二分為四、以此類推的增殖,組成胎兒,再分裂而成青年。如果細胞不能再分裂了,那么個體就出現衰老現象。
抗老之路 直至今日,還不敢講,科學家已經找準了衰老的真正起因,然而端粒功能的發現的確是為我們開拓了一條新的抗衰之路。端粒的縮短,引起衰老。如果端粒長度得不到維持,細胞停止分裂或者死亡。在某種情況下,瀕臨衰亡的細胞愈變成永生細胞,即癌細胞。
端粒酶的發現使正常細胞,衰老和癌化這些苦惱千年的難題有了一個符合邏輯的解釋。簡單地說,把端粒酶注入衰老細胞中,延長端粒長度,使細胞年輕化,這是可能的,科學家們對此寄託了厚望。將來醫生給老人注射類似端粒酶的製劑,延長老者的端粒長度,達到返老還童的目的。
有學者提出,端粒酶的抑制劑可作為治療癌症的藥物。因為只有在癌細胞中存在端粒酶,如果將該酶排光那么癌細胞似乎不會繁殖了。當然其中有不少需克服的困難。
當今衰老研究的新進展——端粒,那么到底用什麼方法能獲得延緩衰老的效果?
首先降低身體的新陳代謝速率,少吃少飲。如一盞油燈,火焰小,點得長,火焰大,點得短。這與Hayflick限度和端粒長度均有關聯。
代謝率 高,細胞分裂次數增多,端粒縮短,壽命也短了。
其次,用藥物刺激體內的幹細胞(一種保持潛能的細胞),彌補衰老損耗細胞。威斯康辛大學首創的生長激素注射法,對調動幹細胞,延緩老化是有一定作用的。還未見到生長激素與端粒關係的研究報告,但生長激素的抗老效果是比較肯定的。端粒酶抗衰老,目前只具理論價值。連動物實驗都很少。早在三十年代,遺傳學家Mullert發現染色體末端結構對保持染色體的穩定十分重要,並定名為(telonereTLM)。1978年Blackburn和Gall首先在
四膜蟲 中發現並證實了端粒結構,端粒是由端粒DNA和端粒蛋白質組成。他們發現這種rDNA每條鏈的末端均含有大量的重複片段,後來發現真核生物絕大多數DNA末端都是由特定的基本序列單元即端粒序列大量重複而構成的。對於一個給定的真核生物物種,它一定具有特徵性的
端粒DNA序列 。
特殊結構 端粒是
染色體 末端的一種特殊結構,它是由許多簡單短重複序列和端粒結合蛋白(Telomere end-binding protein, TEBP)組成。在正常人體細胞中,可隨著
細胞分裂 而逐漸縮短。
端粒是細胞必需的遺傳組分,因為它能夠保護和補償染色體末端遺傳信息的丟失,保護它不會被
核酸酶 識別而免遭降解。但是在複製過程中,端粒也因為複製機制的缺欠或者其他原因會緩慢地丟失,在新細胞中細胞每分裂一次,染色體頂端的端粒就縮短一次(細胞分裂一次其端粒的DNA丟失約30-200bp),當端粒不能再縮短時,細胞就無法繼續分裂了。
進一步的研究表明,衰老細胞中的一些端粒丟失了大部分端粒重複序列。1990年,凱文·哈里(Calvin Harley)發現不同年齡的人的
體細胞 的壽命明顯不同,其端粒的長度也不相同。是隨著年齡的增長而縮短。細胞愈老,其端粒長度愈短;細胞愈年輕,端粒愈長。端粒與細胞老化有關係,因此原因用端粒闡述了新的人體衰老機制。
另外,端粒的丟失還與很多病因有關。Maria Blasco and PieroAnversa的研究,探討了端粒在一些心血管病理狀態中,端粒功能失調的影響。Maria Blasco and Piero Anversa構建了在第二代G2和第5代G5端粒RNA缺失的轉基因小鼠(Terc-/-)。研究者對G5(Terc-/-)小鼠的心肌細胞進行原位定量螢光雜交分析,發現這些細胞具有比G2(Terc-/-)小鼠更短的端粒,G2(Terc-/-)小鼠心肌細胞的端粒也比野生型細胞的端粒要短。
在1996年3月15日的《歐洲分子生物學組織雜誌》上,
達拉斯 UT西南醫學中心,Shay博士和Wright博士報導了,通過控制端粒長度而改變人類細胞壽命的研究結果。他們發現通過增加端粒長度,能夠延長
細胞雜交 系的壽命。但是,要提的是,端粒的減少是否導致
動脈粥樣硬化 這個問題也待進一步的研究.
催化酶 研究發現,細胞中存在一種酶,它合成端粒。端粒的複製不能由經典的DNA聚合酶催化進行,而是由一種特殊的逆轉錄酶——端粒酶完成。端粒酶是以RNA 為模板合成DNA 的酶端粒酶是一種核糖核蛋白,由RNA 和蛋白質構成。其RNA 組分是端粒序列合成的模板。不同生物的端粒酶,其RNA 模板不同,其合成的端粒序列也不同。對端粒酶的RNA 進行誘變; 可在體內合成出與突變RNA 序列相對應的新端粒序列,證明了RNA 的模板功能。端粒酶合成端粒的DNA片段TTAGGG,其
基因定位 於人類染色體的3q.26.3上,正常人體細胞中檢測不到端粒酶。一些良性病變細胞,體外培養的成纖維細胞中也測不到端粒酶活性。但在生殖細胞、睪丸、卵巢、胎盤及胎兒細胞中此酶為陽性,研究表明這也是科學家由此又開始研究精子和癌細胞內的染色體端粒是如何長時間不被縮短的原因。
染色體末端的端粒 注意 值得注意的是,惡性腫瘤細胞具有高活性的端粒酶(它能維持癌細胞端粒的長度,使其無限制擴增。關於癌細胞如何獲得永生,1991年Harley提出端粒-端粒酶假說,認為正常細胞衰亡要經過第一致死期M1期(MortalityStage1)和第二期M2期(MortalityStage2)兩個階段。即在
細胞有絲分裂 的過程中端粒DNA不斷丟失而使端粒縮短,當端粒縮短到一定長度(2kb-4kb)時,染色體的穩定性遭到破壞,細胞出現衰老的表現,細胞進入第一致死期M1期。此時細胞不再分裂,而是退出細胞周期而老化並死亡。如果此時細胞已被病毒轉染(SV40, HPV),癌基因激活或抑癌基因(P53, Rb)失活,細胞便可越過M1期,繼續分裂20-30次,端粒繼續短縮,最終進入第二致死期M2期。多數細胞由於端粒太短而失去功能並死亡,只有少數細胞的端粒細胞的端粒酶被激活,修復和維持端粒的長度,使細胞逃避M2期,而獲得永生。),這也是當代科研領域的熱門研究話題。1995年Hiyama等人[8]在對100例成纖維神經細胞瘤的研究中證實,有端粒酶活性表達的腫瘤組織占94%,端粒酶活性越高的組織越容易伴有其它遺傳學變化,並且預後不良;而低端粒酶活性的腫瘤組織中未見有相應的變化且都預後良好,甚至有3處於IVS階段的無端粒酶活性的病例竟出現了腫瘤消退的現象。這似乎說明端粒酶同癌症之間存在著相關性,但是否因果關係,還很難定論。
端粒DNA 端粒DNA,包括非特異性DNA和由
高度重複序列 組成的特異DNA序列,通常是由富含
鳥嘌呤核苷酸 (G)的短的
串聯重複序列 組成,伸展到染色體的3'端。人工合成四膜蟲端粒的重複DNA片段(TTGGGG)4端。人和小鼠的端粒DNA重序列為TTGGG,人類端粒的長度約為15Kb鹼基。由於dsDNA存在末端複製問題,故細胞每分裂一次,約丟失一個崗崎片斷長度的DNA,即25-100對鹼基。
端粒酶將自身RNA模板合成的DNA重複序列加在後隨鏈親鏈的3’端,然後再以延長了的親鏈為模板,由DNA聚合酶合成子鏈。但是由於複製機制的不完整性(或者這不完整性是進化保留的,由此機制來保證細胞的定期衰老和死亡。),端粒還是以一定的速度丟失。
端粒酶是一種
核蛋白 (RNP),主要由RNA和蛋白質組成。端粒酶是端粒複製所必須的一種特殊的DNA聚合酶。目前不少生物的端粒酶RNA已被
克隆 ,但不同種屬之間的
核苷酸 序列差別很大。
四膜蟲的端粒酶RNA模式板長160-200個核苷酸,編碼1.5拷貝的端粒重複序列。其43-51位序列為CAACCCCAA,剛好編碼一個GGGGTT。
鼠同人的端粒酶RNA基因有65%的相同,模板為8-9個核苷酸序列,人的端粒酶RNA(hTR)由450個核苷酸組成。模板區為CUAACCCUAAC(5’-3’向 Shippen-Lentz(1990年)克隆了游仆蟲屬的端粒酶RNA序列,其中包括5’-CAAAACCCCAAA-3’模板序列。該模板亦與基端粒重複序列(TTTTGGGG)n以鹼基互補方式合成RNA序列。
研究還認為,端粒酶RNA中的模板每次與1.5(TTTTGGGG)重複序列互補,然後通過模板的滑動,再進行下一次合成。
結合蛋白質 在端粒結合蛋白質方面,早在1986年,Gottschling等即已鑑定了尖毛蟲屬(Oxytricha)的
相對分子質量 為55000和26000的端粒結合蛋白質,該蛋白質特異識別和結合尖毛蟲屬的大核白質RAP1(repressor activator protein1)是參與端粒長度調節的一個必需因子,一個RAP1分子平均與18個端粒DNA序列結合,負反饋調節端粒長度。
在克隆鑑定了酵母等的端粒酶蛋白質部分的催化亞基的編碼基因後,人端粒酶蛋白質部分的催化亞基編碼基因也已經被克隆鑑定,命名為hTERT(human Telomerase Reverse Transcriptase)基因。該基因含有一個端粒酶特異基序(Telomerase-specific motif),翻譯48個
胺基酸 的蛋白質序列。hTR和hTERT基因的對照表達研究顯示,hTR基因可在增殖力強制胎兒細胞——非永生化的(mortal)細胞中表達,而hTERT基因僅在腫瘤細胞——永生化的(Immortal)細胞中表達。因此,hTERT基因更顯示出腫瘤特異的診斷和治療潛在套用價值。
另外,人乳頭狀病毒(HPV)能引發人的
子宮頸癌 。HPV病毒基因組中的
癌基因 E6,在
腫瘤發生 中起要作用,它是第一個被發現可以激活端粒酶的癌基因。該基因的表達產物,能在轉錄後水平調節
MYC 的表達,隨後再由MYC激活端粒酶。最近又發現人體內的雌激素(Estrogen),能與TERT基因啟動子區-2677位的一個不完全
迴文結構 結合,直接調節TERT基因活性。另外雌二醇也可通過激活myc基因的表達,間接促進TERT基因的表達,提高端粒酶的活性。
功效
長生不老 美國德克薩斯大學西南醫學中心的細胞生物學及
神經系統科學 教授傑里·謝伊和伍德林·賴特做了這樣一項試驗:在採集的包皮細胞(包皮環切術的附帶產物)中導入某種
基因 ,該基因可使細胞產生一種酶——端粒酶(Telomerase)。
端粒酶 一般來說,包皮細胞在變老之前可分裂60次左右。但在上述試驗中,細胞已分裂了300多次卻毫無終止的徵兆,也沒有顯示任何異常的跡象。“細胞在端粒酶的作用下,就像被注入了興奮劑的小兔子,”謝伊說,“它們只管沒完沒了地分裂繁殖。”
與此同時,謝伊和賴特的合作夥伴——美國傑龍(Geron)公司的研究人員,採用人體視網膜細胞做了相同的試驗。結果,這些細胞似乎也變得長生不老了。
誘人的希望 研究人員由此看到了誘人的希望,但他們卻不知道,這種控制
細胞衰老 過程的方法,最終是否能同樣有效地延緩人體的衰老。因此,迄今尚無人提議在大家的日常飲食中添加端粒酶。實際上,這種酶也有令人憂慮之處:人們發現它也存在於85%的腫瘤之中,可能是造成癌細胞無節制增生的元兇。儘管如此,只要研究人員充分認識其作用原理,就完全可能開發出既可防止衰老,又能制服癌症的新技術。21世紀初人類開始的
生命方舟計畫 對於細胞衰老過程的研究取得了突破性的進展,這讓人們似乎看到了治癒癌症的曙光。
國內研究
人類衰老 中國醫學專家
童坦君 、張宗玉兩位教授經過10多年的研究,破解了人類衰老之謎,得出了人類衰老細胞
基因調控 能力減退與特異
轉錄因子 相關的結論。
童坦君、張宗玉夫婦是
北京大學 醫學部生物化學與分子生物學系教授。他們對人類衰老的研究始於20世紀80年代,並接受了國家自然科學基金重點項目———衰老分子機理與生物學年齡指征的研究。
端粒酶測定 今年3月,在全國人大常委會副委員長、北京大學副校長、北大醫學部主任
韓啟德 的倡導和支持下,童坦君、張宗玉夫婦成立了國內首家衰老研究中心。
據童坦君介紹,人類衰老的機理極其複雜,其學說不下幾十種,如
免疫學說 、
神經內分泌 學說、
自由基 學說、
蛋白質合成 差錯累積學說等。近年從分子與基因水平上提出的基因調控學說、
DNA損傷修復 學說、
線粒體 損傷學說以及端區假說已成為國際研究熱點,這也是童坦君、張宗玉夫婦在人類衰老機理方面研究的成果。
在衰老中心簡陋的辦公室內,兩位老人接受了記者的專訪,他們用通俗的語言解釋了人類為什麼會衰老?衰老機理如何?
童坦君首先介紹了一個專業名詞——
端粒 (又稱端區),它是細胞
染色體 末端的一種用顯微鏡可以見到的呈條狀的物質。端粒有長短,隨年齡增加而越來越短,端粒的消失,會使染色體發生畸變,從而使人類細胞喪失複製能力,最終導致
細胞衰老 。
專家觀點 童坦君說,端粒中還存在一種端粒酶,它具有調控端粒長短的能力,其活性也隨年齡大小而不同,年輕時,活性大,較容易延長端粒,這是年輕人不易顯老的原因。此外,男性端粒長度縮短略快於女性,這也是男性平均壽命低於女性的原因。
張宗玉說,端粒酶的特性讓人們看到了
長生不老 的曙光。根據端區學說的原理,可否將人類體細胞引入端粒酶使細胞不斷生長,從而達到青春常駐,這是人類未來研究的方向。
假說研究 解決端粒酶問題人就可以長生嗎
衰老機制(連結)首先要明確的問題就是人為什麼會死亡,只有對這個過程的機制了解的足夠透徹,做到永生並非不可能。關於人衰老和死亡的機制,比如體內
自由基 清除與生成機制失衡,導致有害自由基日積月累,並進而破壞細胞器,線粒體已被證實參與了這一過程。
端粒酶 端粒酶也是其中一種解釋。由於正常人細胞沒有端粒酶,無法修復DNA複製所造成的DNA縮短的問題,因此隨著細胞複製次數的增多,DNA短到一定程度,可能就觸發了死亡機制,或者死亡是一個漸近的過程。
關於細胞衰老分子機制的主流假說
其中一個就是端粒酶。但是98年就證明了二倍體敘利亞倉鼠
胚細胞 在複製分裂的各階段始終表達端粒酶,但是仍然衰老。而剔除端粒酶基因的小鼠尚未觀測到相應的表型的變化。所以端粒鐘學說並不完全正確。
2. R DNA。染色體複製時可能出現錯配膨起染色體外RDNA環,叫ERC。它的積累導致
細胞衰老 ,並伴隨核仁的裂解。
4. SGS1基因和WRN基因。這是兩個同源的基因,對於保證細胞正常生命周期是必須的,但是容易突變導致早老症。
5. 發育程式。
6. 線粒體DNA。隨著時間的推移,線粒體DNA的突變是相當顯著的。
7. 生命是最最神奇的魔法。細胞里的行動是複雜而精確的,往往是外來刺激導致
蛋白質磷酸化 ,一級一級地傳遞,激活一定基因,開始轉錄翻譯出平時不存在的蛋白質,這蛋白質再引起接下來的一系列
級聯反應 。要推翻自然的規律,解決一個酶的問題,無異於杯水車薪。
可是即使假設人體具有了端粒酶,長生也是個值得打上問號的問題。因為端粒酶僅僅解決了複製長度的問題,並不能解決DNA複製時的變異問題,當然這有專門的機構來負責。可是這也說明,長生並非如想像中那么簡單,不單單一個端粒酶就能解決。
最新研究 美國科學家近日發現了一種功能極似端粒酶的蛋白質,它能四處運送至關重要的蛋白質塊來修復在正常複製中被丟失的染色體末端。如果沒有這樣的日常維護,
幹細胞 將很快停止分裂,胚胎也將無法發育。這是10年來首次發現端粒酶的新蛋白組分,這也許將成為抗癌療法的一個有價值靶標。該項研究成果刊登在1月30日出版的《科學》雜誌上。
端粒酶可在成體幹細胞、免疫細胞和正在發育的胚胎細胞中正常表達。在這些細胞中,端粒酶附著在新複製的染色體末端,從而使細胞的分裂不受約束。如果沒有端粒酶,細胞將停止分裂,或在有限數目的分裂後死亡。不幸的是,這種酶在許多癌細胞中也很活躍。研究人員發現,阻止這種稱為TCAB1蛋白的不恰當表達,也許能限制端粒酶到達其DNA靶標(端粒),並限制細胞的壽命。
研究人員表示,目前還沒有有效的端粒酶抑制劑。多年來,端粒酶一直是研究熱點,但科學家們困擾於其大尺寸和極其少量。成人體內的少數細胞可製作出這種巨型蛋白複合物,但製作量非常之少,因此只有端粒酶的部分成分已被確定。研究人員稱,要找出端粒酶的所有蛋白成分是一項難以置信的巨大挑戰,端粒酶中的未知成分甚至被稱為“暗物質”。
美國史丹福大學醫學院的研究人員使用高靈敏的蛋白鑑別技術(質譜),找到了端粒酶中TCAB1的存在。去年年初,研究人員曾利用相同的技術首次確定了另兩種蛋白pontin和reptin,這兩種蛋白對端粒酶這種巨型複合物的形成非常重要。此次,研究人員則確定了TCAB1蛋白具有以前未知的功能。
與pontin和reptin不同的是,TCAB1是端粒酶的一個真正組成部分。但它對酶的活性來說並不是必需的,它只是給稱為卡哈爾體(Cajalbodies)的細胞核中的處理和保持區域補充端粒酶複合物。卡哈爾體將對各種使用RNA小分子來引領其活性的蛋白進行修飾,譬如,端粒酶使用RNA分子作為嵌在染色體末端的DNA鏈的模板。在適當的時候,TCAB1將端粒酶複合物運送到新複製染色體的等待端。
研究人員表示,TCAB1對端粒酶完成從卡哈爾體到端粒的跳躍是絕對必需的。一旦抑制其在人類癌細胞中的活性,端粒就會變短,這也意味著癌細胞會更快地死亡。研究人員認為,TCAB1蛋白可能是一種負責將各種分子運往其目的地的普通生物運輸器。下一步,研究人員將繼續對TCAB1進行研究,並尋找端粒酶的其他組成部分。
結直腸腫瘤 端粒酶的活性與結
直腸腫瘤 的發生及其機制,結直腸腫瘤細胞分裂較快,端粒酶的活性就高;而細胞分裂較慢的腫瘤組織,端粒酶的活性就低。正常人體記憶體在著
抑制細胞 無限增殖的複雜機制:一是細胞周期性控制;二是隨著每次細胞分裂而發生端粒進行性縮短所引起的
細胞凋亡 或程式性死亡。端粒酶活性的強弱與結直腸腫瘤細胞在積液中的生存時間呈正相關。端粒酶的活性是結直腸癌的早期診斷、預後判斷的重要指標。從大便脫落細胞中檢測端粒酶活性可作為結直腸癌的一種無創的早期診斷方法。邢台市第四醫院通過
聚合酶 鏈端粒重複擴增(PCR TRAP)
銀染 技術可檢測端粒酶活性。
 端粒酶
端粒酶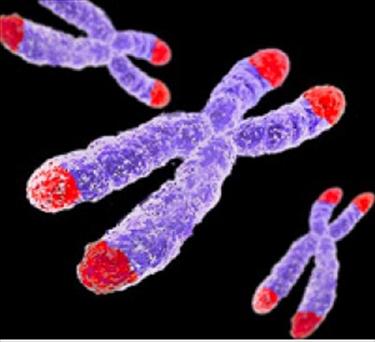 端粒
端粒 染色體末端的端粒
染色體末端的端粒 端粒酶
端粒酶 端粒酶測定
端粒酶測定 端粒酶
端粒酶
