亞類 在生物化學中,PKC家族由15種人類的同工酶組成。根據其第二信使,它們被分為三個亞家族:傳統型(或經型)、新型和非典型。傳統型(c)PKCs含有α、βI、βII和γ亞型。它們需要Ca2+、DAG和磷脂例如磷脂醯絲氨酸來激活。新型(n)PKCs包括δ、ε、η和θ亞型,需要DAG,但不需要Ca2+激活。因此,傳統型和新型PKCs通過與磷脂酶C相同的信號轉導途徑被激活。另一方面,非典型(a)PKCs(包括蛋白激酶Mζ和ι/λ亞型)既不需要Ca2+也不需要二醯甘油來激活。蛋白激酶C通常指整個亞型家族。在有頜脊椎動物中發現的不同種類的PKC源自5個祖先PKC家族成員(PKN、aPKC、cPKC、nPKCE、nPKCD),這些家族成員由於基因組複製而擴大。更廣泛的PKC家族是古老的,可以在真菌中找到,這意味著PKC家族存在於後鞭毛生物(opisthokonts.)的最後一個共同祖先中。
結構 PKC的所有亞類都由一條單
肽鏈 組成(
圖8 -11),分子量大約為67-83kDa,其結構可分為四個保守區C1-C4(mPKC和aPKC缺少C2區)和五個
可變區 V1-V5。基中C1區可能是膜結合區,並且含有富含
半胱氨酸 的隨機
重複序列 Cys-X2-Cys-X13(14)-Cys-X2-Cys-X7-Cys-X7-Cys(X代表任何一種
胺基酸 ),這段順序與在許多金屬-
蛋白質 及轉錄調節有關的
DNA結合蛋白 中的半胱氨酸-鋅-
DNA 結合指形區(cysteine-Zinc-DNabinding finger)保守順序Cys-X2-Cys-X13-Cys-X2-Cys相似。對PKC的多肽片段進行分析發現,該序列與佛波酯和
二醯基甘油 (DAG)的結合有關。C2區與PKC對Ca2+的
敏感性 有關。C1和C2在結構上不同於其它蛋白激酶,能結合Ca2+、磷脂、DAG和TPA,因此C1和C2區又稱為調節區。C3區包括一個
ATP 結合序列
Gly -X-Gly-X-X-Gly-
Lys ,該區域與其它蛋白激酶的ATP
結合位點 具有很高的
同源性 ,又稱催化區。C4區包含一個底物結合區,是識別磷酸化底物所必需的。
已發現了至少11種亞型,其結構有一定的
保守性 而又有所差別,導致其功能和調控的多樣性。
新合成 的PKC一般需要經歷活化莖環(
Activation -loop,A-loop)、轉角模體(Turn motif,TM)以及疏水模體(hydrophobic motif,HM)的程式性磷酸化過程才能成熟,獲得進一步活化的功能。催化區在不同亞型中高度保守,且較小程度地在其他絲氨酸/蘇氨酸激酶的催化區中也高度保守。異構體中的第二信使需求差異是調控結構域的結果,這些區域在類內相似,但在類之間不同。除了PKC-θ和PKC-ι外,PKC催化區的大部分晶體結構尚未確定。但由於其與已確定晶體結構的其他激酶相似,因此可以很好地預測其結構。
蛋白激酶C
轉位與激活
轉位 PKC廣泛分布於多種組織、器官和細胞,
靜止細胞 中PKC主要存在於
胞漿 中,當細胞受到刺激後,PKC以Ca2+依賴的形式從胞漿中移位到
細胞膜 上,此過程稱之為轉位(translocation)。一般將PKC的轉位作為PKC激活的標誌。
調控 PKC的調控結構域或氨基末端包含幾個共享的亞區。C1結構域存在於PKC的所有亞型中,具有DAG以及稱為佛波酯(phorbol esters)的不可水解的非生理性類似物的結合位點。該結構域是功能性的,在傳統型和新型PKC中都能與DAG結合,然而,非典型PKC中的C1結構域不能結合DAG或佛波酯。C2結構域充當Ca2+感測器,存在於傳統型和新型中,但僅在傳統型中起Ca2+感測器的作用。假底物區存在於所有三類PKC中,是一個小的胺基酸序列,模擬底物並結合催化域中的底物結合位點,缺少關鍵的絲氨酸、蘇氨酸磷酸受體殘基,保持酶的活性。當Ca2+和DAG以足夠的濃度存在時,它們分別與C2和C1結構域結合,並將PKC招募到膜上。這種與膜的相互作用導致假底物從催化位點釋放並激活酶。然而,為了使這些變構相互作用發生,PKC必須首先被恰當地摺疊,並且處於允許催化作用的正確構象。這取決於催化區域的磷酸化。
激活 PKC的活性依賴於
鈣離子 和
磷脂 的存在,但只有在
磷脂代謝 中間產物 二醯基甘油 (
DAG )存在下,生理濃度的鈣離子才起作用,這是由於DAG能增加PKC對底物親和力的緣故。
磷脂醯肌醇 -4,5-二磷酸(PIP2)在
磷脂酶 -C作用下水解生成DAG和
IP3 。IP3促進細胞內鈣離子的釋放,在激活PKC過程中與DAG起
協同作用 。
乙酸 豆塞外
佛波酯 (12-o-tertradecanoylphordol-13-acetate,
TPA ;或phorbol-12-myristate-13-acetate,PMA)是一種促
腫瘤 劑,由於基結構與DAG相似,可在很低濃度下模擬DAG,活化PKC,使PKC親和力增至10-7M。PKC是TPA的受體,當TPA插入細胞膜後可以替代DAG而直接活化PKC。當過高劑量TPA處理細胞可使
靶細胞 中PKC迅速耗竭,反而影響細胞的
信號傳遞 。
多種化學物持或抗生素對PKC活性具有
抑制作用 ,根據
抑制劑 作用PKC
靶部位 的不同可以將抑制劑分為二組:一組是作用於催化區的抑制劑,它們可與
蛋白激酶 的保守
殘基 結合,因此對PKC無明顯的選擇性;另一組是作用於
調節區 的抑制劑,它們可與Ca2+、磷脂和二醯基甘油/佛波酯相結合,因而有較高的選擇性 。
激活後,PKC通過RACK蛋白(活化PKC的膜結合受體)轉移至質膜。PKC因其長期激活而聞名:它們在原始激活信號或Ca2+波消失後仍保持激活。據推測,這是通過磷脂酶從磷脂醯肌醇生產DAG來實現的;脂肪酸也可能在長期激活中發揮作用。PKC激活的關鍵部分是向細胞膜的易位。有趣的是,這一過程在微重力環境中會被破壞,從而導致太空人免疫缺陷。
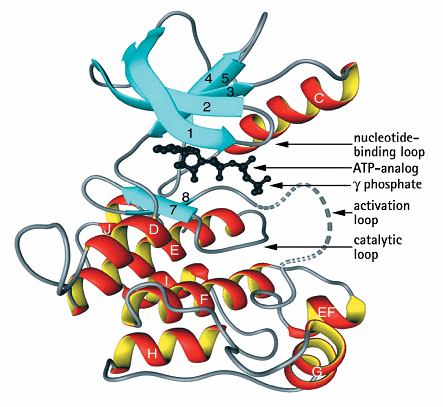
催化 PKC的催化區或激酶核心能夠執行不同的功能。PKB(也稱為Akt)和PKC含有約40%的胺基酸序列相似性,這種相似性在PKC之間增加到約70%,在類內進行比較時甚至更高。例如,ζ和ι/λ這兩種非典型PKC亞型的同源性為84%。在已揭示晶體結構的30多個蛋白激酶結構中,所有結構都具有相同的基本結構,即雙葉結構(bilobalstructure),具有由N端葉組成的β摺疊和由C端葉構成的α螺旋。ATP結合蛋白(ATP)和底物結合位點都位於這兩個末端葉形成的縫隙中。這也是調節區的假底物結構域結合的地方。
PKC催化區的另一個對激酶活性至關重要的特徵是其磷酸化。傳統型和新型PKC有三個磷酸化位點,稱為:激活環、轉向基序和疏水基序(the activationloop, the turn motif, and the hydrophobic motif)。非典型PKCs僅在激活環和轉向基序上磷酸化。由於帶負電荷而與磷酸化胺基酸殘基具有相似作用效果的谷氨酸代替了絲氨酸,疏水基序的磷酸化變得不必要。這些磷酸化過程對酶的活性至關重要,3-磷酸腺苷依賴性蛋白激酶-1(PDPK1)是上游激酶,負責通過激活環的轉磷酸化啟動該過程。
PKC的共有序列與PKA相似,因為它含有類似Ser/Thr等要被磷酸化的的鹼性胺基酸。它們的有MARCKS蛋白、MAP激酶、轉錄因子抑制劑IκB、維生素D3受體VDR、Raf激酶、鈣蛋白酶和表皮生長因子受體等。
作用 蛋白激酶C是一種
細胞質 酶,在未受刺激的細胞中,PKC主要分布在細胞質中, 呈非
活性構象 。一旦有
第二信使 的存在,PKC將成為膜結合的酶,它能激活細胞質中的酶,參與生化反應的調控, 同時也能作用於
細胞核 中的
轉錄因子 , 參與
基因表達 的調控, 是一種多功能的酶。 比較常見的有PKC參與受體脫敏、調節膜結構、調節轉錄、介導免疫應答、調節細胞生長以及學習和記憶等。這些功能是通過PKC介導的其他蛋白質的磷酸化來實現的。PKC通過CARD-CC家族蛋白的磷酸化和隨後的NF-κB活化在免疫系統中發揮重要作用。然而,由於不同種類的細胞之間的蛋白表達不同,磷酸化的底物蛋白不同,因此,PKC的作用是細胞類型特異性的。
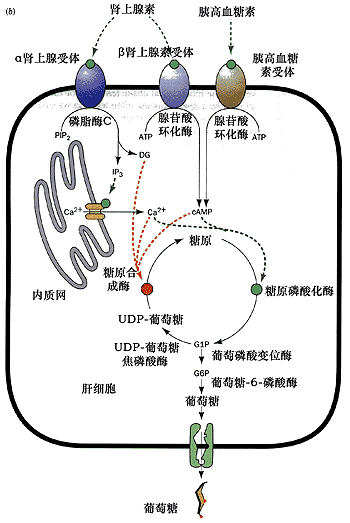
cAMP 介導的促進
糖原分解 、抑制
糖原 合成作用是由
胰高血糖素 受體和β
腎上腺素 受體結合了相應激素所引起;而IP3、DAG和Ca2+介導的促進糖原分解和抑制糖原合成的是由α
腎上腺 受體結合腎上腺素所引起。cAMP激活蛋白激酶A,而IP3、DAG和Ca2+ 激活蛋白激酶C.
肌細胞 生成素是一種轉錄因子,在肌細胞分化中起關鍵作用。在
成肌細胞 (myoblast)中, 蛋白激酶C可使肌細胞生成素磷酸化,抑制了肌細胞生成素與DNA結合的能力,因而阻止了
細胞分化 為
肌纖維 。
蛋白激酶C至少可通過兩種途徑參與
基因表達 的控制。一種途徑是蛋白激酶激活一個磷酸化的
級聯繫統 ,使MAP蛋白激酶磷酸化,磷酸化的MAP蛋白激酶將基因調節蛋白Elk-1磷酸化,使之激活。激活了Elk-1與一個短的
DNA序列 (稱為血清反應元件,SRE)結合,然後與另一個因子(血清反應因子,SRF)共同調節基因表達。另一種途徑是蛋白激酶磷酸化並激活抑制蛋白Iκ-B,釋放基因調節蛋白NF-κ-B,使之進入細胞核激活特定基因的轉錄。
小腦 長時程抑制 LTD是由於PKC激活間接或直接引起
AMPA受體 的磷酸化,使AMPA受體轉化為穩定的失敏狀態或使受體發生內化,結果導致LTD
此外
有人認為PKC能夠催化未被其他激酶催化的蛋白,如催化與分泌和增殖有關的蛋白磷酸化。還可以活化Na+-K+
交換系統 、使細胞內H+減少、提高細胞質中的pH,還可以提高Na+/K+泵的運轉等。 蛋白激酶C在細胞的生長、分化、
細胞代謝 以及
轉錄激活 等方面具有非常重要的作用 。PKC的活性下降與腫瘤也有密切關係。
病理學 由腫瘤啟動子佛波酯激活的PKC可能會磷酸化有效的轉錄激活劑,從而導致癌基因表達增加,加速癌症發展或干擾其他現象。然而,長時間暴露於佛波酯會導致PKC的下調。功能缺失突變和低PKC蛋白水平在癌症中普遍存在,表明PKC的腫瘤抑制作用。
蛋白激酶C酶是血管通透性的重要介質,並與各種血管疾病有關,包括糖尿病等相關疾病,以及與吸菸相關的內皮損傷和組織損傷。低水平PKC活性能通過磷脂醯肌醇3-激酶/AKT信號逆轉細胞手性,並改變具有相反手性的細胞之間的連線蛋白組織,導致內皮通透性發生意外的性質變化,從而可能導致炎症和疾病。
抑制劑 PKC抑制劑,如盧布司他林(ruboxistaurin),可能對周圍型糖尿病腎性病有益。天然存在的PKC抑制劑有車紅素、米雅酚C、肉豆蔻醇、棉酚等。其他PKC抑制劑還包括:Verascoside、BIM-1、Ro31-8220、苔蘚抑素1(Bryostatin 1)、他莫昔芬(Tamoxifen)等,其中有些已進行了抗腫瘤相關的研究。
激活劑
蛋白激酶C激活劑丁烯酸酯(ingenol mebutate)來源於南歐大戟Euphorbia peplus ,已被批准用於光化性角化病的治療。除了抑制劑外,苔蘚抑素也可以作為PKCe激活劑,正在研究對阿爾茨海默病的作用。12-O-十四烷醯佛波醇-13-乙酸酯(PMA或TPA)是一種可以激活傳統型PKC的二醯基甘油模擬物,它通常與離子黴素一起使用,離子黴素提供激活某些PKC所需的鈣依賴性信號。