基本介紹
在無機分析中,很少利用金屬
水合離子本身的顏色進行
光度分析,因為它們的吸光
係數值都很小。一般都是選適當的試劑,將待測離子轉化為有色化合物,再進行測定。這種將試樣中被測組分轉變成有色化合物的
化學反應,叫顯色反應。顯色反應有氧化還原反應和配位反應。而配位反應最主要,對於顯色反應,一般應滿足下列標準。
 顯色反應
顯色反應一般標準
⑴選擇性好。一種
顯色劑最好只與被測組分起顯色反應。干擾少,或干擾容易消除。
⑵靈敏度高。
分光光度法一般用於微量組分的測定,故一般選擇生成有色化合物的、吸光度高的顯色反應。但靈敏度高后,反應不一定選擇性好。故應全面加以考慮。對於高含量組分的測定,不一定選用最靈敏的顯色反應。(應考慮選擇性)
⑶有色化合物的組成要恆定。
化學性質穩定,對於形成不同配位比的配位反應,必須注意控制試驗條件,使生成一定組成的
配合物,以免引起誤差。
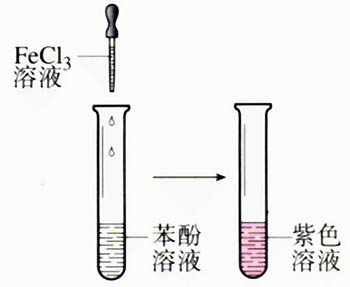 顯色反應
顯色反應⑷有色化合物與
顯色劑之間的顏色差別要大。這樣顯色時的顏色變化鮮明,而且在這種情況下,
試劑空白一般較小。一般要求有色化合物的最大吸收波長與顯色劑最大吸收波長之差在60nm以上。
R為顯色劑,MR為有色化合物。
⑸顯色反應的條件要易於控制。如果要求過於嚴格,難以控制,測定結果的
再現性差。
相關反應
多元配合物
多元
配合物是由三種或三種以上的
組分形成的配合物。目前套用較多的是由一種金屬離子與兩種
配位體所組成的配合物。一般稱為“三元配合物”。
金屬離子
條件控制
顯色反應能否滿足光度法的要求,除了主要與
顯色劑的性質有關係外,控制好顯色反應的條件也是十分重要的。顯色條件包括
顯色劑用量、
酸度、
顯色溫度、
顯色時間及
干擾的消除。
試劑用量
M(被測組分)+R(
顯色劑)= MR(有色化合物)
為了使顯色反應儘可能進行完全,加入適當過量的顯色劑是必要的。但也不能過量太多,否則會引起
副反應,對測定反而不利。在實際工作中,顯色劑的適宜用量是通過實驗求得的。固定被測組分的濃度和其它條件,分別加入不同量的顯色劑,測量
吸光度,做吸光度 – 顯色劑用量曲線。
溶液酸度
大部分高價金屬離子都易
水解,顯然,金屬離子的水解,對於顯色反應的進行是不利的,故溶液的酸度不能太低。
顯色劑多是有機弱酸,溶液的酸度影響著顯色劑的
離解,並影響顯色反應的完全程度。此外,許多顯色劑本身就是
酸鹼指示劑,溶液的酸度對顯色劑本身的顏色會產生改變。
溶液的酸度對有色配合物的組成及穩定性也有影響。因此,某一顯色反應最適宜的酸度可通過實驗來確定。固定待測組分及顯色劑濃度,改變溶液pH,測定其
吸光度,做吸光度-pH關係曲線,曲線平坦部分對應的pH為適宜的
酸度範圍。
顯色時間
有些顯色反應較慢,需放置使其顯色完全。有些顯色
配合物不夠穩定,放置後會產生部分分解,導致吸光度降低,因此適宜的顯色時間必須通過實驗來確定。從加入
顯色劑計算時間,每隔幾分鐘測定一次吸光度,繪製A-t曲線,來確定適宜的時間。
干擾消除
主要有三種:利用掩蔽反應、分離干擾離子。
試劑分類
無機顯色劑
許多無機試劑能與金屬離子起顯色反應,如與
氨水反應生成深藍色的
配離子,但多數
無機顯色劑的靈敏度和選擇性都不高。其中性能較好。當有實用價值的無機顯色劑列於表7-1:
下表為常用的無機顯色劑
| | 滴定元素
| | 有色化合物組成
| 顏色
| 測定波長/nm
|
| 配位
| Fe(Ⅲ)
| 0.1~0.8
mol/L硝酸
| Fe(SCN)52-
| 紅
| 480
|
硫氰酸鹽
| 配位
| Mo(Ⅵ)
| 1.5~2mol/L硫酸
| MoO(SCN)5-
| 橙
| 460
|
硫氰酸鹽
| 配位
| W(Ⅴ)
| 同上
| WO(SCN)4-
| 黃
| 405
|
硫氰酸鹽
| 配位
| Nb(Ⅴ)
| 3~4mol/L鹽酸
| NbO(SCN)4-
| 黃
| 420
|
| | Si
| 0.15~0.3mol/L硫酸
| H4SiO4.
| 藍
| 670~820
|
| | P
| 0.5mol/L硫酸
|
| 藍
| 670~830
|
| | V(Ⅴ)
| | P2O5.V2O5.22MoO3.nH3O
| 黃
| 420
|
| | W
| 4~6mol/L鹽酸
| H3PO4.10WO3.W2O5
| 藍
| 660
|
| 配位
| Cu(Ⅱ)
| 濃氨水
| | 藍
| 620
|
| 配位
| Co(Ⅲ)
| 濃氨水
| Co(NH3)53+
| 紅
| 500
|
| 配位
| Ni
| 濃氨水
| Ni(NH3)62+
| 紫
| 580
|
| 配位
| Ti(Ⅳ)
| 1~2mol/L硫酸
| TiO(H2O2)2+
| 黃
| 420
|
| 配位
| V(Ⅴ)
| 0.5~3mol/L硫酸
| VO(H2O2)3+
| 紅橙
| 400~450
|
| 配位
| Nb
| 18mol/L硫酸
| Nb2O3(SO4)2.(H2O2)2
| 黃
| 365
|
有機顯色劑
大多數
有機顯色劑常與金屬生成穩定
螯合物,有機顯色劑中一般都含有
生色團和
助色團。有機化合物中的不飽和鍵基團能吸收波長大於200nm的光。這種基團稱為廣義的生色團。例如
偶氮基(- N=N-),醌基等。某些會有環對電子的基團,它們與生色團上的不飽和鍵相互作用,可以影響有機化合物對光的吸收,使顏色加深。這些基團稱為助色團。例如:胺基(-
NH2),
羥基(-OH)等,以及鹵代基(X-)等,它們能與生色團上的不飽和鍵相互作用,引起永久性的電荷移動,從而減小了分子的激化能,促使試劑對光的最大吸收向長波方向移動。所以這些基團稱為助色團。有機顯色劑是一般分析工作中常用的
顯色劑,它能與金屬離子生成
螯合物。具有以下優點:
⑴顏色鮮明。一般ε>104,靈敏度高。
⑷可被有機溶劑萃取,廣泛套用於萃取光度法。
屬於NN型螯合
顯色劑,是目前測定微量的較好顯色劑。顯色靈敏度高,ε=1.1*104,λmax=508nm可直接測定Fe2+。反應是特效的,適用還原劑(如鹽酸羥氨)將Fe3+還原為Fe2+,然後控制pH=5~6條件下,Fe2+與試劑作用,生成穩定的紅色
配合物。
屬於含硫顯色劑,能用於測定Cu2+、Pb2+、Zn2+、Cd2+、Hg2+等多種
重金屬離子。採用一致的
酸度及加入
掩蔽劑的辦法,可以消除重金屬離子之間的干擾。提高反應的選擇性。
反應靈敏度很高。如Pb2+的雙硫腙的配合物:
λmax=520nm q=6.6*104
屬
偶氮類螯合
顯色劑可在強酸型溶液中與Th(Ⅳ)、Zr(Ⅳ)、U(Ⅳ)等生成穩定的有色
配合物。也可以在弱酸性溶液中與
稀土金屬離子生成穩定的有色配合物。可用於測定稀土的總量。
 顯色反應
顯色反應
 顯色反應
顯色反應