基本介紹
- 中文名:鍵的極性
- 外文名:nonpolar covalent bond
- 起因:電負性
- 定義:正電荷和電子對重心不重合
基本內容
對分子影響

極性的關係



極性(polarity):物體在相反部位或方向表現出相反的固有性質或力量,對特定事物的方向或吸引力(如傾斜、感覺或思想);向特定方向的傾向或趨勢,對兩極或起電(如物體的...
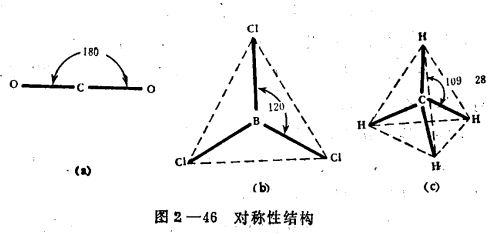
鍵的極性是由於成鍵原子的電負性不同而引起的。當成鍵原子的電負性相同或相近時,核間的電子云密集區域在兩核的中間位置附近,兩個原子核正電荷所形成的正電荷重心...
分子中正負電荷中心不重合,從整個分子來看,電荷的分布是不均勻的,不對稱的,這樣的分子為極性分子,以極性鍵結合的雙原子分子一定為極性分子,極性鍵結合的多原子分子...
在化合物分子中,不同種原子形成的共價鍵,由於兩個原子吸引電子的能力不同,共用電子必然偏向吸引電子能力較強的原子一方,因而吸引電子能力較弱的原子一方相對的顯正...
分子極性,即分子中正負電荷中心不重合,導致電荷的分布不均勻所產生的極性...... 在化學中,極性指一根共價鍵或一個共價分子中電荷分布的不均勻性。如果電荷分布得不...
鍵的極性和誘導效應是指由兩個處於相同化學環境中的原子形成的共價鍵,電子云對稱地分布在兩個成鍵原子之間,這種共價鍵沒有極性,稱為非極性共價鍵,如H-H 鍵、...
極性溶劑是指含有羥基或羰基等極性基團的溶劑,即溶劑分子為極性分子的溶劑,由於其分子內正負電荷重心不重合而導致分子產生極性。用於表征分子極性大小的物理量為偶極矩...
非極性分子是指偶極矩μ=0的分子,即原子間以共價鍵結合,分子裡電荷分布均勻,正負電荷中心重合的分子。分子中各鍵全部為非極性鍵時,分子是非極性的(O3除外)。...
一般認為共軛效應是共軛體系中由於軌道離域或電子離域所產生的鍵長平均化、體系內能變低。吸收光譜向長波方向移動,分子的折光率增大等效應。共軛效應可以沿著共軛鏈...
極性聚合物:狹義的極性聚合物一般指總偶極不為零的聚合物,廣義極性聚合物則指分子內具有較強極性鍵的聚合物。...
能表征化學鍵性質的物理量稱為鍵參數(bond parameter)。共價鍵的鍵參數主要有鍵能、鍵長、鍵角,此外還有鍵的極性和鍵級。...
鍵強度即化學鍵的強弱。有多種描述鍵強度的物理量如鍵能、鍵離解能以及鍵級等等。鍵能是化學鍵形成所放出的能量或化學鍵斷裂時所吸收的能量,它隱含著不同分子...
鍵接強度即化學鍵的連線強度,反應了化學鍵的強度。有多種描述鍵強度的物理量如鍵能、鍵離解能以及鍵級等等。鍵能是化學鍵形成所放出的能量或化學鍵斷裂時所...
原子通過共用電子對而形成的化學鍵叫電子對鍵,又叫共價鍵(covalent bonding)。兩原子間共用一對電子的共價鍵叫共價單鍵(single covalent bonding),共用兩對、三對...
鍵矩(bond moment)指雙原子分子中,兩個原子間的偶極矩。多原子分子的偶極矩由分子中全部原子和鍵的性質及其相對位置所決定。...
