發現歷史過程 鍆的合成首次由阿伯特·吉奧索、格倫·西奧多·西博格、Gregory R. Choppin、Bernard G. Harvey及Stanley G. Thompson(組長)在1955年初於加州大學伯克利分校成功進行。該團隊通過以α粒子撞擊Es創造了Md(半衰期為87分鐘),反應在伯克利放射實驗室的60寸回旋加速器(Md是單個原子逐一合成的第一個同位素)。元素101是第九個被合成的超鈾元素。鍆的首17個原子是用離子交換吸附洗脫法分離並分析的。過程當中,鍆的化學表現與銩的相似,自然產生的銩是鍆的同系物。
決定可行性 在估計該合成方法是否可行時,實驗團隊作出了粗略地計算。將會產生的原子數量,約為撞擊目標的原子數量,乘以截面,乘以離子束強度,乘以撞擊時長。結果為每次試驗會產生1顆原子。因此在最佳情況下,預測每一次試驗會製造出1顆元素101的原子。這樣的計算證明實驗是可行的。
反衝技術 鍆的合成使用了由阿伯特·吉奧索引入的反衝技術。目標元素置於與粒子束相反的位置,反衝的原子落在捕集箔上。所用的反衝目標用了由Alfred Chetham-Strode研發的電鍍技術生產。這種方法的產量很高,而這在產物是極為罕有的鑀目標材料的情況下是必須的。
反衝目標由10個Es組成,通過電鍍鋪在一張薄金箔上(也能使用Be、Al和Pt)。在位於伯克利的回旋加速器中,能量為41 eV的α粒子撞擊該目標,粒子束強度極高,在0.05cm的面積內每秒有6∙10顆粒子。目標用水或液態氫冷卻。在氣態大氣層中使用氦會減慢反衝原子的速度。該氣體可以通過小孔排出反應間,並形成氣體射流。一部分非揮發產物原子經由射流,積累在箔的表面。該箔片可以定期更換。發現鍆的實驗所用的反應為:Es +He →Md +n。
純化及離析 從採集箔片上取下鍆原子時可使用酸浸蝕法或完全溶解薄金箔。鍆的純化和離析能夠通過幾種方式進行。從鑭系裂變產物中分離出化合價為3的錒系元素時,能夠使用陽離子樹脂交換柱,其中用
鹽酸 飽和的90%水10%乙醇溶液作為
洗脫液 。要從採集箔片上快速採下鍆,可以使用陰離子交換色譜法,其中用6M鹽酸作為洗脫液。金則會在鍆與其他錒系元素通過時留在柱子上。最後還需要從其他化合價為3的錒系元素中分離出Md。分離元素99、100和101時,使用經過銨鹽處理的陽離子樹脂交換柱(陶瓦士50交換柱)。鍆在鐨之前一點洗脫出來,以此作出了鍆的化學識別。在一系列重複的試驗中,實驗團隊使用的洗脫液為α-羥基異丁酸(α-HIB)。若使用“氣體射流”的方法,則首兩步可以省略。用這一方法,可以在目標的幾十米以外在一秒以內採集並轉移個別產物原子。要有效地長距離轉移原子,需要在氣體射流中有較大的粒子(如氯化鉀噴霧)。在製造和分離鑀後元素時常使用這一方法。
另一個分離3+錒系元素的方法是溶劑萃取色譜法,用二(2-乙基已基)膦酸為固定有機相,而HNO3 為流動水溶相。錒系元素的洗脫順序與使用陽離子樹脂交換柱時相反。用這一方法的優勝之處是,分離出來的鍆不含有機錯化劑,用樹脂交換柱分離的則有。缺點是,鍆要在鐨之後,到整個順序的後期才會洗脫。
發現時刻 鍆並沒有被直接探測到,而是經過觀察自發裂變產物Fm探測的。這些事件都發生於1955年2月19日。第四次錄得的事件正式證實了第101號元素鍆的化學特徵。進一步的分析及實驗顯示,該同位素的質量數為256,並通過電子捕獲進行衰變,半衰期1.5小時。
元素概述
元素來源 鍆在自然界中不存在。用氦核轟擊鑀所獲得的鍆很少,但總算證明鍆確實存在。通常的合成方式是以
α衰變 撞擊
鑀 元素。
名稱由來 為紀念發明了
元素周期表 的科學家德米特里·伊萬諾維奇·
門捷列夫 (Dmitri Ivanov
鍆元素的名稱為了紀念化學家門捷列夫
元素描述 化學性質僅限於
示蹤量 ,在離子交換色譜上顯示出主要以+3價存在於
水溶液 中。此外,也有+2價和+1價。鍆的同位素主要有:鍆248~鍆258。
半衰期 從幾秒到大約55天。最穩定的同位素是258Md,半衰期為55天。
元素名稱:鍆
元素類型:金屬
Main Md+3
Other Md+2
元素中文名稱:鍆
元素英文名稱:Mendelevium
核電核數:101
所屬周期:7
所屬族數:IIIB
氧化物:
最高價氧化物:
密度:未知
熔點:未知
沸點:未知
顏色和狀態:金屬
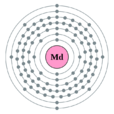
外圍電子排布: 5f13 7s2 核外電子排布: 2,8,18,32,31,8,2
同位素及
放射線 : Md-250[50s] Md-258(放 α)
電子親合和能: 0 KJ·mol-1
第一電離能 : 6500 KJ·mol-1 第二
電離能 : 0 KJ·mol-1 第三電離能: 0 KJ·mol-1
單質密度: 0 g/cm3 單質熔點: 0 ℃ 單質沸點: 0 ℃
特性 研究人員發現,鍆的氧化態除了有一般錒系元素的+3以外,還有中等穩定的+2。其+3氧化態在水溶液中為主導的狀態(所用方法為色譜法)。鍆甚至有時表現出+1的氧化態。使用Md能研究鍆在水溶液中的化學特性。其外鍆沒有任何已知套用,而至今也只合成了微量的鍆元素。其他的
同位素 也已被發現,它們都具有放射性,其中Md最為穩定,半衰期約為55日。另外的同位素的質量數從248到258不等,半衰期從幾秒鐘到51天不等。最初的Md半衰期為87分鐘。
金屬態 Johansson和Rosengren於1975年預測鍆金屬的化合價會主要為2,相似於
銪 (Eu)和
鐿 (Yb),而非3。在微量鍆元素上用熱色譜法的研究指出,鍆確實形成化合價為2的金屬。在經驗公式的幫助下,其金屬半徑預測為0.194 ± 0.010
nm 。估計的
升華熱 介乎134-142 kJ/mol之間。
溶液 在發現鍆之前,在水溶液中最穩定狀態的
化合價 為3。因此,它的化學特性預計與其他3+
錒系元素 及
鑭系元素 的相似。在
陽離子樹脂 交換柱中,化合價為3的錒系元素中,鍆在鐨前一點
洗脫 出來,證明了該預測。之後所發現到的有,不溶的鍆
氫氧化物 和
氟化物 ,與化合價為3的鑭系元素共同
沈澱 。該方法證實了鍆的化合價為3,且半徑小於鐨。利用經驗公式所預測的Md的
離子半徑 為0.0192 nm,
配位數 為6。再利用化合價為3的
稀土元素 的已知離子半徑,加上配位係數的
對數 和離子半徑之間的
線性關係 ,預計Md的平均離子半徑為0.089 nm;而用實驗模型及
玻恩-哈伯循環 所計算的
水化熱 為– (3654 ± 12) kJ/mol。在具
還原性 的環境下,鍆表現出不尋常的化學特性。與
BaSO4 的共沈和使用的溶劑萃取色譜實驗在不同的還原劑中進行。結果顯示,Md在水溶液中能夠容易還原為穩定的Md。在水加乙醇溶劑中,鍆也可以還原為
化合價 為1的狀態。Md和化合價為2的離子的
共結晶 是由於混合晶體的產生。Md的離子半徑為0.117 nm。從Md+到Md3+的氧化反應並未成功。
同位素 已辨認的16個鍆原子質量數在245到260之間,最穩定的為
半衰期 為51.5天的Md、31.8天的Md及5.52小時的Md。其餘的
放射性 同位素的半衰期都小於97分鐘,大部分都小於5分鐘。該元素還有5個亞穩態,其中最穩定的為Md(半衰期為58分鐘)。鍆同位素的
原子量 從 245.091
u (Md)到260.104 u(Md)。
元素用途 目前尚未發現什麼實際用途。
 鍆元素的名稱為了紀念化學家門捷列夫
鍆元素的名稱為了紀念化學家門捷列夫